北京地區健康絕經期前女性骨轉換標志物P1NP和β-CTX的參考區間分析
張然星 李漢蓮 魏戌 高景華 謝雁鳴 韓艷 史穎紅 游珂
1.中國中醫科學院望京醫院,北京 100102 2.中國中醫科學院中醫臨床基礎醫學研究所,北京 100700
骨的重建是破骨細胞吸收舊骨與成骨細胞合成新骨的動態偶聯過程,骨組織受激素信號、旁分泌和自分泌因子及物理壓力的刺激,在基本多細胞單位中完成吸收與合成的相互轉換,從而保證其礦化平衡與結構完整,并通過精確有序的調節機制維持其正常骨量和生理功能[1-3]。在此過程中的代謝產物以不同濃度和結構方式分布于骨骼、血液、尿液或其他體液中,因此,臨床上可以通過檢測血液或尿液中的骨代謝產物和相關激素,間接推斷骨骼的各種代謝狀態。這些可被檢測的骨代謝產物與相關激素統稱為骨代謝生化標志物或骨代謝標志物,其中能反映骨轉換狀態的指標稱為骨轉換標志物(bone turnover markers,BTMs)[4]。大量臨床試驗已證實,BTMs在骨質疏松性骨折的風險預測及抗骨質疏松藥物的療效監測等方面具有潛在的重要價值[4-5]。國際骨質疏松基金會(IOF)和國際臨床化學聯合會(IFCC)的骨標志物標準化工作組推薦血清I型原膠原氨基端前肽(procollagen type 1 N-terminal propeptide, P1NP)和I型膠原羧基端肽交聯(β cross-linked C-telopeptide of type 1 collagen, β-CTX)作為骨轉換參考性標志物,強調需要對兩者建立國際參考標準,協調不同檢測方法及研究結果的一致性,從而更好地評估其臨床應用效能,擴大其在相關領域的應用經驗[4]。
研究表明,在骨質疏松癥的藥物療效監測中,作為“金標準”的骨密度(bone mineral density, BMD)對藥物干預作用的響應不及BTMs敏感。在骨質疏松性骨折風險預測中,BTMs水平的變化可疊加或獨立于BMD測量,提高風險評估的可信度[6-8]。然而,由于BTMs檢測易受到顯著的分析前和分析變異,以及個體內生物學變異的影響[9],加之其檢測系統尚缺乏統一的國際標準[4],這都極大地限制了其在臨床中的廣泛應用[10]。在BTMs參考標準的建立過程中,如何確定不同人群的生物學參考區間無疑是一個核心問題[11]。絕經后女性是原發性骨質疏松癥的高危人群,在對這部分人群骨質疏松的防治和管理過程中,需要健康絕經前女性BTMs的參考區間作為參照標準和評價依據。目前,BTMs水平在不同年齡階段呈現不同程度的變化和分布趨勢已成為共識[12-21],因此建立健康絕經期前女性BTMs參考區間的關鍵首先是要準確界定其變化和分布趨勢趨于相對穩定的特異年齡階段,再以此特異年齡階段的健康人群作為參考人群,篩選參考個體,形成參考樣本組,獲得參考值,最終得到參考分布,參考限和參考區間。另外,研究顯示[15,17,20],BTMs水平在不同種族、不同生活方式的國家和地區人群及不同檢測系統之間都可能表現出顯著差異。而目前國內臨床實驗室在開展BTMs檢測過程中,檢測項目的參考區間多由試劑廠商依據國外相關研究提供,近幾年雖陸續有符合中國人群特征參考區間建立的報道,但罕見有北京地區健康女性絕經期前參考區間的研究[22-25]。
鑒于此,本研究選擇北京地區健康絕經期前女性體檢人群作為研究對象,通過觀察不同年齡組血清BTMs水平的分布趨勢差異,確定參考人群的特異年齡階段,并初步建立北京地區健康絕經期前女性骨轉換標志物P1NP和β-CTX羅氏電化學發光法檢測系統的參考區間,進而為臨床實驗室如何建立骨轉換標志物的參考區間提供經驗與借鑒。
1 資料和方法
1.1 研究對象
選擇2015年8月至2016年8月在中國中醫科學院望京醫院體檢中心體檢的健康絕經前女性作為招募對象,經調查問卷及體檢篩查,確定符合入選標準的272名北京地區健康絕經前女性作為研究對象,每位入選受試者至少在京居住5年。納入標準:(1)30~54歲月經周期正常女性;(2)愿意接受研究方案,并同意進行有關檢查(如骨密度、血清骨轉換標志物、肝腎功能、血糖等);(3)自愿簽署知情同意書。排除標準:(1)BMD經雙能X線吸收測量法(DXA)測量,腰椎和髖部骨量異常,T值<-1;(2)患有全身代謝性骨骼疾病;(3)半年內用過影響骨代謝藥物;(4)兩年內有外傷引起的骨折;(5)患有影響骨代謝的慢性疾病如糖尿病、類風濕性關節炎、甲旁亢、甲亢及其他需要長期治療的慢性疾病;(6)患有嚴重心、腦血管疾病;(7)肝腎功能異常;(8)患有慢性胃腸道疾病;(9)近期有急慢性感染過敏;(10)1年內應用避孕藥或懷孕;(11)當前或3個月內在哺乳期;(12)有長期吸煙和飲酒習慣;(13)2~3天內有劇烈運動;(14)嚴重的器質性疾病、精神神經系統疾病和活動性骨關節病。
1.2 研究方法
1.2.1問卷調查:所有受試者簽署知情同意書后,在醫生協助下填寫調查問卷。調查問卷的基本內容包括:受試者出生日期、身高(cm)、體重(kg)、體重指數=體重(kg)/身高(m)2、月經周期、生活方式、飲食習慣及相關體檢結果資料。
1.2.2常規生化指標及骨轉換標志物檢測:每名受試者于體檢當日清晨8:00~9:00空腹采集兩個真空采血管(每管4 mL)的靜脈血,離心3000 rpm,5 min,分離血清后,其中1管血清采用羅氏C702生化檢測系統檢測肝腎功能、血糖、血鈣、血磷;另一管血清于-80 ℃冰箱凍存,全部樣本收集結束后同一時間采用羅氏E602免疫檢測系統測定血清P1NP與β-CTX。檢測過程嚴格按照IOF/IFCC提出的骨轉換標志物檢測的相關要求,盡量減少可控變異因素以保證實驗數據的準確性。檢測所用試劑為羅氏E602免疫檢測系統專用試劑盒,實驗步驟按照試劑盒說明書進行。檢測不精密度為:P1NP的日內CV:1.7%~3.2%,日間CV:2.3%~3.7%;β-CTX日內CV:1.2%~4.7%,日間CV:1.7%~5.7%。最低檢測限為:P1NP:5 ng/mL;β-CTX:0.01 ng/mL。
1.2.3骨密度檢測:應用美國GE公司雙能X線(DXA)骨密度儀,測定正位腰椎(L2~L4)和雙側股骨近端,即股骨頸(Neck),Ward’s 三角區,大轉子(Troch),獲取以下參數:骨密度(g/cm2)、T-值評分、Z-值評分。儀器精度1%,重復測量誤差<1%。根據WHO推薦的骨量判斷標準:T≥-1.0時,骨量正常;-2.5≤T<-1.0時,骨量減少;T<-2.5時,骨質疏松。
1.3 數據管理與統計分析
數據管理與統計分析均由第三方中國中醫科學院中醫臨床基礎醫學研究所負責。應用Epidata3.0數據庫對數據進行獨立雙人雙錄入,經一致性檢驗審核通過后鎖定數據庫,采用SPSS 20.0軟件進行統計分析。所有的統計檢驗均采用雙側檢驗,P≤0.05被認為具有顯著統計學差異,數據是否符合正態分布通過Kolmogorov-Smirnov檢驗來進行判斷。運用局部加權回歸散點平滑法(locally weighted scatterplot smoothing,LOWESS)描述P1NP與β-CTX水平隨年齡變化的分布趨勢,采用Kolmogorov-SmirnovZ檢驗比較不同年齡段間P1NP與β-CTX水平的分布差異,從而得出P1NP與β-CTX水平分布趨勢相對平穩的特異年齡段。隨后按照CLSI發布的C28-A3文件中關于醫學實驗室參考區間建立的具體要求,計算得出P1NP和β-CTX的參考限及參考限90%的可信區間。
1.4 倫理審查與臨床研究注冊
本項臨床研究于2014年12月24日經中國中醫科學院望京醫院醫學倫理委員會審查批準,同意該項研究的實施(批件號WJEC-KT-2014-026-P002)。調查對象按照自愿參加的原則,全部簽署知情同意書。2015年5月10日在中國臨床試驗注冊中心完成臨床研究注冊(注冊號ChiCTR-DOC-15006377)。
2 結果
2.1 受試者篩選
根據受試者納入與排除標準,636名體檢的絕經期前女性參與篩選。427名受試者參與臨床篩選,最終納入健康絕經期前女性受試者272名。
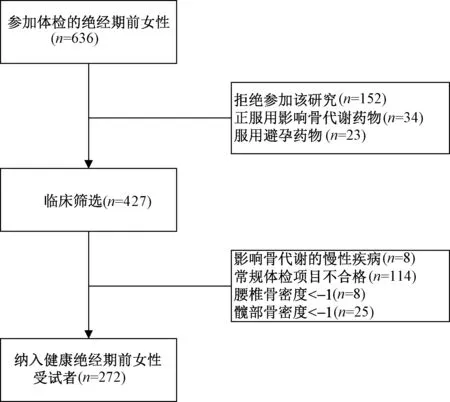
圖1 受試者篩選流程圖Fig.1 The flow-chart of the subject screening.
2.2 研究人群基本特征
共納入北京地區健康絕經前女性272人,受試者年齡為(39.51±5.85)歲,身高為(161.97±4.48)cm,體重為(59.74±7.97)kg,體重指數為(22.77±2.86)kg/m2,血鈣(2.27±0.12)mmol/L,血磷(1.11±0.16)mmol/L(表1)。

表1 研究人群基本特征(n=272)Table 1 The levels of P1NP and β-CTX in the study subjects (n=272)
2.3 研究人群P1NP與β-CTX水平
經Kolmogorov-Smirnov檢驗,總人群中P1NP與β-CTX水平均不符合正態分布(P=0.000)。P1NP水平的中位數為34.30 ng/mL(95%CI:32.94~35.74 ng/mL),β-CTX水平的中位數為0.24 ng/mL(95% CI:0.23~0.26 ng/mL)(表2)。

表2 研究人群P1NP與β-CTX水平(n=272)Table 2 The levels of P1NP and β-CTX in the study subjects (n=272)
2.4 P1NP與β-CTX水平隨年齡變化趨勢比較
運用LOWESS法繪制P1NP、β-CTX水平隨年齡變化的擬合曲線圖(圖2~3),從圖中大致可以看出35~45歲之間兩種骨代謝標志物水平的分布趨勢相對平穩。同時,運用Kolmogorov-SmirnovZ檢驗比較35~39歲與40~44歲的P1NP與β-CTX水平的分布趨勢,無顯著統計學差異(P>0.05),因此根據年齡分組情況將35~39歲與40~44歲兩個年齡段進行合并,進一步采用Kolmogorov-SmirnovZ檢驗比較不同年齡段間P1NP與β-CTX水平的分布趨勢。
結果顯示β-CTX水平各年齡組比較,在30~34歲與35~44歲組有顯著統計學差異(P=0.015<0.05),其余各組間比較無顯著統計學差異(P>0.05);P1NP水平各年齡組比較,在45~49歲與35~44歲組有顯著統計學差異(P=0.034<0.05),其余各組間比較無顯著統計學差異(P>0.05)(表3)。
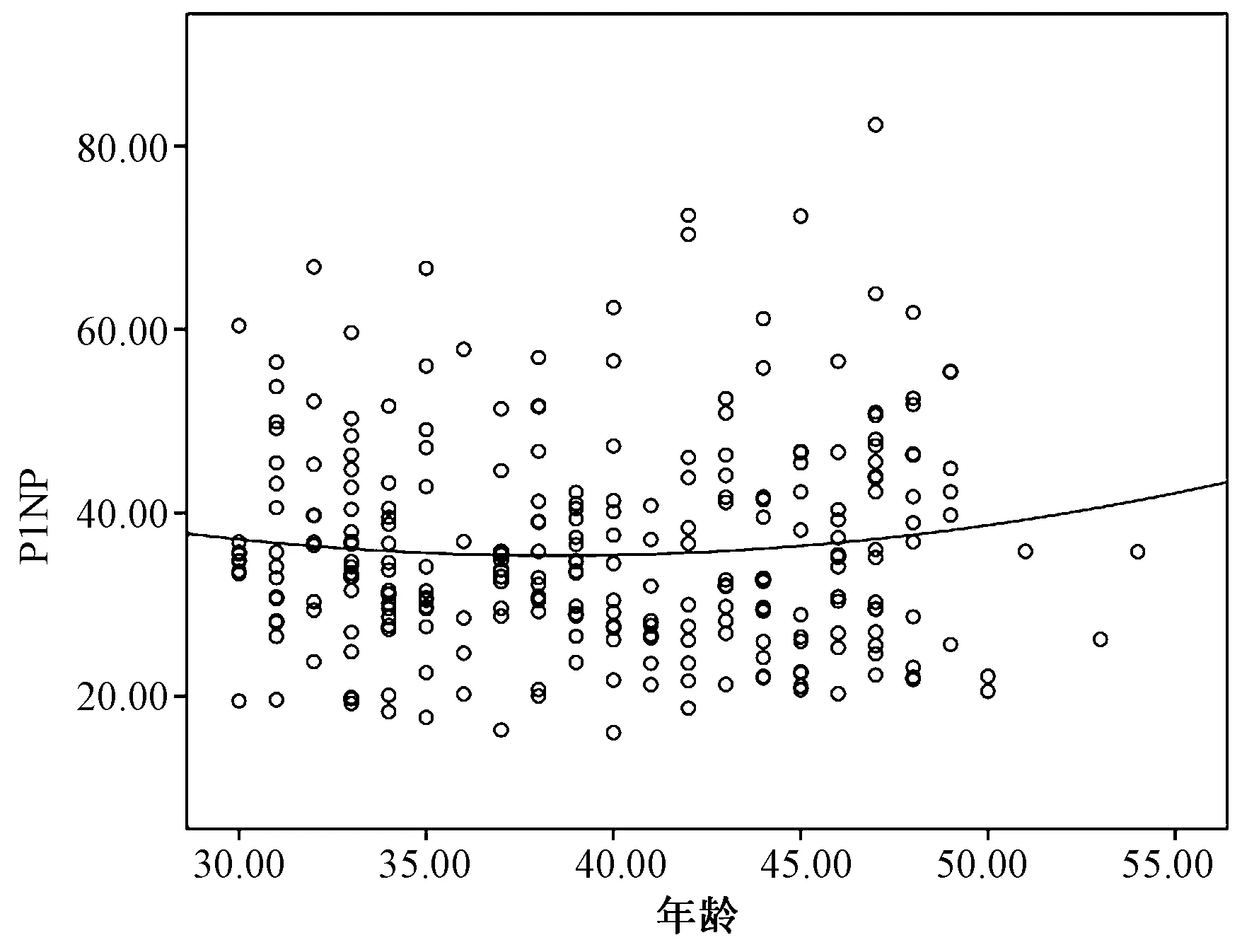
圖2 P1NP水平隨年齡變化的擬合曲線圖Fig.2 Plot of P1NP level following the change of age
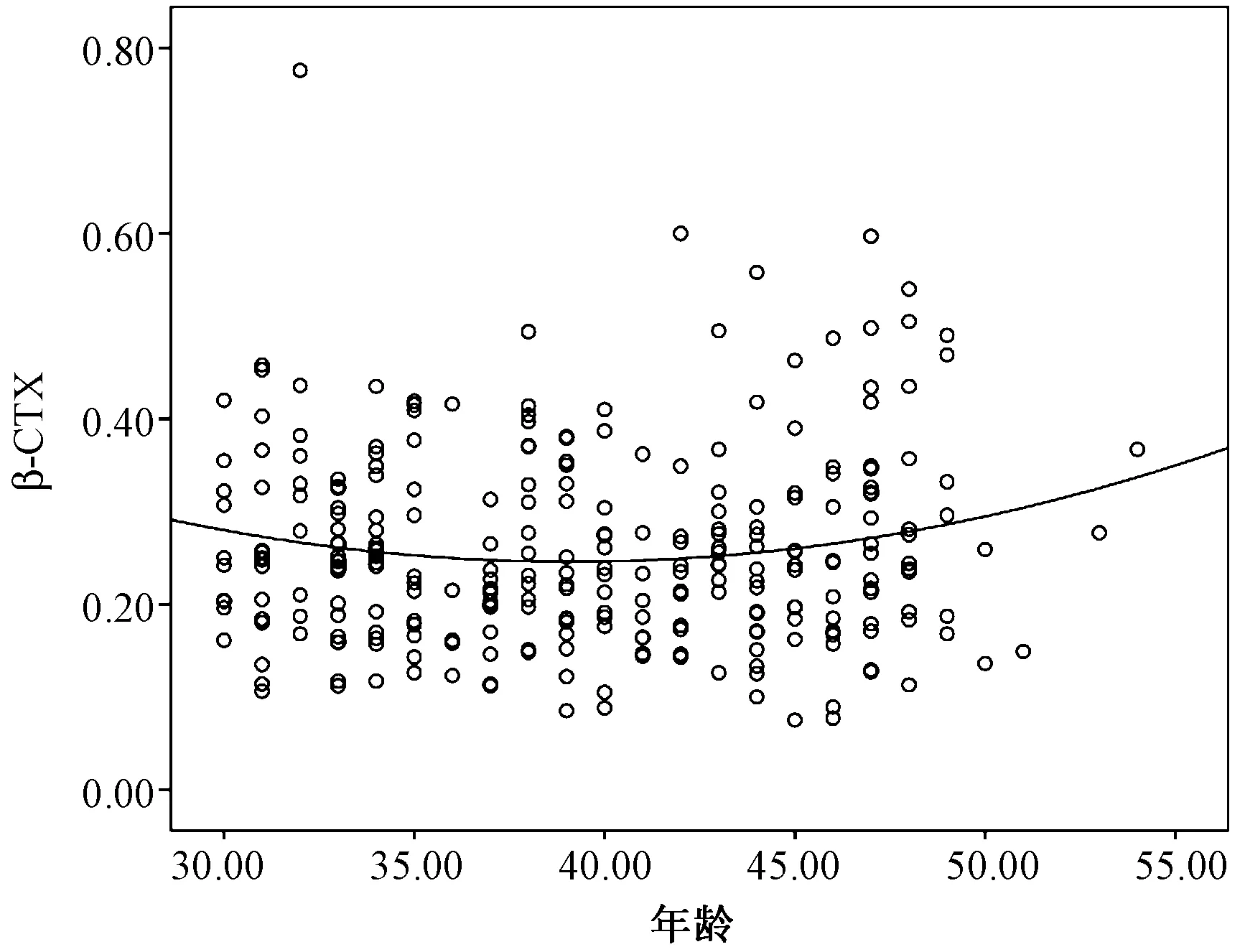
圖3 β-CTX水平隨年齡變化的擬合曲線圖Fig.3 Plot of β-CTX level following the change of age
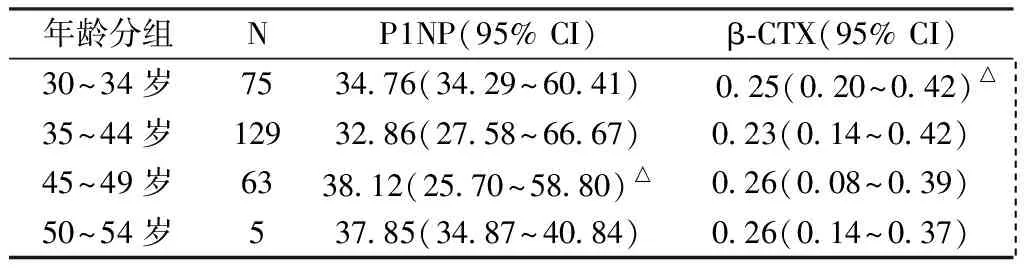
表3 不同年齡段P1NP與β-CTX水平比較Table 3 Comparison of P1NP and β-CTX among different age groups
注:與35~44歲相比,△P<0.05,其余P>0.05。
2.5 P1NP與β-CTX水平的參考限、參考限90%可信區間
根據上述結果,以35~44歲年齡組健康絕經期前女性作為參考人群,P1NP水平的參考區間為17.95~65.60 ng/mL,β-CTX水平的參考區間為0.10~0.49 ng/mL;P1NP與β-CTX水平的參考限、參考限90%可信區間見表4。
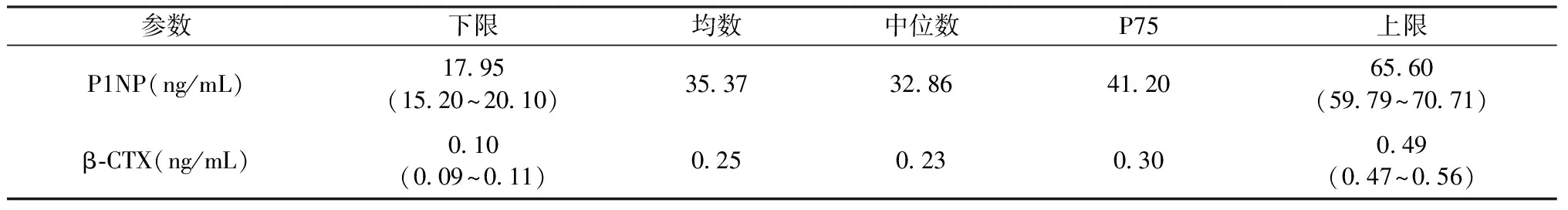
表4 P1NP與β-CTX水平的參考限、參考限90%可信區間Table 4 The reference interval value of P1NP and β-CTX (CI 90%)
3 討論
參考區間是臨床實驗室解釋檢驗報告的一個“決策支持工具”[26]。建立代表健康成年人BTMs真實表達水平的參考區間,對于推進BTMs的臨床應用具有重要的現實意義。多數前瞻性隊列研究證實,與健康絕經前女性BTMs參考區間的上限比較,絕經后女性非治療者BTMs水平升高程度可預測遠期發生骨折風險的大小[8]。絕經后骨質疏松癥藥物療效監測的一個主要目標就是將患者BTMs水平降至健康絕經前女性參考區間的“下半段”,即低限值到均值之間的范圍內[4]。
在參考區間的建立過程中,固有生物學變異對參考值的影響不容忽視,因為它決定了不同個體,甚至同一個體不同生理時期、不同生命階段具有變異性[27]。對參考個體進行分組可有效減少個體間變異的影響,從而減少“受影響個體”與“正常個體”之間判別值的重疊,提高參考區間在實際應用中的參考價值[3]。女性在30歲之前可由骨骼發育尚未完全成熟而致BTMs的水平偏高,而在45歲之后開始進入圍絕經期,雌激素水平的顯著下降致破骨細胞活性增強,使BTMs的水平再次進入顯著升高階段[28-30]。因此,健康絕經前女性BTMs參考區間的建立是以年齡分組為前提的,IOF推薦其參考人群應為30~45歲之間BMD正常的人群[28]。由此可見,即使是在絕經期前,只有受變異因素影響最小的特異年齡段的健康人群,才適宜作為建立BTMs參考區間的參考人群。本研究應用IFCC推薦的前瞻性采樣法,通過隨機選擇,按照納入及排除標準篩選出272名符合條件的30到54歲的受試者,并以5歲為一個年齡階段對受試者進行分組,這與國際相關研究的年齡分組方式相同,研究人群的基本特征代表了北京地區健康絕經期前女性的自然狀態。同時,本研究選擇了目前公認的具有較高靈敏度和特異性的電化學免疫分析技術來測定受試者血清P1NP與β-CTX水平,并通過嚴格的排除標準、分析前質量控制和標準化操作盡量減少導致BTMs水平出現變異的可控因素。結果顯示,受試者血清P1NP與β-CTX整體水平的中位數分別為34.30(95% CI:32.94~35.74)ng/mL和0.24(95% CI:0.23~0.26)ng/mL。這與Li等[23]的研究結果存在差異,該研究報道的30歲至絕經前的中國五個地區健康女性人群血清P1NP與β-CTX整體水平的中位數分別為40.42(95% CI:17.1~102.15)ng/mL和0.26(95% CI:0.08~0.72)ng/mL。經分析,筆者認為上述差異可能來自于篩選受試者時所使用的納入與排除標準的差異。
目前證實,骨量異常者和正常人群的BTMs水平具有顯著的重疊性[31],這表明在確定參考人群年齡組過程中,更為準確的方法應該是通過比較各組BTMs水平的分布趨勢來判斷變異因素影響最小的年齡組,而不是只比較組間BTMs水平的均值/中位數是否存在差異[13,16,19,22]。因此,本研究通過LOWESS法繪制BTMs水平隨年齡變化趨勢的擬合曲線圖,并應用Kolmogorov-SmirnovZ檢驗比較35~39歲與40~44歲年齡段及35~44歲年齡段與其他年齡段BTMs水平的分布趨勢差異。結果顯示,P1NP與β-CTX水平隨年齡的增加均呈現出底部平緩的“波谷樣”分布趨勢,谷底的最低點均出現在40歲,位于35~44歲的中間位置。進一步與兩者35~44歲的水平比較,P1NP與β-CTX水平具有統計學意義的分布趨勢差異分別出現在30~34歲及45~49歲年齡組。由于骨重建是骨形成與骨吸收的動態偶聯過程,因此,基本能夠證明不論是骨形成標志物P1NP水平,還是骨吸收標志物β-CTX水平,35~44歲是兩者分布趨勢趨于相對平穩,受變異因素影響最小的年齡段,該年齡段的人群更適合作為建立健康絕經期前女性BTMs參考區間的參考人群,這一結論與Ardawi等[16]的研究結果相似,其報道的沙特絕經前女性參考人群年齡階段為35~45歲。另外,Michelsen等[19]的研究雖然使用了不同于羅氏的檢測系統,但其用于判斷德國女性絕經前參考人群特異年齡段的方法、結論與本研究相同。
在計算參考區間時,由于大多數參考值不是正態分布,美國臨床和實驗室標準協會(CLSI)和IFCC均推薦使用非參數統計方法計算參考區間,定義參考區間為參考值數據95%的分布范圍,即2.5%~97.5%位數所在的區間,并要求參考樣本組至少包括120個參考數據, 這也是估計出參考上限和下限90%可信區間的最低保證[32]。本研究中,參考樣本的選擇遵循了上述方法和原則,經BTMs水平隨年齡變化趨勢分析,最終確定的參考樣本組包含了129個P1NP和β-CTX的參考值。進而我們采用非參數方法并結合實際臨床意義,建立兩者的雙側95%參考區間。值得注意的是,在確定參考區間的參考限時,需要同時估計參考限的可信區間。這是因為,選擇受試者樣本進行參考限的計算,就是對研究人群相應百分數的評估,從同樣人群中的其它抽樣也許會得出稍微有些不同的參考限。因此,CLSI C28-A3指南中強調[32],一個非常有效的方法是通過計算樣本中百分位數的可信區間,來識別和評定樣本估算時的可變性。兩個理由揭示了可信區間的必要性:首先,能夠提示研究人員進行變異性評估并提供可變性評估的定量測定方法。其次,當采集的樣本量增加時可信區間就會變窄。因此,研究人員可以采取增加參考個體的樣本含量來提高評估的參考區間的精密度。本研究中,P1NP與β-CTX參考區間均值及其可信區間分別為35.37(95% CI:33.57~37.37)ng/mL,0.25(95% CI:0.23~0.27)ng/mL,這與Hu等[22]報道的上海地區健康絕經前女性參考區間的均值及可信區間相似,兩者分別為:35.22(95% CI:30.67~40.10)ng/mL,0.242(95% CI:0.218~0.297)ng/mL。但本研究所建立的參考區間與試劑廠商提供的參考區間相差較大,試劑廠商提供的參考區間來自于OFELY研究[33-35]。這也再次證實,臨床實驗室在進行BTMs檢測時需建立滿足自身條件和符合本地人群特征的參考區間。
骨轉換標志物能夠成功應用于臨床試驗和實踐需要最大程度提高其檢測準確性、精確性和可比性。檢測系統的標準化和協調化可使不同地區、不同時間、不同實驗室的檢測結果具有可比性。IOF和IFCC推薦在國際范圍內建立BTMs的參考性檢測系統,此過程中主要包括:制備初級和次級參考物,控制分析前變異因素,協調研究結果一致性,建立健康人群的參考區間及評價BTMs的臨床應用價值等[4],這將有助于BTMs檢測臨床實踐指南的制定與實施。Bauer等[11]指出,在健康年輕人群中建立更為穩健的參考區間極為必要,因為確定“非正常”范圍首先要明確何為“正常”范圍,來自于大樣本的健康年輕人群的BTMs參考區間可以更好的解釋骨轉換標志物與臨床評價的相關性。Morris等[5]回顧既往研究表明,在BTMs參考區間建立過程中不同的納入與排除標準、不同的樣本采集程序、不同的檢測系統所致的研究結果存在一定差異。本研究的局限性在于:(1)在受試者體檢篩查過程中,并未對甲狀旁腺素與1,25-二羥維生素D3進行檢測;(2)參考樣本的數量為129例,僅能滿足評估參考限90%可信區間的最低要求;(3)受試者主要來源于城市地區,農村地區的入選人數相對偏少。
本研究通過對北京地區30~54歲健康女性絕經期前血清骨轉換標志物P1NP和β-CTX水平在不同年齡段分布趨勢差異分析,證實了35~44歲為兩者分布趨勢趨于平穩且受變異因素影響最小的年齡段,進而以此年齡段健康女性為參考樣本初步建立了血清P1NP和β-CTX的參考區間及其高、低限的可信區間。本研究可為北京地區女性骨質疏松癥防治和管理提供參考依據,并為基層臨床實驗室建立骨轉換標志物標準化檢測程序提供借鑒。另外,如何協調BTMs參考區間在不同檢測系統之間的一致性及如何提高其在骨質疏松癥個體化治療中的實際臨床應用價值還有待于進一步的深入研究。

