去鐵胺對輸血相關性鐵過載患者骨密度的影響
陳愛華 趙國陽* 莊琴 張鵬 徐又佳
1. 江蘇大學附屬醫院骨科,江蘇 鎮江 212001 2. 江蘇大學附屬醫院血液科,江蘇 鎮江 212001 3. 蘇州大學附屬第二醫院骨科,江蘇 蘇州 215004
以往研究[1-3]發現,鐵過載可導致骨質疏松癥的發生和發展,降低鐵過載可有助于改善骨質疏松。臨床上降低鐵過載的方法是使用鐵螯合劑。在幾種鐵鰲合劑中,去鐵胺(deferoxamine, DFO)是目前臨床應用時間最長、使用最廣泛的鐵螯合劑。但是,DFO對骨密度的作用如何,能否應用于伴有鐵過載的骨質疏松患者的治療,目前尚缺乏全面、系統的研究。
輸血相關鐵過載是臨床上繼發性鐵過載最為常見的原因,這些患者在血液科需要DFO降鐵治療以保護器官功能、延長生存時間。目前研究發現,輸血相關鐵過載患者中骨密度減低較為常見[4,5];但是,在DFO降鐵治療過程中,臨床上往往只關注這些患者鐵負荷水平的變化,而對降鐵治療后骨密度的變化則缺少研究。本研究從DFO已經廣泛應用的血液科輸血相關鐵過載患者入手,觀察這些患者在DFO降鐵治療前后骨密度和血清生化指標的變化,探討DFO對輸血相關鐵過載患者骨量的影響,為DFO用于伴有鐵過載的骨質疏松癥患者的研究提供基礎、依據和治療經驗。
1 材料和方法
1.1 研究對象
收集2011年7月至2017年7月我院血液科反復輸血繼發性鐵過載患者臨床資料。納入標準:①基礎疾病為再生障礙性貧血、骨髓增生異常綜合征或原發性骨髓纖維化,累計輸注15~20 U紅細胞以上,血清鐵蛋白(Fer)超過1000 ng/mL以上;②使用去鐵胺降鐵治療6個月以上,血清Fer降至1000 ng/mL以下。排除標準:①原發性鐵蓄積;②原發或DFO治療過程中出現性腺功能減退、腎上腺皮質功能減退、甲狀旁腺功能減退;③DFO治療過程中使用雙膦酸鹽、降鈣素、特立帕肽等抗骨質疏松藥物;④使用地拉羅司、去鐵酮等其他降鐵藥物治療。經篩選,本研究共選取合格研究對象22例。
1.2 檢測指標與方法
收集患者DFO治療前后血液樣本檢測的數據。血清Fer采用電化學發光法檢測,儀器為ROCHE cobas 600;血紅蛋白(Hb)采用半導體激光散射技術和細胞化學染色技術檢測,儀器為Mindray BC-5380;血清堿性磷酸酶(ALP)、白蛋白(Alb)、谷丙轉氨酶(ALT)、谷草轉氨酶(AST)、離子鈣(iCa)均采用酶動力法檢測。
收集患者DFO治療前后骨密度檢測數據。使用美國Lunar公司雙能X線骨密度儀。測定部位為股骨頸和腰椎(L1-L4),儀器自動生成T值。根據WTO骨質疏松癥診斷標準,T值≥-1.0SD為骨量正常、T值在-1.0SD~-2.5SD之間為骨量減少、T值≤-2.5SD為骨質疏松。
1.3 去鐵胺降鐵治療方法
甲磺酸去鐵胺(DFO,諾華制藥) 500 mg加入5~7 mL生理鹽水中,25~60 mg/kg(具體劑量根據患者鐵蛋白和體重水平計算,維持治療指數小于0.025)微量泵皮下注射,每次維持8 h,每月治療20 d,間隔10 d。監測血清Fer水平,當血清Fer<1000 ng/mL時停用DFO治療。
1.4 統計學處理
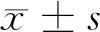
2 結果
2.1 基線資料
本研究共入選患者22例(見表1),其中男性14例,女性8例,平均年齡為61.9歲;接受反復輸血治療后,血清Fer明顯升高,達到平均2019.95 ng/mL,符合鐵過載診斷標準;DFO降鐵治療時間最少0.5年,最多長達9年;降鐵治療前5例(23%)患者合并糖尿病,12例(55%)患者存在骨量減少,6例(27%)患者存在骨質疏松癥;Hb、Alb分別平均為61.02 g/L和36.03 g/L,低于正常水平,其他血清生化指標ALP、ALT、AST、iCa尚處于正常水平。

表1 患者一般資料Table 1 The general characteristics of the subjects
2.2 去鐵胺治療前后骨密度以及血清生化指標變化分析
患者經DFO降鐵治療后血清Fer明顯下降,由基線水平的2019.95±630.77 ng/mL降至843.61±91.01 ng/mL,差異有統計學意義(P<0.05);股骨頸和腰椎(L1-L4)骨密度分別由基線水平的0.73±0.12 g/cm2、0.92±0.14 g/cm2升高至0.77±0.09 g/cm2、0.94±0.14 g/cm2,差異有統計學意義(P<0.05);Hb、血清Alb、ALP、ALT、AST和iCa在DFO治療前后無明顯變化(P>0.05);1例患者在DFO治療期間新出現糖尿病并發癥;DFO治療結束后骨量正常、骨量減少和骨質疏松患者分別由治療前的4、12、6例變為治療后的10、11、1例,差異有統計學意義(P<0.05)(表2)。治療前后骨量正常、骨量減少和骨質疏松患者的比例變化如圖1所示。
表2 去鐵胺治療前后骨密度和血清生化指標比較Table 2 Comparison of bone mineral density and biochemical indexes between baseline and the end of DFO treatment
注:與治療前比較,*P<0.05

圖1 去鐵胺(DFO)治療前后骨量正常、骨量減少和骨質疏松患者分布條圖Fig.1 Comparison between number of normal osteopenia and osteoporotic patients at baseline and the end of DFO treatment
3 討論
再生障礙性貧血、骨髓增生異常綜合征和原發性骨髓纖維化是臨床上常見的慢性貧血性疾病。隨著病情的進展,這些患者往往需要長期的紅細胞輸注以維持生存。一般認為,一個單位紅細胞含有200~250 mg鐵,由此計算在輸注15~20個單位紅細胞后大部分患者就會發生鐵過載。按中華醫學會血液分會標準,血清Fer超過1000 ng/mL為病理性鐵過載[6],在本研究中,筆者選擇血液科再生障礙性貧血、骨髓增生異常綜合征和原發性骨髓纖維化3類患者,這些患者累計輸注紅細胞累計在15~20個單位以上,而且血清Fer超過1000 ng/mL,因此符合輸血相關鐵過載的診斷標準。為排除內分泌系統疾病對骨密度的影響,筆者排除了合并性腺功能減退、腎上腺皮質功能減退和甲狀旁腺功能減退患者。首先我們分析了22例患者的DFO治療前的基線特征,發現他們的平均Hb和Alb低于正常水平,血清Fer水平平均高達2019.95 ng/mL,與慢性貧血、鐵過載的特征相符;在22例患者中,骨質疏松患者6例,約占27%,骨量減少患者12例,約占55%,骨量正常患者僅為4例,約占18%,提示在這些鐵過載患者中存在低骨量現象,這與筆者以往的研究結果類似[7],低骨量的原因一般認為與高鐵負荷導致成骨細胞的骨形成功能抑制和破骨細胞的骨吸收功能增強有關[8,9]。這些患者在經過DFO有效的鐵螯合治療后,血清Fer明顯下降,平均降至843.61 ng/mL,有意義的是患者的股骨頸和腰椎的骨密度增加,骨量下降得到改善。筆者認為,DFO降低體內的鐵水平后,由于高鐵負荷對骨代謝的抑制作用減輕,骨量得到部分恢復。2016年,廖慶輝等[10]使用DFO干預骨質疏松老年女性患者,發現在DFO治療后患者股骨頸和腰椎的骨密度明顯增加,而且DFO治療組骨密度增加的幅度明顯高于常規治療的對照組。2014年,Chen等[11]使用枸櫞酸鐵銨干預制造鐵過載斑馬魚幼魚模型,發現鐵過載斑馬魚幼魚的骨形成受到明顯抑制,在使用DFO降低斑馬魚體內的鐵負荷后,斑馬魚的骨量增加,骨形成能力部分恢復。近年來研究發現,DFO除了對通過降低鐵負荷改善骨質疏松外,尚存在對骨代謝直接的作用。2008年,Qu等[12]研究發現,DFO可影響成骨細胞內的經典Wnt/β-catenin信號通路,促進成骨細胞分化。2012年,Zhang等[13]研究發現,骨內植物上涂以DFO,可顯著增加新骨的形成,促進骨折的愈合。2012年,筆者的研究也顯示,DFO在一定濃度范圍內可促進成骨細胞的增殖、礦化和成骨相關基因的表達[14]。綜上,筆者認為,本研究中,DFO治療后的骨量好轉可能也與DFO對骨組織的直接作用有關。
在本研究中,由于經過嚴格的病例篩選,所研究的樣本量比較少,鐵過載評價指標僅使用血清Fer,未進行肝臟、心臟等實質臟器的鐵負荷檢測,而且,在評價骨密度的同時,也未觀察骨代謝或骨轉化指標的變化,這些是本研究的局限。
總之,輸血相關鐵過載患者多伴有骨量下降,去鐵胺降鐵治療可部分改善這些患者的低骨量狀態。本研究為去鐵胺可能用于伴有鐵過載的骨質疏松癥的輔助治療提供了有意義的支撐。

