L-鼠李樹膠糖-1-磷酸醛縮酶立體選擇性的半理性改造合成D-阿洛酮糖
汪馬燕,李子杰,高曉冬
(江南大學 生物工程學院,糖化學與生物技術教育部重點實驗室,江蘇 無錫,214122)
目前,肥胖、高血脂、高血壓和糖尿病等疾病的發病率迅速增加,主要原因是過度攝入高脂肪和高糖的食物。因此,低熱量的稀有糖(rare sugar)引起了廣泛關注。國際稀有糖協會(ISRS)對稀有糖的定義:自然界中存在但含量極低的一類單糖及其衍生物[1]。盡管稀有糖在自然界含量很少,卻在膳食、醫藥、保健等領域擁有重要地位,如低卡路里的木糖醇、甘露糖醇和赤蘚糖醇等在食品工業已得到廣泛應用[2]。
根據稀有糖的定義,D-阿洛酮糖屬于一種稀有單糖[3],在分類上,D-阿洛酮糖屬于己酮糖,是D-果糖三位碳所對應的差向異構體(圖1)。D-阿洛酮糖能夠作為一種零能量、不被消化的食用糖替代品[4-5]。商業碳水化合物和農產品中D-阿洛酮糖含量相當少,只有某些天然植物如鼠刺的提取物中含有少量D-阿洛酮糖[6]。由于D-阿洛酮糖具有零熱量,難以被腸道消化吸收等特性[7],被美國食品導航網評價為最具潛力的蔗糖替代品,現多被引用為新型低卡路里甜味劑[8]。同時,D-阿洛酮糖也可以作為肝脂類酶和腸道α-糖苷酶的抑制劑,減少脂肪堆積[9]。SUNA等研究結果顯示D-阿洛酮糖通過抑制睪丸組織中ROS的產生,阻止鄰苯二甲酸二(2-乙基)乙酯誘導的睪丸損傷[10]。此外D-阿洛酮糖除了對6-羥基多巴胺誘導的細胞凋亡有神經保護的作用外,還能抑制高濃度葡萄糖誘導下的單核細胞趨化蛋白MCP-1的表達[11]。基于D-阿洛酮糖諸多的生理功能,在未來食品、醫藥和化妝品等領域的應用將會非常廣泛。美國的食品藥品監督管理局(FDA)于2002年已經批準D-阿洛酮糖為公認安全食品(generally recognized as safe,GRAS)[3,5],這為其工業化應用提供了有力的保障。
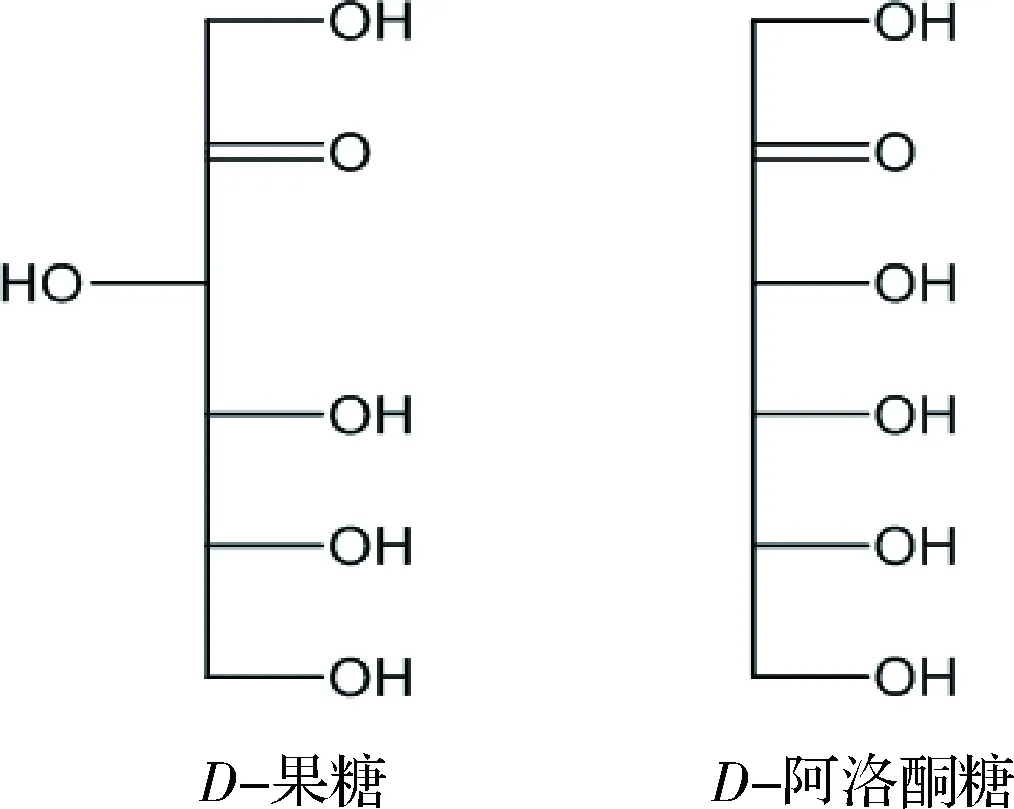
圖1 D-果糖和D-阿洛酮糖的結構式比較Fig.1 Structural comparison of D-fructose and D-psicose
D-阿洛酮糖功能活性與人類健康密切相關,建立完善的高產體系迫在眉睫。目前D-阿洛酮糖的研究瓶頸主要集中在如何擴大產業化生產。早期D-阿洛酮糖的合成方法是化學轉化,其合成過程不僅繁瑣還存在一定的局限性,更不符合當今綠色可持續發展的社會理念[12-13]。目前生產D-阿洛酮糖主要是利用酶固定轉化法,即對酶的克隆表達以及產物的分離精制[14]。不論是化學合成法還是生物轉化法制備D-阿洛酮糖,都存在一個大難題,產品分離與精制十分困難[6]。粗產品中的D-阿洛酮糖往往與其他糖混合在一起,不僅產率降低,而且D-阿洛酮糖與其混雜的糖理化性質幾乎完全相同,所以很難精制與提純[13]。為了對當前的D-阿洛酮糖合成體系進行優化,就必須解決這一難題。
在醛縮酶家族中,磷酸二羥基丙酮(dihydroxyacetone, phosphate,DHAP)依賴型醛縮酶是應用最廣的一類醛縮酶。該類醛縮酶催化供體DHAP與受體醛的縮合反應,生成的產物具有兩個新的立體中心,并且這兩個立體中心的構型一般由醛縮酶來決定[15-16]。前期研究顯示,大腸桿菌MG1655來源的野生型L-鼠李樹膠糖-1-磷酸醛縮酶(L-rhamnulose-1-phosphate aldolase,RhaD)在以D-甘油醛作為醛受體時,失去了對該醛受體的立體選擇性,產生的D-阿洛酮糖與D-山梨糖比例約為1∶1,不利于D-阿洛酮糖的分離純化[17]。據報道,ANDREAS等人經實驗得出大腸桿菌來源的Ⅱ型醛縮酶L-墨角藻糖-1-磷酸醛縮酶(L-fuculose-1-phosphate aldolase,FucA)的113位酪氨酸(Tyrosine,Tyr)是影響醛受體結合的一個重要位點[18-19]。RhaD與FucA同屬II型DHAP依賴型醛縮酶,我們推測其在催化機理上存在相似性。酶的組氨酸殘基從供體上攫取一個質子得到烯醇負離子,該烯醇負離子對醛受體發起親核進攻組氨酸和醛受體需要輔助金屬離子 Zn2+在活性位點配位(圖2-a)。
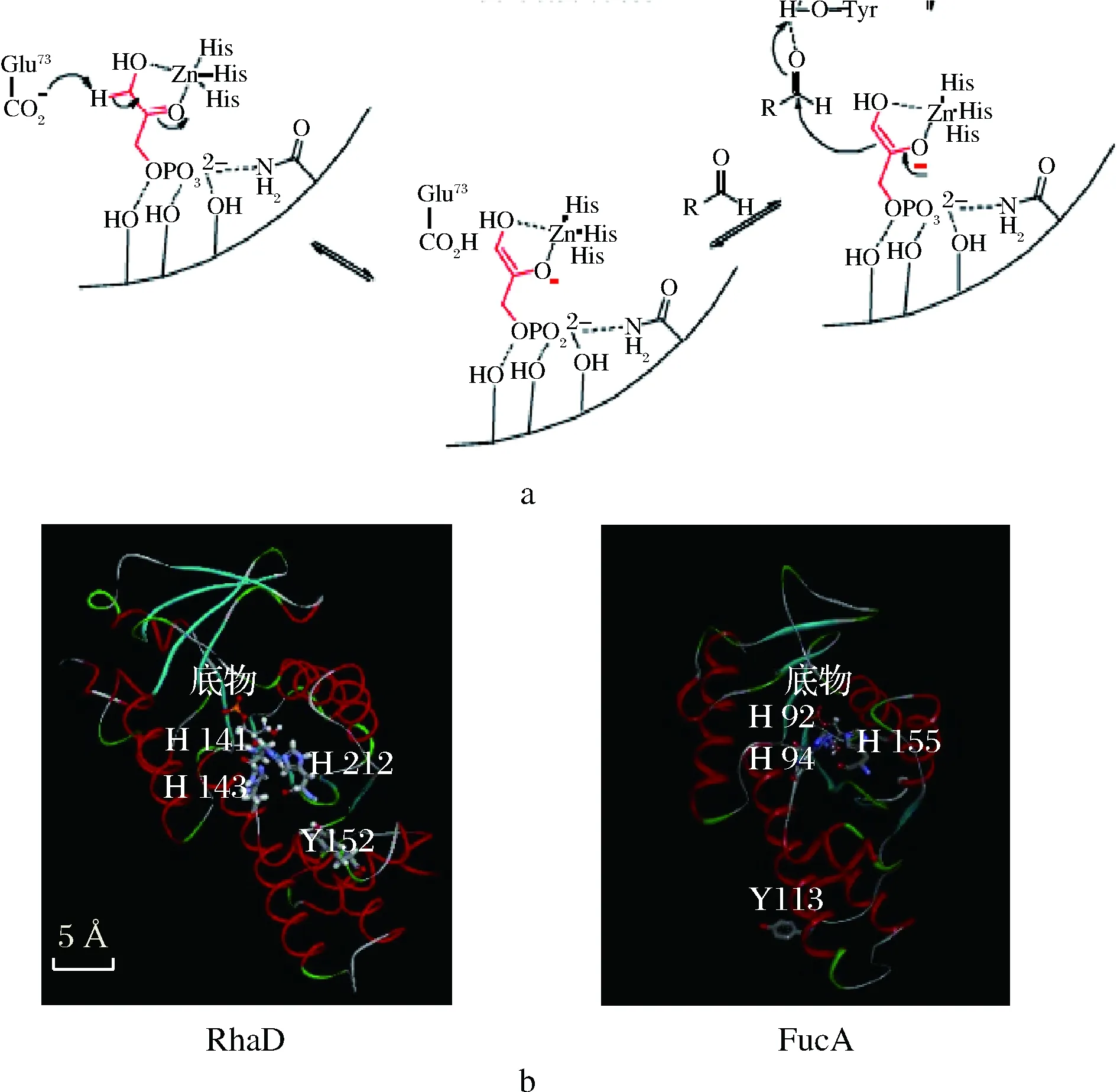
a-DHAP依賴II型醛縮酶催化機理圖;b-FucA與RhaD酶分子結構圖圖2 FucA與RhaD酶分子結構圖示以及催化機理Fig.2 Molecular structure and catalytic mechanism of FucA and RhaD
FucA的第92位、第94位、第155位3個組氨酸結合輔助的金屬離子,同時從底物分子上攝取質子,這是一個可逆的過程。對比蛋白分子模型圖,我們知道RhaD的第141、143以及第212位3個組氨酸殘基行使類似的催化過程(圖2-b)。基于氨基酸序列比對發現,RhaD和FucA在酪氨酸位點上具有保守性:FucA的113位酪氨酸對應RhaD的152位酪氨酸。本研究通過定點飽和突變對RhaD的152位酪氨酸進行半理性改造,提高該酶對D-甘油醛的立體選擇性,使得專一性合成D-阿洛酮糖。
1 材料與方法
1.1 質粒和菌株
大腸桿菌MG1655、XL10-gold和Rosetta(DE3)本實驗室保存。菌株XL10-gold/pET28a-rhaD、Rosetta/pET28a-rhaD為實驗室前期構建。用于基因擴增的引物在華大基因合成。
1.2 酶、試劑及耗材
過氧化氫酶(catalase)、酸性磷酸酶(acid phosphatase from sweet potato,AP)、異丙基-β-D-硫代半乳糖苷(IPTG)、硫酸卡那霉素(Kan)、磷酸二羥基丙酮(DHAP)、D-甘油醛(D-glyceraldehyde)、D-山梨糖(D-sorbose)、D-阿洛酮糖(D-psicose)購于Sigma-Aldrich;Ni2+親和層析柱購自于GE;BCA蛋白濃度測定試劑盒(加強型)購置于碧云天;Aminex HPX-87H色譜柱(300 mm×7.8 mm)購于Bio-Rad公司;TLC硅膠鋁板購于Merck KGaA;定點突變試劑盒購自北京全式金生物科技有限公司;PCR反應所需試劑均購買于TaKaRa公司;質粒小量制備試劑盒購于上海生工生物工程股份有限公司。
1.3 培養基及其他溶液配制
LB培養基:酵母浸出物5 g/L,胰蛋白胨10 g/L,NaCl 5 g/L,瓊脂20 g/L(固體培養基),高壓滅菌(121 ℃,20 min)。
TB培養基:酵母浸出物24 g/L,胰蛋白胨12 g/L,K2HPO4·3H2O 16.4 g/L,KH2PO42.31 g/L,甘油0.4%(V/V)。
用于蛋白純化緩沖液:裂解、平衡緩沖液:25 mmol/L Tris-HCl(pH=7.8),150 mmol/L NaCl;洗滌緩沖液:25 mmol/L Tris-HCl(pH=7.8),150 mmol/L NaCl,60 mmol/L imidazole;洗脫緩沖液:25 mmol/L Tris-HCl(pH=7.8),150 mmol/L NaCl,500 mmol/L imidazole;脫鹽緩沖液:25 mmol/L Tris-HCl(pH=7.8),50 mmol/L NaCl。
1.4 主要儀器
iMarK酶標儀(Bio-Rad);蛋白純化系統AKTAavant;高效液相色譜HPLC(HITACHI);超聲波細胞粉碎機(南京新辰生物科技有限公司)。
1.5 表達載體pET28a-rhaDY152X152位突變的構建
為了對RhaD152位的酪氨酸進行定點飽和突變,分別以丙氨酸等19種氨基酸來代替酪氨酸。以本實驗室質粒保藏菌提取目的質粒pET28a-rhaD,設計并合成定點突變引物共19對 (表1)。

表1 RhaD152位的酪氨酸定點飽和突變引物Table 1 Primers for site-saturation mutagenesis oftyrosine 152 of RhaD
注:下劃線上的字母代表突變位點。
以152位酪氨酸突變成丙氨酸為例進行說明,PCR擴增合成氨基酸突變后的質粒pET28a-rhaDY152A。50 μL體系如下:質粒(10 ng),上下游引物(10 μmol/L),2×TransStart FastPfu PCR Super Mix (25 μL)。PCR條件:94 ℃,2~5 min;94 ℃,20 s;55 ℃,20 s;72 ℃,7 min,20個循環;72 ℃,10 min)。電泳檢測目的條帶大小正確后,用突變試劑盒DMT酶,37 ℃孵育1 h。取2~5 μL DMT酶消化產物轉化大腸桿菌,并涂布到LB (Kan)(50 μg/mL)抗性平板上。挑選單菌落提取質粒酶切鑒定及測序,最終得到19種RhaD 152位酪氨酸定點突變的表達載體。
1.6 RhaD野生型及突變體蛋白在大腸桿菌Rosetta中的誘導表達
將攜帶野生型和突變型質粒(如pET28a-rhaD和pET28a-rhaDY152X)轉化到Rosetta(DE3)感受態細胞,涂到LB(Kan)平板上,37 ℃過夜培養,然后挑選單菌落接種LB(Kan)液體培養基中,37 ℃過夜培養,取2 mL菌液接種到200 mL TB(Kan)液體培養基中,37 ℃振蕩培養。3~4 h后OD600=0.6~0.8,轉16 ℃培養同時加入200 μL IPTG(終濃度0.1 mmol/L)誘導表達。(在此之前取500 μL菌液作為誘導前樣品),加入誘導劑后,16 ℃繼續培養20 h(取誘導后500 μL菌液作為誘導后樣品),離心收集菌體(8 000g,2 min,4 ℃),準備純化。
1.7 RhaD野生型以及突變體蛋白的分離純化
基于前期研究基礎上[20-21],我們探索出適合純化醛縮酶用以生產稀有糖的一系列方法流程。即用15~20 mL預冷的裂解緩沖液重懸以上收集的菌體,超聲破碎。破碎約25 min后(超聲破碎5 s,間隔5 s),鏡檢直至破碎完全。將破碎后的菌體離心(12 000g,30 min,4 ℃),利用蛋白純化系統AKTAavant純化上清中的蛋白(具體步驟:先用預冷的平衡緩沖液平衡鎳親和層析柱5 mL HisTrpTMHP;接著以1.5 mL/min上樣,上樣結束后,以預冷的洗滌緩沖液洗去非特異性結合的雜蛋白;最后換洗脫緩沖液洗脫目的蛋白,收集洗脫峰取樣并進行SDS-PAGE檢測)。純化后的蛋白用超濾管脫鹽后用BCA試劑盒測定蛋白濃度。
1.8 RhaD醛縮酶突變體的立體選擇性分析
以DHAP和D-甘油醛為底物的反應體系如下:DHAP(0.5 mol/L,5 μL,50 mmol/L),D-甘油醛(0.5 mol/L,3 μL,30 mmol/L),RhaD醛縮酶(終質量濃度為0.5 mg/mL),加入50 mmol/L Tris-HCl (pH=7.8)緩沖液使反應終體積為50 μL。30℃反應12 h后,取1 μL反應液進行TLC檢測[展開劑為正V(丁醇)∶V(乙酸)∶V(水)=2∶1∶1],茴香醛染色檢測酮糖-1-磷酸的生成。用6 mol/L HCl調節反應液pH值為4.6,然后加入0.25 μL AP,30 ℃反應10 h,取1 μL TLC檢測,用0.1 mol/L NaOH將pH調至7.0終止反應。反應上清液用HPLC檢測分析稀有糖的種類及比例。HPLC檢測條件如下:Bio-Rad Aminex HPX-87H,流動相為5 mmol/L的稀硫酸水溶液,流速為0.5 mL/min,日立示差檢測器(HITACHI RI),進樣量為20 μL。D-阿洛酮糖、D-山梨糖的保留時間分別為11.23 min和12.55 min。采用相同條件進行D-阿洛酮糖和D-山梨糖的標準曲線的繪制。
2 結果與分析
2.1 表達載體pET28a-rhaDY152X152位突變的構建
前期研究表明大腸桿菌來源的FucA醛縮酶的第113位的酪氨酸是參與醛受體分子結合的重要位點。通過NCBI中Blastp對大腸桿菌來源的RhaD和FucA進行氨基酸序列比對。結果顯示:RhaD與FucA在酪氨酸位點上具有高度保守性,即RhaD第152位酪氨酸與FucA第113位酪氨酸對應(圖3)。

圖3 RhaD和FucA氨基酸序列比對Fig.3 Amino acid sequence alignment of aldolases RhaD and FucA
以質粒pET28a-rhaD為模板,經過單酶切驗證擴增出完整質粒大小約6 194 bp的條帶,rhaD基因片段大小為825 bp,pET-28a載體大小為5 369 bp,以pET-28a質粒單酶切作為對照(圖4),重組質粒經過雙酶切,能夠切出rhaD基因大小的片段,與預期的結果相吻合,重組質粒經過測序表明突變成功。
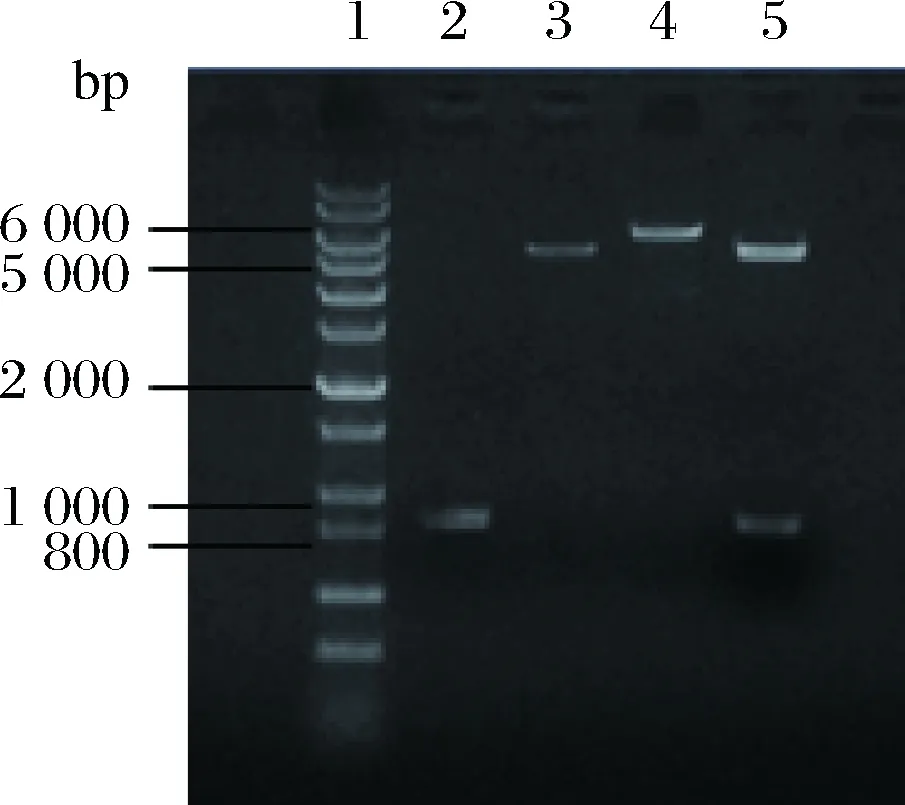
1-DNA Marker (1 kb plus);2-rhaD片段(825 bp);3-質粒pET-28a經EcoR I單酶切產物;4-PCR擴增得到重組質粒pET28a-rhaDY152X EcoR I單酶切產物;5-重組質粒pET28a-rhaDY152X EcoR I和BamH I雙酶切產物圖4 表達載體pET28a-rhaDY152X152位突變的構建Fig.4 Construction of expression plasmid pET28a-rhaDY152X
2.2 RhaD突變體蛋白在大腸桿菌Rosetta中的誘導表達
以丙氨酸和色氨酸分別取代152位的酪氨酸的RhaD突變體蛋白的表達純化為例進行說明。根據SDS-PAGE結果分析(圖5),經IPTG誘導后在約30 kDa處出現一條蛋白條帶(3號泳道),與預期結果一致,對比之下,未經IPTG誘導的菌體(2號泳道)沒有出現目的帶,說明RhaD突變體蛋白成功表達。細胞破碎上清液,經過鎳柱純化后,蛋白純度在95%以上。
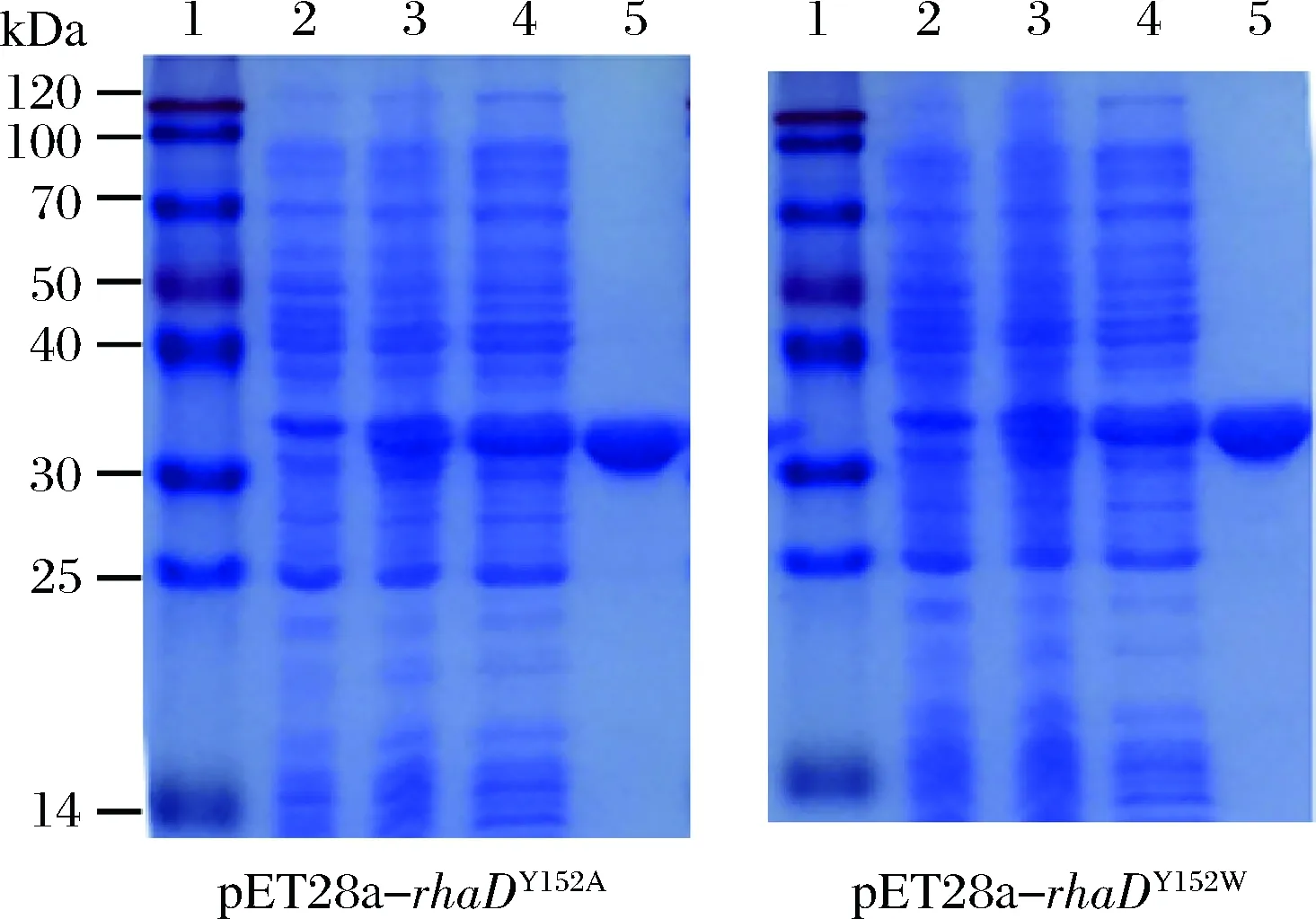
1-蛋白Marker;2-誘導前全細胞;3-誘導20 h后的全細胞;4-細胞裂解上清;5-純化后的RhaD圖5 SDS-PAGE 檢測RhaD突變體的表達與純化Fig.5 SDS-PAGE analysis of expression and purification of RhaD mutants
2.3 TLC檢測RhaD突變體的酶活
以DHAP作為供體分子,以D-甘油醛為受體分子,經純化后的RhaD突變體的催化,生成相應的酮糖-1-磷酸。在酸性磷酸酶AP的作用下,脫掉磷酸基團得到相應的酮糖。以突變體RhaD Y152A和RhaD Y152W為例進行說明。TLC結果顯示(圖6):兩種突變體均可以催化DHAP和D-甘油醛合成酮糖-1-磷酸并在TLC板上顯示深藍色(a箭頭所示);用AP處理后,可以脫掉磷酸基團得到相應的酮糖(b箭頭所示)。
2.4 HPLC分析RhaD突變體的立體選擇性
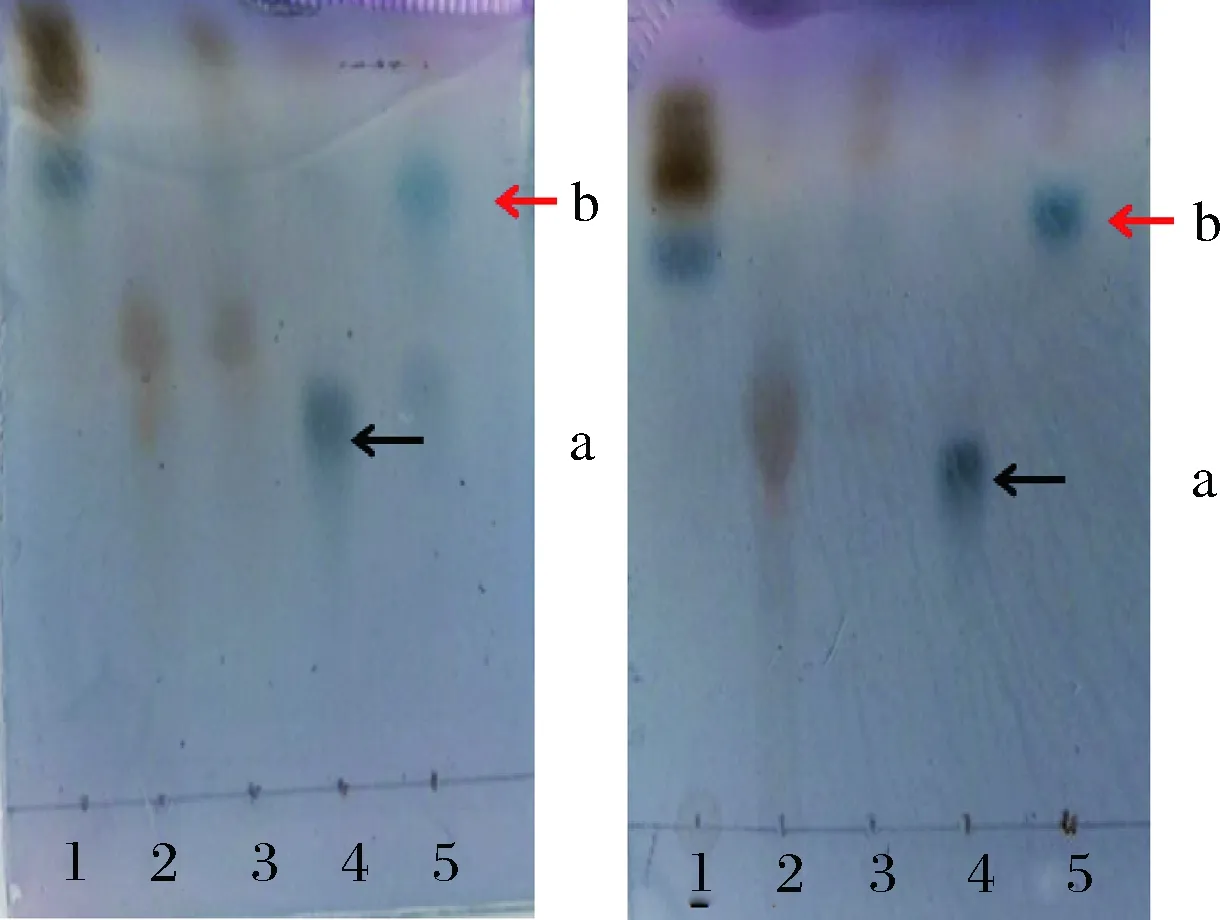
a-為RhaDY152A突變體催化的反應; b-RhaDY152W突變體催化的反應1-D-甘油醛;2-DHAP;3-反應0 h;4-反應20 h(脫磷酸前產物);5-脫磷酸后產物圖6 TLC分析RhaD突變體的活性Fig.6 TLC analysis of the activities of RhaD mutants
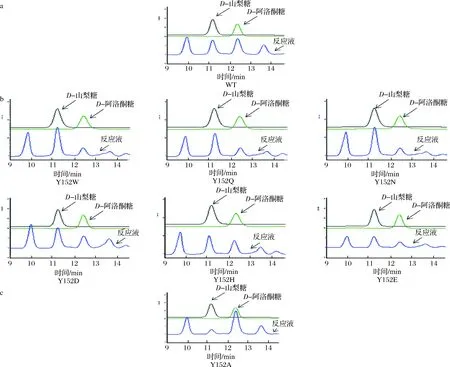
a-野生型RhaD催化的反應;b-6種代表性的RhaD突變體傾向于生成D-山梨糖的反應;c-RhaD Y152A突變體中傾向于生成D-阿洛酮糖的反應圖7 HPLC分析RhaD突變體的立體選擇性Fig.7 HPLC analysis of the stereoselectivity of RhaD
為了分析RhaD突變體的立體選擇性,利用HPLC對反應產物及其比例進行檢測,并以野生型RhaD醛縮酶催化的反應作為對照。前期結果表明,以DHAP和D-甘油醛作為底物,在野生型RhaD醛縮酶的作用下,生成D-山梨糖和D-阿洛酮糖兩種稀有糖并且兩種稀有糖的比例約為1∶1。如圖7-a所示,本結果與前期結果保持一致,兩者的比例接近與1∶1。在這19種RhaD突變體催化的反應(表2),突變體Y152W,Y152Q,Y152N,Y152D,Y152H,Y152E,Y152G,Y152K,Y152P,Y152S,Y152T,Y152V,Y152M共計13種均傾向于生成D-山梨糖,選取6種代表性的突變體的液相檢測圖(圖7-b所示),最高比例10.8∶1(突變體Y152W)。突變體Y152F,Y152I,Y152R的立體選擇性保留與野生型一樣的趨勢,同時也存在部分表現為酶失活的失敗突變(Y152C,Y152L)。RhaDY152A催化的反應傾向于生成D-阿洛酮糖(如圖7-c),兩者的比例約為8∶1。

表2 RhaD所產稀有糖種類及其比例Table 2 Results of RhaD and mutants for rare sugarssynthesis and ratios
3 結論
本研究結果表明大腸桿菌來源的RhaD醛縮酶的第152位酪氨酸的定點飽和突變能夠顯著影響該酶的立體選擇性。其中RhaDY152A更傾向于生成D-阿洛酮糖,推測可能由于丙氨酸是空間位阻最小的氨基酸,對D-甘油醛在RhaD活性口袋中的定位有著重要影響,下一步的工作將通過測定該突變體的酶動力學參數來分析立體選擇性發生改變的原因。雖然RhaD Y152A突變體催化的反應仍有少量的D-山梨糖產生,需要對更多的氨基酸位點進行理性改造,使其能夠專一性地合成高附加值的D-阿洛酮糖,這對于解決稀有糖同分異構體的分離純化問題具有重要意義。
基于生物信息技術的日臻成熟,我們將采用計算機模擬對底物分子與酶分子進行對接,分析系統能量最小化時,底物與酶分子發生相互作用的關鍵氨基酸。通過對酶分子(半)理性改造,找到能專一性合成高附加值D-阿洛酮糖的突變體,應用到D-阿洛酮糖的工業化生產。而這一設想的提出,對今后更多DHAP依賴II型醛縮酶的立體選擇性研究提供了理論依據和方法。

