微生物葡萄糖氧化酶的研究進(jìn)展
廖兆民,蔡俊,林建國
(湖北工業(yè)大學(xué) 生物工程與食品學(xué)院,發(fā)酵工程教育部重點(diǎn)實驗室,工業(yè)發(fā)酵湖北省協(xié)同創(chuàng)新中心,工業(yè)微生物湖北省重點(diǎn)實驗室,湖北 武漢,430068)
對葡萄糖氧化酶(glucose oxidase,E.C.1.1.3.4,GOD)的研究可追溯到1928年MULLER等人從黑曲霉和灰綠青霉的無細(xì)胞提取液中分離出一種脫氫酶,將其命名為葡萄糖氧化酶[1]。之后COULTHARD[2]、ROBERTS[3]、KOCHOLATY[4]等人均從青霉菌中分離出一種抗菌劑,僅在葡萄糖作用下才具有殺菌效果,1963年發(fā)現(xiàn)這些抗菌劑與MULLER發(fā)現(xiàn)的葡萄糖氧化酶是同一類酶[5]。葡萄糖氧化酶的應(yīng)用十分廣泛,特別是在飼料工業(yè)和食品工業(yè)上,20世紀(jì)末我國成立GOD研究協(xié)作組,對其展開了系統(tǒng)的研究,主要集中在產(chǎn)酶菌株的篩選、發(fā)酵條件的優(yōu)化、酶的分離純化及酶學(xué)特性等研究,由于國內(nèi)研究工作起步較晚,目前我國生產(chǎn)的工業(yè)酶制劑純度低、成本高且穩(wěn)定性差,現(xiàn)階段主要利用基因工程技術(shù)對產(chǎn)酶菌株進(jìn)行改良。本文主要綜述產(chǎn)GOD微生物來源,著重介紹了高產(chǎn)GOD工程菌選育的研究進(jìn)展和微生物GOD的應(yīng)用,以期為微生物氧化酶的開發(fā)和高效利用提供理論依據(jù)。
1 葡萄糖氧化酶概述
1.1 葡萄糖氧化酶的理化性質(zhì)
葡萄糖氧化酶是一種黃素蛋白,是分子質(zhì)量約為130~170 kDa的同型二聚體,含有兩個黃素腺嘌呤二核苷酸(flavin adenine dinucleotide,F(xiàn)AD)結(jié)合位點(diǎn)及約11%~13%的高甘露糖型糖基化部分。GOD屬于葡萄糖/甲醇/膽堿氧化還原酶家族,與家族中其他成員具有相同的結(jié)構(gòu)骨架[6]。高純度的GOD為淡黃色粉末,易溶于水,不溶于甘油、氯仿、乙醚等[7]。GOD的吸收光譜最大值為278、382和452 nm,且在紫外光下無熒光。固體GOD酶制劑在低溫下能長期保存,-15 ℃能保存8年。GOD溶液的穩(wěn)定性取決其pH值,在pH值2以下及pH值8以上,催化活性迅速喪失,pH值在5.0左右最穩(wěn)定[8]。GOD的作用溫度為30~60 ℃,最適溫度在55 ℃左右,30 ℃以下及60 ℃以上時,催化活性低于最適酶活的50%。非離子表面活性劑對GOD的影響很小,陰離子表面活性劑如十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)在低pH下使GOD失活,陽離子表面活性劑如十六烷基溴化銨在高pH下使GOD失活[9]。GOD抑制劑包括氯甲基苯甲酸酯,Ag+, Hg2+, Cu2+,羥胺,肼,苯肼,二甲酮和硫酸氫鈉。GOD誘導(dǎo)劑包括葡萄糖、碳酸鈣、巰基乙酸、葡萄酸、乙二胺四乙酸和一些金屬離子如Zn2+、Fe2+、Mn2+、Co2+等[10]。NAKAMURA 和FUJIKI[11]對黑曲霉和青霉的GOD進(jìn)行了比較研究,發(fā)現(xiàn)他們的分子質(zhì)量分別為152 kDa和150 kDa。這兩種菌株產(chǎn)生的GOD具有相似的碳水化合物成分,均主要由葡萄糖、甘露糖和氨基己糖構(gòu)成。黑曲霉GOD比青霉GOD含有更多的甘露糖和氨基己糖,但葡萄糖卻相對較少。黑曲霉GOD和青霉GOD中的總碳水化合物含量分別為16%和11%。兩種酶的氨基酸含量表明黑曲霉含有更多的組氨酸、精氨酸和酪氨酸,青霉則含有更多的賴氨酸和苯丙氨酸。
1.2 葡萄糖氧化酶的作用機(jī)制
GOD利用分子氧作為電子受體,催化β-D-葡萄糖上的第1個羥基,氧化成D-葡萄糖酸-δ-內(nèi)酯,同時產(chǎn)生H2O2,兩種產(chǎn)物最終都會自發(fā)地催化分解。D-葡萄糖酸-δ-內(nèi)酯隨后會被內(nèi)酯酶緩慢水解成D-葡萄糖酸(gluconic acid,GA),產(chǎn)生的H2O2會被過氧化氫酶(hydrogen peroxide,CAT)分解成O2和H2O。根據(jù)乒乓機(jī)制,GOD催化葡萄糖氧化的整個反應(yīng)如下[12]:
GOD(FAD)+β-D-葡萄糖→GOD(FADH2)+D-葡萄糖酸-δ-內(nèi)酯
GOD(FADH2)+ O2→GOD(FAD)+ H2O2
β-D-葡萄糖+ GOD(FAD)+ O2→GA + GOD(FADH2)+ H2O2
目前已知的氧化酶中GOD因高度特異性而出名,研究發(fā)現(xiàn),GOD作用于D-葡萄糖的β-端基異構(gòu)體時十分敏感,但底物為α-端基異構(gòu)體如2-脫氧-D-葡萄糖,D-甘露糖和D-半乳糖時,GOD的催化作用將大大降低[13]。
2 產(chǎn)GOD的微生物來源
GOD可以從許多不同的來源獲得,包括紅藻、柑橘類水果、昆蟲、細(xì)菌、植物、動物和真菌。真菌具有使用各種碳源的巨大能力并且能在應(yīng)力條件下產(chǎn)生GOD,早在1950年真菌GOD就大規(guī)模應(yīng)用于工業(yè)[14],目前生產(chǎn)GOD的最常見微生物是曲霉屬(Aspergillus)、青霉屬(Penicillium)和酵母屬(Saccharomyces)(見表1)。
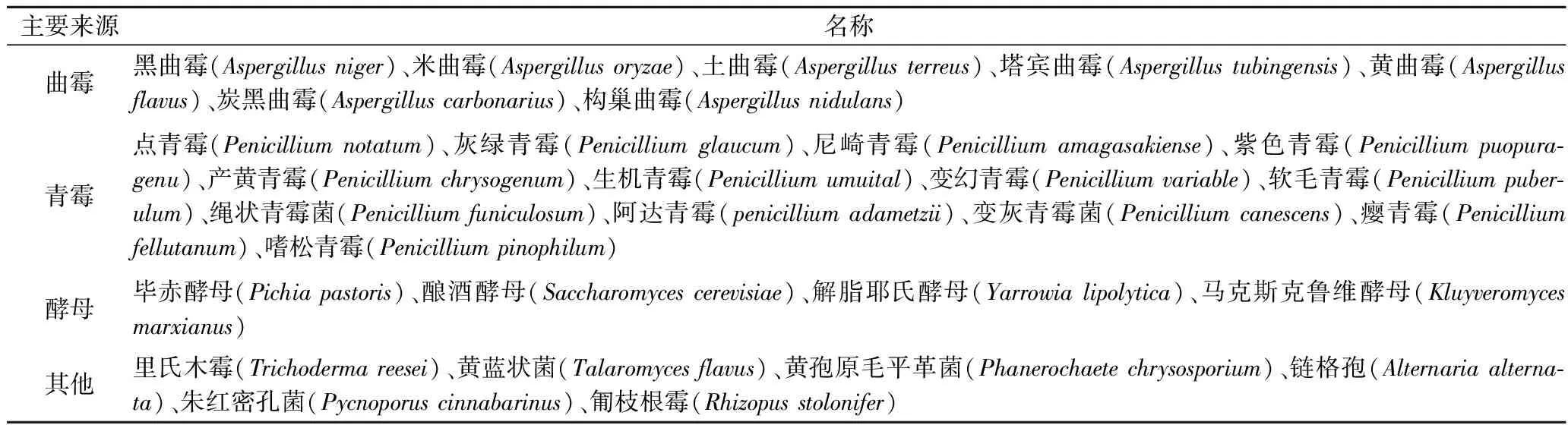
表1 GOD的微生物來源Table 1 Microbial sources of GOD
2.1 黑曲霉產(chǎn)GOD
在食品工業(yè)中,黑曲霉的使用符合美國食品藥品監(jiān)督管理局(Food and Drug Administration,F(xiàn)DA)的安全性指標(biāo)(generally regarded as safe,GRAS)[15],大多數(shù)商業(yè)生產(chǎn)的GOD是從生產(chǎn)葡萄糖酸或葡萄糖酸鹽的黑曲霉菌絲體中分離。未經(jīng)遺傳改造的天然黑曲霉能產(chǎn)生大量GOD,HAQ等人[16]從旁遮普各地土壤中分離出黑曲霉,GOD產(chǎn)量達(dá)到(145.22±0.034) U/mg。CLARKE等人[17]研究了GOD在黑曲霉的細(xì)胞外液、細(xì)胞壁、細(xì)胞質(zhì)和黏液中的分布情況,其中細(xì)胞外液含有38%的酶活,其余62%與菌絲體有關(guān),分別以34%、12%、16%的比例分布在細(xì)胞壁、細(xì)胞質(zhì)和粘液之間。BANKAR等人[18]研究了影響黑曲霉產(chǎn)GOD的最佳營養(yǎng)因子,蔗糖、蛋白胨、NaNO3和CaCO3作為培養(yǎng)成分時,酶活顯著增加了28.93倍,其中CaCO3作為一種強(qiáng)誘導(dǎo)劑誘導(dǎo)GOD的產(chǎn)生。DIEGO等人[19]發(fā)現(xiàn)葡萄糖氧化酶產(chǎn)生在指數(shù)生長期。多變量實驗表明,pH值和攪拌參數(shù)對GOD的產(chǎn)率影響最大,產(chǎn)酶最佳碳源是葡萄糖而不是蔗糖,這一點(diǎn)與BANKAR等人報道的有所差異。HATZINIKOLAOU和MACRIS曾報道過葡萄糖(純的或作為蔗糖水解轉(zhuǎn)化酶的產(chǎn)物)是GOD基因轉(zhuǎn)錄的主要誘導(dǎo)劑,但某些情況下蔗糖卻是最佳碳源,關(guān)于最佳碳源的選擇還有待進(jìn)一步的研究。EL-HARIRI等人[20]用兩種改良的基礎(chǔ)液體培養(yǎng)基篩選了產(chǎn)GOD黑曲霉,在沃格爾肉湯培養(yǎng)基上顯示產(chǎn)GOD陰性,但在察氏培養(yǎng)基上GOD酶活達(dá)7.28 U/mL,GOD的產(chǎn)生可能受3種可控因素的影響:基礎(chǔ)培養(yǎng)基成分、培養(yǎng)時間和菌株對培養(yǎng)基成分的適應(yīng)性。其中,在接種黑曲霉9 d后GOD產(chǎn)量最高,這與BANKAR和PETRUCCIOLI等人[21]報道的接種后第3天達(dá)到最大酶活不一致。雖然黑曲霉是目前商業(yè)應(yīng)用最廣泛的產(chǎn)GOD菌株,但由于大部分酶活存在于細(xì)胞內(nèi),常用的超聲破壁法和酶解法操作繁瑣且破壁效率低,一種高破壁率且簡便的GOD分離方法還有待深入研究。
2.2 青霉屬產(chǎn)GOD
目前在生物傳感器和生物燃料領(lǐng)域,GOD的應(yīng)用十分廣泛。黑曲霉和青霉的總碳水化合物含量分別為16%和11%,黑曲霉GOD的糖基化程度高于青霉GOD,較高的糖基化程度限制了傳感器中電子從電極遷移到GOD的速率,從而降低了生物傳感器的靈敏度。 KALISZ等人[22]研究了青霉菌中去糖基化GOD的酶學(xué)特性,發(fā)現(xiàn)去糖基化不影響GOD最適溫度和最適pH值的動力學(xué),也不增加GOD對蛋白質(zhì)降解的敏感性,但表現(xiàn)出酶的pH值穩(wěn)定性和溫度穩(wěn)定性的降低。通過與黑曲霉GOD對比,發(fā)現(xiàn)青霉GOD具有更好的底物親和力和催化效率,應(yīng)用在生物傳感器上具有更好的優(yōu)勢。KIESS等人[23]通過埃德曼降解和質(zhì)譜分析確定了來自青霉菌的GOD完整氨基酸序列,每個單體的完整序列包含587個氨基酸殘基,含有3個半胱氨基酸殘基和7個潛在的N-糖基化位點(diǎn),研究表明青霉GOD和黑曲霉GOD具有高度的同一性(66%)和相似性(79%)。KONISHI等人[24]報告了黃青霉的葡萄糖氧化酶制劑的安全性。對大鼠進(jìn)行了90天重復(fù)劑量口服毒性研究,在高達(dá)15 600 U/(kg·d)的黃青霉GOD劑量下(相當(dāng)于193 mg總有機(jī)固體/(kg·d)),大鼠體內(nèi)沒有發(fā)現(xiàn)相關(guān)的化合物副作用。另外,黃青霉GOD在一系列遺傳毒性測試中顯示出非遺傳毒性,具體測試包括細(xì)菌回復(fù)突變試驗、體外哺乳動物染色體畸變試驗、體內(nèi)哺乳動物紅細(xì)胞微核試驗和彗星試驗,研究表明黃青霉GOD同樣可用于食品行業(yè),并且具有十分可靠的安全性。
盡管天然GOD在各個方面表現(xiàn)出它的巨大潛力,但在工業(yè)化生產(chǎn)上卻存在明顯的缺陷。一方面,大部分天然GOD來源于霉菌,霉菌在發(fā)酵過程中形成的菌絲體會使發(fā)酵液的黏度增高,從而影響攪拌和供氧的速度,菌絲體的存在也導(dǎo)致發(fā)酵液中營養(yǎng)成分的不均勻混合,最終導(dǎo)致產(chǎn)品的回收率低。另一方面,天然GOD的分子結(jié)構(gòu)復(fù)雜,導(dǎo)致酶的穩(wěn)定性差。在食品加工、飼料生產(chǎn)、紡織漂白等方面,酶的耐熱性、耐酸性及耐氧化性遠(yuǎn)遠(yuǎn)達(dá)不到工業(yè)化生產(chǎn)的要求。因此,目前工業(yè)生產(chǎn)GOD的微生物均優(yōu)選于經(jīng)過基因工程改造的酵母菌屬。
3 高產(chǎn)GOD工程菌的選育
天然GOD的大規(guī)模生產(chǎn)受發(fā)酵能力低、純化工藝復(fù)雜,酶活性低等因素制約,且傳統(tǒng)過程中往往伴隨其他雜質(zhì)的產(chǎn)生,包括CAT、纖維素酶和淀粉酶,同時GOD可以被H2O2滅活,因此構(gòu)建工程菌生產(chǎn)GOD成為主要研究方向。過去十幾年,利用漢氏酵母和釀酒酵母異源表達(dá)GOD進(jìn)行工業(yè)化生產(chǎn)被認(rèn)為具有很大的前景[25],但是重組酶的高糖基化限制了其在生物傳感器上的使用[22]。有研究人員在大腸桿菌中表達(dá)出非糖基化的GOD,但是重組酶以不溶性包涵體的方式存在,僅僅40%左右的蛋白質(zhì)存在活性[26]。畢赤酵母作為僅次于大腸桿菌的第二大表達(dá)系統(tǒng),具有進(jìn)行許多真核轉(zhuǎn)錄翻譯修飾的能力,如信號序列的處理、糖基化及二硫鍵形成等,可作為GOD表達(dá)的良好表達(dá)系統(tǒng)。CROGNALE等人[27]在畢赤酵母X33中表達(dá)了可變青霉P16的GOD基因,3 L發(fā)酵罐中未優(yōu)化發(fā)酵15 d,其酶活達(dá)到50 U/mL。重組酶比天然酶的糖基化程度略高,分別是17%、14%,酶學(xué)特性相似。GUO等[28]在蛋白酶缺陷性畢赤酵母中表達(dá)了黑曲霉Z-25GOD,搖瓶優(yōu)化后酶活達(dá)到400 U/mL,觀察到重組酶的Km和Kcat值比天然酶的略低,盡管較低的Km值有助于提高酶對β-D-葡萄糖的親和力,但較低的Kcat值則代表了重組酶較慢的催化速度。郜趙偉等人[29]通過密碼子優(yōu)化實現(xiàn)重組GOD的高水平表達(dá),突變了涉及228個殘基的272個核苷酸并調(diào)整了G+C含量,高密度發(fā)酵后酶活達(dá)到615 U/mL,使GOD的產(chǎn)率提高到原來的410%,實現(xiàn)面包焙烤工業(yè)的低成本替代。顧磊等人[30]對比了黑曲霉GOD和青霉GOD的基因序列,對其酶活性保守區(qū)域內(nèi)的差異氨基酸位點(diǎn)進(jìn)行突變,復(fù)合突變體的Kcat/KmA提高至rGOD的2.4倍,將CAT中區(qū)域B和D分別與GOD的N端與C端融合,突變體的溫度穩(wěn)定性和耐氧化性均有所增強(qiáng),然后證實了共表達(dá)HAC1基因?qū)τ诘鞍渍郫B機(jī)制的正向作用,研究了各模塊基因改造對GOD產(chǎn)量的影響并進(jìn)行組合優(yōu)化,GOD酶活達(dá)到1 972.9 U/mL。近幾年來,葡萄糖氧化酶和辣根過氧化物酶的交聯(lián)結(jié)合酶聚體廣泛用于食品和制藥工業(yè)的各個領(lǐng)域,用于催化級聯(lián)反應(yīng)[31-32]。但GOD的利用通常受限于極端溫度、pH值或表面活性劑存在的高溫條件,高穩(wěn)定性的GOD將大大提高其利用價值。牟慶璇等人[33]通過整合分子伴侶二硫鍵異構(gòu)酶和透明顫菌的血紅蛋白使酶活提高了150%,利用計算機(jī)軟件輔助突變了S16K、Q243H和H477Y三個氨基酸位點(diǎn)使熱穩(wěn)定性達(dá)到63 ℃。JIANG等人[10]通過設(shè)計突變體,用計算機(jī)CDOCKER算法輔助進(jìn)行同源性建模,將亮氨酸替換成甲硫氨酸,從而提高了GOD對H2O2(競爭性抑制劑)的抗氧化能力。 獲得的結(jié)果與計算機(jī)輔助分析的結(jié)果一致,表明這種方法對酶結(jié)構(gòu)優(yōu)化的有效性。ROUPAIN等人[34]采用隨機(jī)突變和理性設(shè)計的方法分離出無特征突變的黑曲霉葡萄糖氧化酶,改進(jìn)了其性質(zhì),發(fā)現(xiàn)兩種突變能顯著提高酶的熱穩(wěn)定性。其中突變體T554M引入一個硫-π作用,突變體Q90R/Y509E在二聚體蛋白結(jié)構(gòu)界面附近引入一個新的鹽橋。另一種雙取代突變體Q124R/L569E的穩(wěn)定性沒有顯著提高,但酶的比活性增加兩倍,結(jié)果顯示了蛋白質(zhì)結(jié)構(gòu)對酶整體穩(wěn)定性的影響。
GOD在工業(yè)上的適用性依賴于它的高催化活性、底物親和力以及高穩(wěn)定性。來源真菌的GOD具有廣譜應(yīng)用的特點(diǎn),為了產(chǎn)生更高的經(jīng)濟(jì)效益,它必須在更極端的溫度和更長的時間內(nèi)保持穩(wěn)定,如在面包焙烤的高溫條件下、食品和藥品低溫生產(chǎn)條件下及在傳感器中長期使用條件下均能保持良好的穩(wěn)定性。GOD的優(yōu)化可以利用現(xiàn)代分子技術(shù)與生物工藝工程技術(shù)相結(jié)合,實現(xiàn)經(jīng)濟(jì)可行的酶生產(chǎn)系統(tǒng),將高效重組微生物技術(shù)和蛋白質(zhì)工程技術(shù)相結(jié)合,提高GOD穩(wěn)定性的同時可以進(jìn)一步提升其工業(yè)價值。盡管已經(jīng)有許多成功的研究通過使用遺傳修飾和其他方法來改善和優(yōu)化真菌GOD的產(chǎn)生,但是不同真菌積累GOD的機(jī)制尚沒有權(quán)威的報道,這一點(diǎn)仍然是目前研究的突破口。
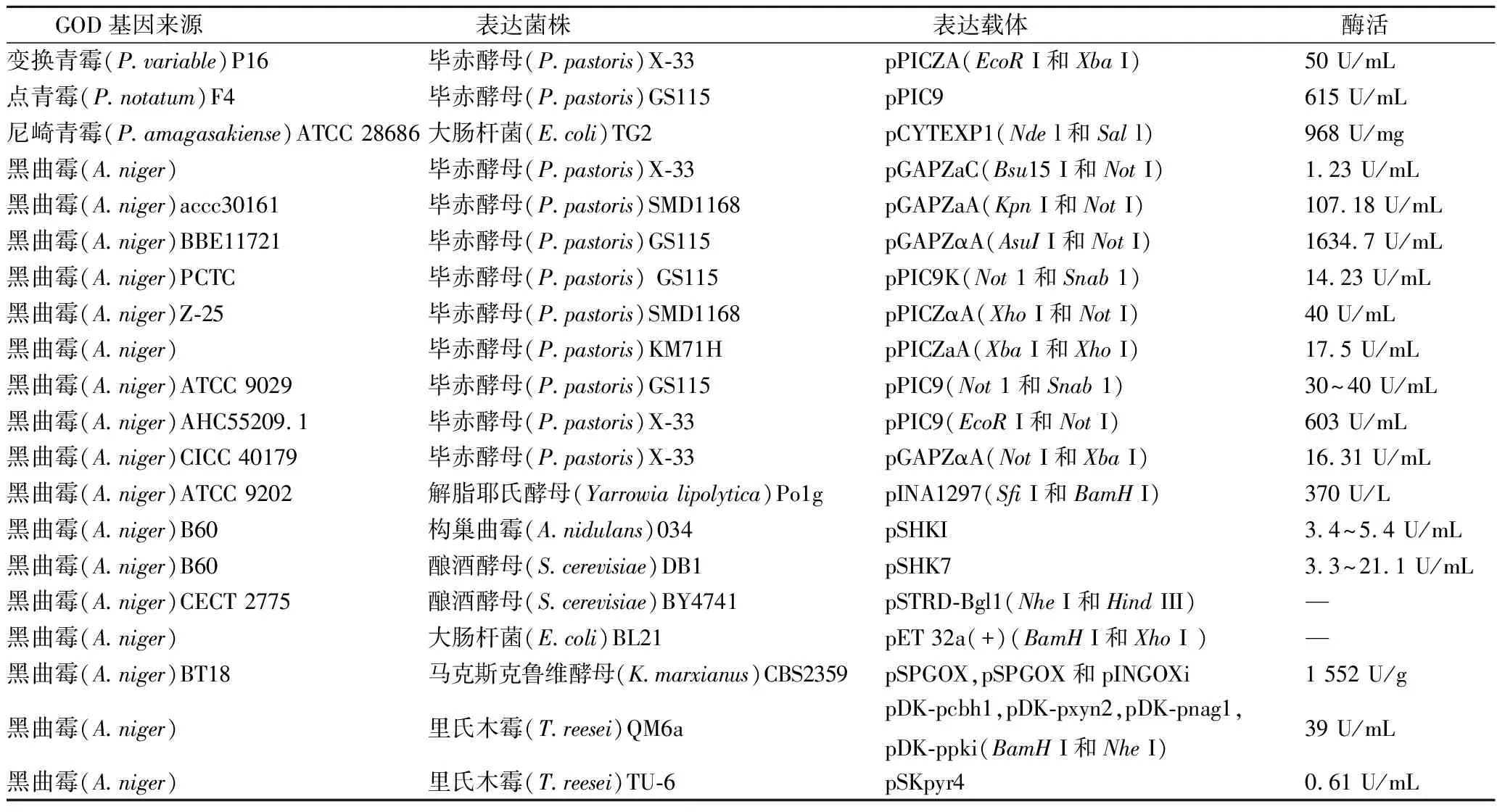
表2 GOD基因工程菌株Table 2 Genetically engineered strain of glucose oxidase
注:表中“—”表示文獻(xiàn)中未提到
4 微生物GOD的應(yīng)用
4.1 食品領(lǐng)域的應(yīng)用
在烘焙行業(yè)中,GOD作為一種高效的氧化劑,可以提高面包的質(zhì)量,增大面包的體積,由GOD產(chǎn)生的H2O2能提高面團(tuán)的彈性和黏性[35],但GOD添加過量會引起不良的反應(yīng)[36]。研究發(fā)現(xiàn),GOD和其他添加劑共加入會產(chǎn)生協(xié)同作用,如GOD和脂肪酶共同添加可以提高面包的質(zhì)量和保質(zhì)期;在小麥粉中添加基礎(chǔ)添加劑及32%抗壞血酸、4.2%α-淀粉酶和63.8%GOD能降低面包的硬度和咀嚼性并改善其粘彈性和體積[37]。AITLNEL等人[38]發(fā)現(xiàn)了淀粉葡萄苷酶、GOD和半纖維素酶的組合利用對面團(tuán)流變學(xué)特性的協(xié)同效應(yīng)。APRODU和BANU等人研究了車前子、豌豆纖維、燕麥麩皮、水和GOD對無谷蛋白玉米面包的流變學(xué)性質(zhì)和烘烤性能的影響,表明GOD能顯著的改善所有纖維類型的面包體積[39]。
在飲料制造中,GOD通過消除殘留的葡萄糖從而減少葡萄酒中的低度酒精物質(zhì)[40],目前通過將GOD固定在尼龍纖維膜上研發(fā)出一種新型葡萄糖電化學(xué)傳感器,能夠分析商業(yè)飲料中葡萄糖含量和監(jiān)測啤酒的釀造過程[41]。
GOD還有一個主要的應(yīng)用是生產(chǎn)GA及其衍生鹽,GA可通過生物化學(xué)、電化學(xué)、生物電化學(xué)和微生物發(fā)酵過程來生產(chǎn),但發(fā)酵法是GA生產(chǎn)的首選方法,其他方法價格昂貴且生產(chǎn)效率低[42]。葡萄糖轉(zhuǎn)化為GA的催化效率高度依賴于GOD的穩(wěn)定性,最近,已經(jīng)證明在無機(jī)載體SiO2體系上修飾過的葡萄糖與酶交聯(lián)的穩(wěn)定系統(tǒng)使GA產(chǎn)率達(dá)到目前最高85%[43]。GA在面包、飼料和飲料等領(lǐng)域被用作色素穩(wěn)定劑、酸化劑、抗氧化劑和螯合劑等。在乳品工業(yè)中,GA用于促進(jìn)乳酪凝乳的形成、提高牛奶的熱穩(wěn)定性、鋁罐的清洗及防止奶石的形成[43]。GA衍生鹽如葡萄糖鈉具有螯合金屬離子的巨大潛力,并且可用于去除食品中的苦味[44]。
GOD還可用作食品抗菌劑,對不同的食源性病原體具有抗菌活性,包括產(chǎn)氣莢膜梭菌、沙門氏菌、李斯特菌、金黃色葡萄球菌、空腸彎曲桿菌、大腸桿菌和蠟狀芽孢桿菌等[45]。GOD及其產(chǎn)物H2O2和GA對幼蟲芽孢桿菌ATCC9545具有體外抗菌活性,已應(yīng)用于食用抗菌薄膜,通過在食品表面釋放足夠數(shù)量的抗菌物質(zhì)來提高食品的保質(zhì)期[46]。
4.2 醫(yī)藥行業(yè)的應(yīng)用
葡萄糖生物傳感器用于快速、準(zhǔn)確監(jiān)測糖尿病患者血糖濃度,目前已經(jīng)開發(fā)出了更先進(jìn)的技術(shù)如連續(xù)葡萄糖監(jiān)測儀[47],葡萄糖生物傳感器的缺點(diǎn)和局限性可通過電極、膜、酶固定化和納米復(fù)合膜修飾電極等先進(jìn)方法消除。GOD的固定化能加快催化反應(yīng)速率、增強(qiáng)GOD的穩(wěn)定性、提高生產(chǎn)率以及降低操作成本,是研制高穩(wěn)定、具有長期使用壽命葡萄糖生物傳感器的關(guān)鍵因素。將GOD結(jié)合到生物傳感器的方法包括吸收、共價吸附、交聯(lián)和微囊化,HONG[48]等人通過酶吸附、沉淀、交聯(lián)組合混合制備方法,開發(fā)了基于GOD固定在氧化石墨烯上的生物傳感器,以交聯(lián)沉淀形式存在的GOD聚集體提高了酶的裝載量和系統(tǒng)的穩(wěn)定性。
4.3 其他領(lǐng)域的應(yīng)用
在紡織工業(yè)中,GOD產(chǎn)生的H2O2是一種有效的工業(yè)漂白劑,是應(yīng)用最廣泛的商業(yè)H2O2替代品。ABER等人[49]利用生物芬頓法通過GOD產(chǎn)生的對染料溶液進(jìn)行脫色,他們將GOD固定在磁體礦納米粒子Fe3O4上并研究了最佳脫色條件,該系統(tǒng)可有效地用于葡萄糖的氧化和原位生成H2O2去除酸性黃12。FAROOQ等人[50]對比了傳統(tǒng)漂白和GOD催化漂白對針織棉織物的漂白效果,發(fā)現(xiàn)酶漂白劑能提高織物的白度和力學(xué)性能,如抗拉強(qiáng)度和撕裂強(qiáng)度。近幾年,研究發(fā)現(xiàn)以酶為生物催化劑的生物燃料電池系統(tǒng)是未來可植入設(shè)備的優(yōu)良替代品[51],人們開發(fā)了可植入微型化膜/無室裝置,如人造胰腺和起搏器中的胰島素泵和葡萄糖傳感器。CHRISTWARDANA等人[52]將GOD-CAT共固定化增強(qiáng)了無膜生物燃料電池的發(fā)電效率,該系統(tǒng)存在協(xié)同作用機(jī)制,如CAT分解了不利于電池發(fā)電的H2O2同時激活了GOD的氧化反應(yīng)。GOD還大量用于飼料工業(yè),據(jù)研究,日糧中添加GOD可以增強(qiáng)仔豬的生長能力、提高體內(nèi)生長發(fā)育相關(guān)激素水平和改善仔豬的糞便微生物群落[53],每噸日糧中添加100 g GOD可以有效改善仔豬腸道健康和血清中相關(guān)生長激素含量[54]。
5 結(jié)語
GOD在食品、飼料、醫(yī)藥、紡織和新能源等領(lǐng)域的應(yīng)用十分廣泛,特別是在食品和飼料工程領(lǐng)域,我國作為農(nóng)業(yè)大國,GOD的產(chǎn)量及穩(wěn)定性遠(yuǎn)遠(yuǎn)達(dá)不到市場要求。我國對GOD的研究起步較晚,目前國內(nèi)的研究主要在于高產(chǎn)GOD菌株的選育和酶學(xué)特性研究。盡管有多種微生物能產(chǎn)生GOD,但實際應(yīng)用于商業(yè)的微生物種類僅占小部分,開發(fā)新的GOD來源和具有成本效益的發(fā)酵工藝應(yīng)被高度重視。近年來,酶固定化技術(shù)被開發(fā)為大規(guī)模生產(chǎn)GOD的新方法。然而,酶固定化后的擴(kuò)散限制和酶活性下降等問題限制了固定化GOD的應(yīng)用,該方面的研究還需深入突破。利用現(xiàn)代生物技術(shù)如蛋白質(zhì)設(shè)計、定點(diǎn)誘變等可實現(xiàn)GOD在各領(lǐng)域的大規(guī)模高效利用,將GOD在具有潛力的微生物中重組表達(dá)確實大大提高了GOD的產(chǎn)量,但GOD穩(wěn)定性的提高有待于進(jìn)一步研究以滿足未來的市場需求。

