姜黃素微乳凝膠抗皮膚纖維化作用的實驗研究
韓桂香 劉 嘉 朱萱萱 張 迪
(1.江蘇衛生健康職業學院,江蘇南京211800;2.南京中醫藥大學附屬醫院,江蘇南京210029)
近年來,因明確的藥理作用和較低的毒副作用,姜黃素(curcumin)及其相關制劑在皮膚疾病中有較為廣泛的應用[1]。有研究認為,姜黃素具有清除活性氧自由基及抗脂質過氧化的作用,可防護人角質形成細胞的氧化損傷,還對瘢痕疙瘩成纖維細胞、人增生性瘢痕成纖維細胞具有明顯的抑制作用,也具有明顯的抗炎和抗皮膚微生物的作用[2]。盡管應用前景廣泛,但由于姜黃素水溶性低,且在中性pH中不穩定,這樣的理化性質限制了其進一步開發利用。姜黃素的外用制劑往往因釋藥緩慢,累積釋藥量達不到治療濃度而影響治療效果[3]。基于此,我們通過制劑學的方法改變姜黃素的理化性質,將姜黃素制備成新型的載體經皮給藥系統——微乳凝膠,對比姜黃素普通凝膠與姜黃素微乳凝膠對小鼠皮膚纖維化模型的作用,并深入探討其機制,以期為姜黃素進一步的開發及臨床應用奠定基礎。
1 材料
1.1 實驗動物 6周齡SPF級Balb/c小鼠,雄性,體重20~24g,由北京維通利華提供,動物合格證號:SCXK(蘇)2016-0003。
1.2 試藥 姜黃素(純度95%,西安四季生物科技有限公司);聚山梨酯-80(廣州廣醇化工科技有限公司);辛酸癸酸甘油三酯(德國BASF);乙基己基異壬酸酯(上海譽宇新材料科技有限公司);油酸(汕頭市西隴化工廠);泊洛沙姆407(德國BASF);無水乙醇(上海久億化學試劑有限公司);二甲苯、鹽酸、氨水、中性樹膠、30%H2O2,國藥集團化學試劑有限公司;蘇木素、伊紅,武漢谷歌生物科技有限公司;積雪苷軟膏(積雪總苷含量為0.025g/g,上海現代制藥股份有限公司);博來霉素(海正輝瑞制藥有限公司);羥脯氨酸測試盒(南京建成生物工程研究所);Ⅰ型膠原蛋白(ColⅠ)試劑盒,轉化生長因子β(TGF-β)檢測試劑盒,基質金屬蛋白酶9(MMP-9)檢測試劑盒,南京拜睿生物科技有限公司。
1.3 儀器 T6新世紀紫外可見分光光度計(北京普析通用儀器有限責任公司);高速冷凍離心機(德國SIGMA公司);JJ-12J脫水機(武漢俊杰電子有限公司);JB-P5石蠟包埋機(武漢俊杰電子有限公司);RM2016石蠟超薄切片機(上海徠卡儀器有限公司);Nikon DS-U3生物正置光學顯微鏡(日本尼康);JB-L5凍臺(武漢俊杰電子有限公司);組織攤片KD-P機(浙江省金華市科迪儀器設備有限公司);DNP-9022 37℃恒溫培養箱、DHG-9108A鼓風干燥箱(上海精宏實驗設備有限公司)。
2 實驗方法
2.1 姜黃素微乳凝膠的制備 以偽三相圖法篩選姜黃素微乳的工藝,微乳制備完成后再制備成凝膠劑。經過篩選,姜黃素微乳的最優處方為:水相為無水乙醇25%,水53.5%;油相為油酸和乙基己基異壬酸酯的混合物(1∶1)6.8%,表面活性劑為聚山梨酯-80與辛酸癸酸甘油三酯的混合物(1∶3)14.7%。制備方法:將適量姜黃素溶于無水乙醇,配置成10mg/mL的溶液,先后加入表面活性劑和油相,超聲20min后,加入水相,緩慢加入,邊加邊攪,500r/min磁力攪拌45min即得姜黃素微乳。微乳制備完成后,以直接溶脹法制備微乳凝膠,將泊洛沙姆407置于微乳表面,放置4℃冰箱12h,待凝膠基質泊洛沙姆407溶脹后,緩慢攪拌,置室溫下即得。姜黃素微乳凝膠含藥量為2.5mg/mL。
2.2 姜黃素凝膠與空白凝膠的制備 將適量姜黃素溶于無水乙醇,以直接溶脹法制備微乳凝膠,制備方法同上,姜黃素凝膠含藥量為2.5mg/mL。將泊洛沙姆407直接溶脹于蒸餾水中即制成空白凝膠。
2.3 小鼠皮膚纖維化模型制備 將70只SPF級BALB/c小鼠隨機分為正常組、模型組、姜黃素微乳凝膠低劑量組、姜黃素微乳凝膠中劑量組、姜黃素微乳凝膠高劑量組、姜黃素凝膠組、陽性藥(積雪苷軟膏)組,每組10只,正常飼養于SPF級動物實驗室內,給予SPF級飼料(由江蘇省協同醫藥生物技術有限公司提供)飼養。實驗前用電動剃毛剪將背部毛發剃除,面積1.5cm×1.5cm。采用博來霉素建立小鼠皮膚纖維化模型,用PBS液(pH7.2磷酸鹽緩沖液)將博來霉素(BLM)配置成200μg/mL溶液,經0.22μm無菌濾膜過濾除菌后保存備用。造模時在小鼠背部中央剃毛處用博來霉素溶液作背部皮內注射,每日1次,每次0.1mL,共3周。正常組用PBS液0.1mL注射,方法同造模組。每日記錄皮膚彈性及外觀等大體變化,給藥3周后,觀察造模情況,60只博來霉素皮膚纖維化模型小鼠注射區皮膚活動度明顯減弱,注射區皮膚與皮下組織粘連,初步確定造模成功。在之后的實驗中處死小鼠,取注射區皮膚,進行組織學檢查,確認造模均成功。
2.4 給藥方案 正常組與模型組給以空白凝膠,0.5mL/次;姜黃素微乳凝膠低、中、高劑量組分別給予姜黃素微乳凝膠0.8、1.6、2.4mg/次;姜黃素凝膠組給予姜黃素凝膠,2.4mg/次;陽性藥組給予積雪苷軟膏,25mg/次。以上各組動物在成功造模后的次日開始給藥,每日給藥2次,連續3周。
2.5 指標檢測 (1)動物血清中羥脯氨酸含量測定:實驗結束時動物取血,2000r/min離心15min,取上清液,測定羥脯氨酸含量(采用堿水解法,按試劑盒說明書進行操作)。(2)處死小鼠,取背部中央約1.5cm×1.5cm大小皮膚,經過10%福爾馬林液固定,常規取材,脫水,石蠟包埋,制片,HE染色,由專業病理人員在光學顯微鏡下閱片。應用醫學彩色病理圖像分析系統測定真皮厚度,每張切片隨機取5處測皮膚厚度,取平均值。(3)免疫組化測定:ColⅠ、TGF-β、MMP-9,實驗方法參照試劑盒說明書操作,棕黃色為陽性表達,應用Image-Pro Plus對實驗結果圖片進行分析。
2.6 統計學方法 相關數據采用SPSS 16.0統計軟件進行統計分析,數據用(±s)表示,計量資料比較采用t檢驗,多組間計量資料的兩兩比較采用q檢驗,以P<0.05為差異有統計學意義。
3 實驗結果
3.1 各組小鼠羥脯氨酸含量比較 結果見表1。姜黃素微乳凝膠各劑量組組間比較差異具有統計學意義(P<0.05,P<0.01),表現出一定的劑量依賴性。
3.2 各組小鼠皮膚組織病理學觀察與真皮厚度比較 各組小鼠真皮厚度比較結果見表2。姜黃素微乳凝膠各劑量組組間比較差異具有統計學意義(P<0.05,P<0.01),表現出一定的劑量依賴性。HE染色組織圖見圖1。除正常組外,其他各組小鼠皮膚組織學顯示真皮層不同程度的增厚,真皮小血管周圍出現不同程度的炎癥細胞浸潤,血管壁增厚,管腔變小或閉塞,皮膚附屬器明顯減少。陽性藥組和姜黃素微乳凝膠高劑量組真皮纖維化程度明顯減輕,浸潤的炎癥細胞明顯減少;中劑量組和姜黃素凝膠組作用相近,略有改善真皮病變的作用;低劑量組則改善不明顯。
表1 各組小鼠血清羥脯氨酸含量比較(±s)
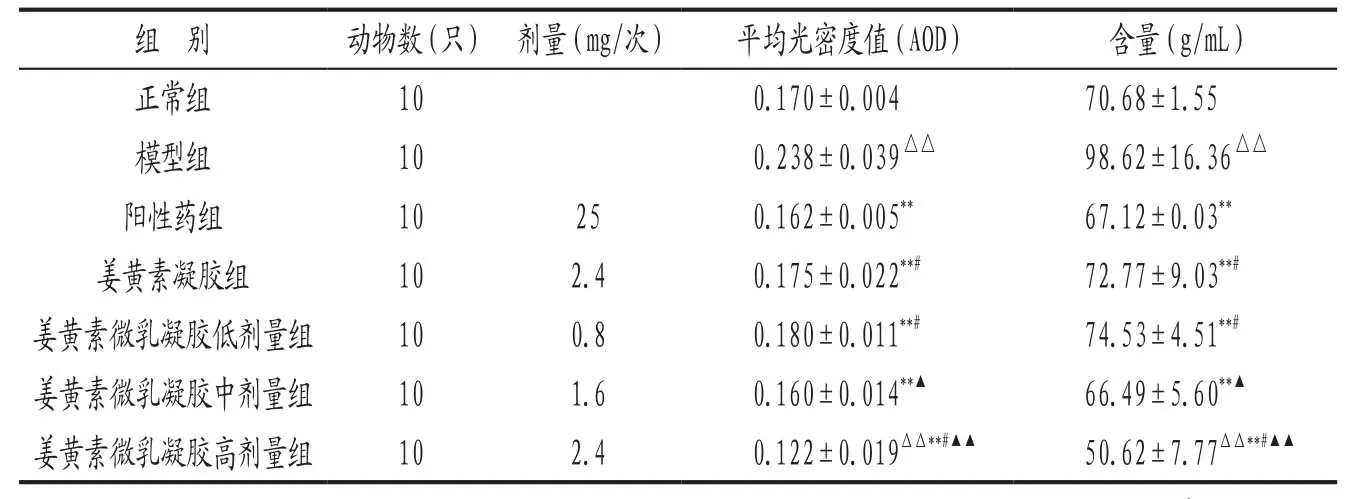
表1 各組小鼠血清羥脯氨酸含量比較(±s)
注: 與正常組比較,△△P<0.01;與模型組比較,**P<0.01;與陽性藥組比較,#P<0.05;與姜黃素凝膠組比較,▲P<0.05,▲▲P<0.01。
正常組 10 0.170±0.004 70.68±1.55模型組 10 0.238±0.039△△ 98.62±16.36△△陽性藥組 10 25 0.162±0.005** 67.12±0.03**姜黃素凝膠組 10 2.4 0.175±0.022**# 72.77±9.03**#姜黃素微乳凝膠低劑量組 10 0.8 0.180±0.011**# 74.53±4.51**#姜黃素微乳凝膠中劑量組 10 1.6 0.160±0.014**▲ 66.49±5.60**▲姜黃素微乳凝膠高劑量組 10 2.4 0.122±0.019ΔΔ**#▲▲ 50.62±7.77ΔΔ**#▲▲
3.3 各組小鼠皮膚組織中ColⅠ、MMP-9和TGF-β表達比較 結果 見 表3。 結 果 顯 示,ColⅠ、MMP-9和TGF-β在模型組表達顯著升高,在正常組則幾乎無表達,提示皮膚纖維化與ColⅠ、MMP-9和TGF-β的高表達有相關性。姜黃素微乳凝膠各劑量組上述指標有不同程度的降低,高劑量組降低最為明顯,且明顯優于姜黃素凝膠組(P<0.05,P<0.01)。姜黃素微乳凝膠各劑量組組間比較差異具有統計學意義(P<0.05,P<0.01),表現出明顯的劑量依賴性。
4 討論
皮膚纖維化通常發生于硬皮病與皮膚瘢痕形成過程中,其主要特征為真皮層出現增厚,皮膚附屬器毛囊、汗腺等出現阻塞,真皮小血管周圍炎癥細胞浸潤,血管壁明顯增厚,管腔變小或閉塞等[4]。皮膚纖維化是多個細胞因子參與的細胞間相互作用的結果,通常認為與ColⅠ、MMP-9和TGF-β等的異常表達有關。TGF-β是目前普遍認為與皮膚纖維化相關的因子,往往參與細胞分化、細胞凋亡、細胞動態平衡等多個過程,如TGF-β過高表達,能誘導成纖維細胞、膠原蛋白、層黏蛋白等的分泌及合成,并抑制其降解,從而導致細胞外基質(EMC)的沉積[5],最終導致皮膚纖維化的產生。MMP-9屬于基質金屬蛋白酶(MMPs)家族,其主要功能是降解和重塑EMC的動態平衡。MMP-9與組織器官發生纖維化密切相關,Vassiliadis等[6]研究發現,MMP-9中的CO3-610片段與介導Ⅲ型膠原蛋白降解程度直接相關,在博來霉素皮膚纖維化小鼠中普遍高表達,提示MMP-9與皮膚纖維化發生發展直接相關。Kobayashi等[7]發現,MMP-9可通過激活TGF-β,誘導成纖維細胞生成,進而誘發組織纖維化。羥脯氨酸為膠原蛋白特征性的氨基酸,在創傷愈合及組織纖維化病變等方面有較高的預測價值,相關研究也常將血清羥脯氨酸含量作為纖維化程度的標志[8-9]。Ⅰ型膠原蛋白為結締組織中的主要成分之一,其主要分布于皮膚和肌腱,是皮膚纖維化的重要指標。
表2 各組小鼠真皮厚度比較(±s)
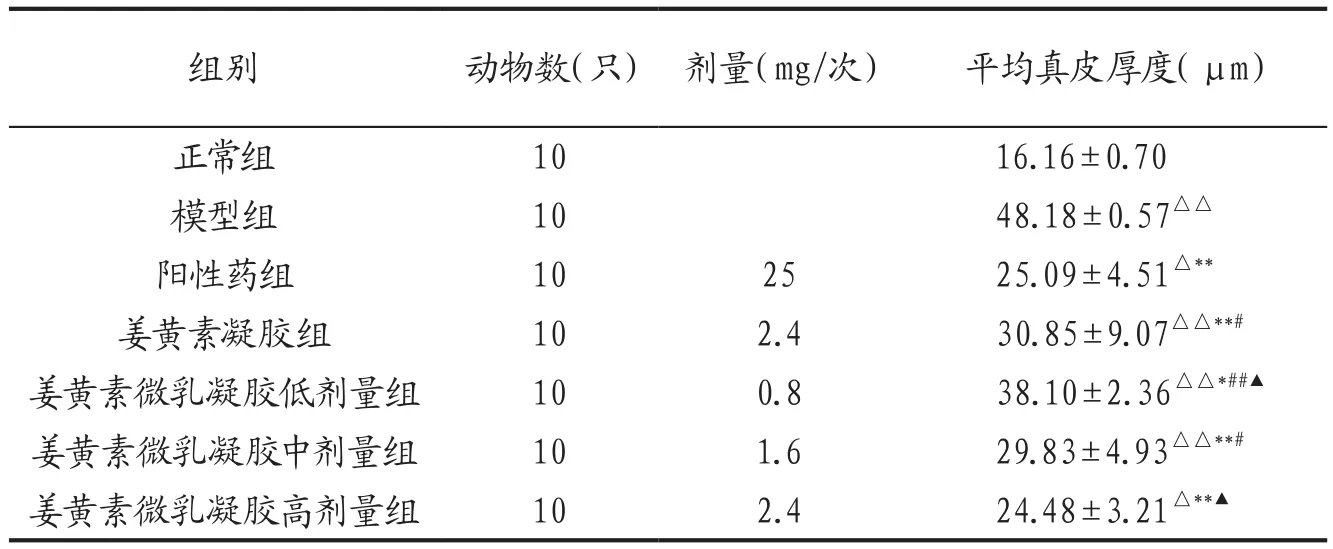
表2 各組小鼠真皮厚度比較(±s)
注: 與正常組比較,△P<0.05,△△P<0.01 ;與模型組比較,*P<0.05,**P<0.01;與陽性藥組比較,#P<0.05,##P<0.01 ;與姜黃素凝膠組比較,▲P<0.05。
組別 動物數(只) 劑量(mg/次) 平均真皮厚度(μm)正常組 10 16.16±0.70模型組 10 48.18±0.57△△陽性藥組 10 25 25.09±4.51△**姜黃素凝膠組 10 2.4 30.85±9.07△△**#姜黃素微乳凝膠低劑量組 10 0.8 38.10±2.36△△*##▲姜黃素微乳凝膠中劑量組 10 1.6 29.83±4.93△△**#姜黃素微乳凝膠高劑量組 10 2.4 24.48±3.21△**▲
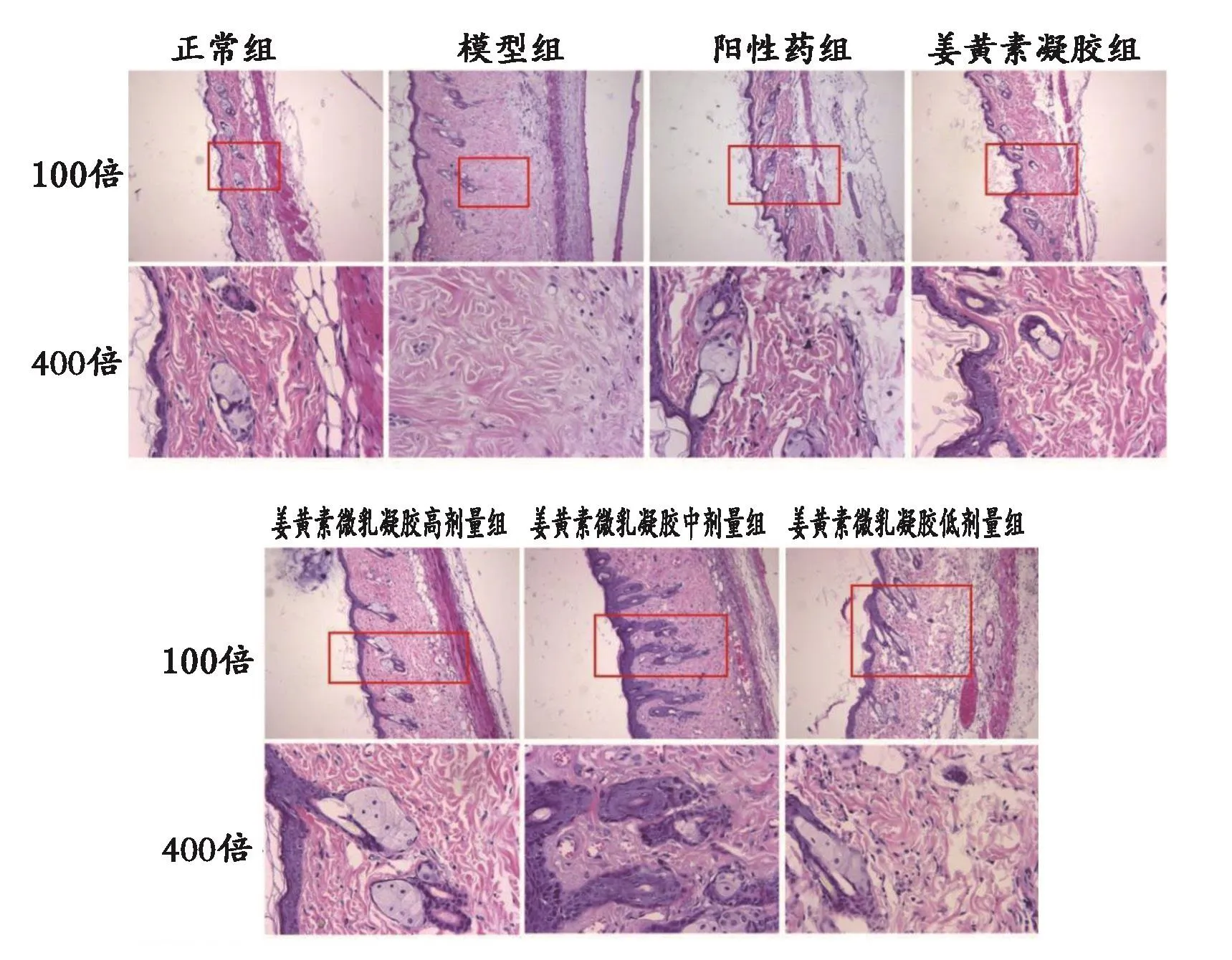
圖1 各組小鼠皮膚組織HE染色圖
表3 各組小鼠皮膚組織中的COLⅠ、MMP-9和TGF-β表達比較(±s)
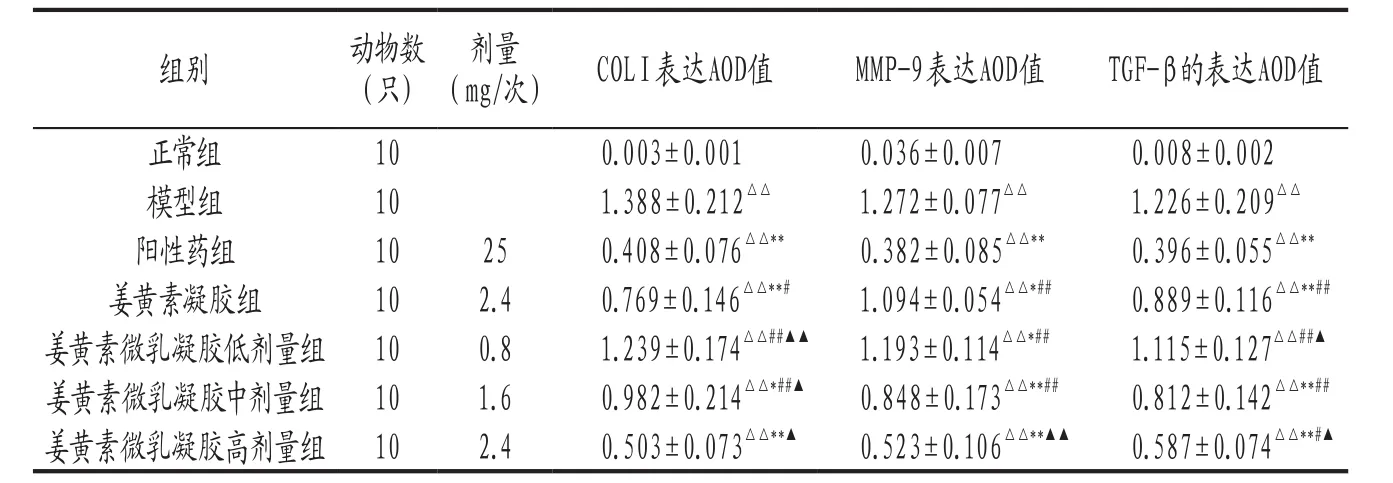
表3 各組小鼠皮膚組織中的COLⅠ、MMP-9和TGF-β表達比較(±s)
注: 與正常組比較,△△P<0.01 ;與模型組比較,*P<0.05,**P<0.01 ;與陽性藥組比較,#P<0.05,##P<0.01;與姜黃素凝膠組比較,▲P<0.05,▲▲P<0.01。
組別 動物數(只)劑量(mg/次) COLⅠ表達AOD值 MMP-9表達AOD值 TGF-β的表達AOD值正常組 10 0.003±0.001 0.036±0.007 0.008±0.002模型組 10 1.388±0.212△△ 1.272±0.077△△ 1.226±0.209△△陽性藥組 10 25 0.408±0.076△△** 0.382±0.085△△** 0.396±0.055△△**姜黃素凝膠組 10 2.4 0.769±0.146△△**# 1.094±0.054△△*## 0.889±0.116△△**##姜黃素微乳凝膠低劑量組 10 0.8 1.239±0.174△△##▲▲ 1.193±0.114△△*## 1.115±0.127△△##▲姜黃素微乳凝膠中劑量組 10 1.6 0.982±0.214△△*##▲ 0.848±0.173△△**## 0.812±0.142△△**##姜黃素微乳凝膠高劑量組 10 2.4 0.503±0.073△△**▲ 0.523±0.106△△**▲▲ 0.587±0.074△△**#▲
姜黃素因具有多靶點的藥理學作用而備受藥學界的關注,其在逆轉纖維化方面也有諸多報道[10-11]。一系列研究證實,姜黃素可多靶點逆轉肝、肺、腎及皮膚的纖維化,涉及基因及蛋白包括IFN-γ、MCP-1、TGF-β、CTGF、VEGF、TNF-α、IL-1、ET-1、AngⅡ等[1]。由此可見,姜黃素在治療纖維化和皮膚病領域有光明的前景。然而,藥物的研發除了確切的藥理作用和較小的毒性外,還需考慮其理化性質及生物藥劑學特性。姜黃素屬二酮類化合物,主鏈為不飽和脂族及芳香族基團,姜黃素不溶于水和乙醚,溶于乙醇和冰醋酸,在乙醇中的溶解度較小,僅為10mg/mL。此外,姜黃素在中性條件下不穩定,易水解為阿魏酸甲烷和阿魏酸[12]。姜黃素理化性質的缺陷限制了其的進一步開發和利用。以皮膚外用制劑為例,姜黃素雖可透過脂溶性的表皮,但其后在水性環境中可能釋藥緩慢,甚至尚未到達作用部位即被分解。因此,改變姜黃素的理化性質,對其的開發利用十分必要。微乳凝膠(microemulsion-based gels,MBGs)是在微乳中加入明膠、纖維素和卡波姆等水溶性高分子材料,形成透明和穩定的網狀結構膠體[13],是一種復合制劑,具有延長藥物維持時間,改善透皮速率等綜合優勢。因此,將姜黃素制備成微乳凝膠,可有效改善其釋藥特性,增加黏性,改善涂布性和延展性,最終增加藥效。本研究顯示,姜黃素微乳凝膠在減小真皮厚度,降低血清羥脯氨酸含量,降低TGF-β、MMP-9及ColⅠ表達等方面均優于姜黃素凝膠,與陽性藥積雪苷軟膏(積雪苷軟膏為目前臨床治療皮膚纖維化的一線用藥)相似甚至更優。后續的研究應當進一步優化姜黃素微乳凝膠的給藥劑量,并開展相關制劑的穩定性研究和中試生產研究,為姜黃素新劑型的進一步開發及臨床應用奠定基礎。

