廣西高考改革背景下有效解答高考化學離子共存問題的建議
韋福順
摘要:廣西高考歷年沿用全國卷,其中離子共存是全國卷高考中的高頻考點,其考察形式一般為選擇題,離子共存是基本考察點,但隨著高考改革的深入,該題型提升為粒子共存,并從無機物的共存擴大至有機物共存范疇,信息量增多,難度加大。該類型題目一直以來重視考察學生對于離子反應概念、離子的顏色、復分解反應、氧化還原反應概念、水解反應以及電解質溶解度的熟練掌握程度。現對高考改革背景下”離子共存”解題思路作如下分析,并提供解題的合理化建議。
關鍵詞:高考改革離子共存解題研究
在高中化學知識體系中,主干知識包含有離子反應與共存,考試大綱均有明確要求。廣西歷年沿用全國高考卷,縱觀近幾年全國高考化學試題,離子共存試題多以選擇判斷題出現,屬于高頻考點范疇。究其原因,離子共存問題與實際生產生活問題密切相關,故出此類題型亦是情理之中。結合實際生產生活進行命題,考查學生應用知識分析問題、解決問題的能力,符合新課程高考精神“由考查知識轉化為考查能力”[1]。現對離子共存問題進行題型整合,并就如何有效解答離子共存問題給出以下合理化建議。
1.“離子共存”解題研究
各離子間是否發生反應是離子共存的本質,若粒子間能發生化學反應則不共存。其次反應的發生,應關注復分解反應的發生條件,如有無沉淀、氣體、弱電解質產生,還應關注溶液酸堿性、顏色,能否進行氧化還原反應等。解答此類題目應充分結合題目已知條件再判斷,前文提過的解題思路將不再贅述。
1.1離子不能大量共存的規律
1.1.1有氣體產生
如CO32-、SO32-、HS-等易揮發的弱酸的酸根與H+不能大量共存,主要是由于HS-+H+=H2S↑。
1.1.2有沉淀生成或生成微溶物質
常見有CO32-與Ba2+、Ca2+、Cu2+、Zn2+等不能共存;或者OH-與Mg2+、Al3+、Fe2+、Cu2+、Ag+等不能共存;再比如AlO2-與HCO3-不能大量共存:AlO2-+ HCO3-+H2O=Al(OH)3↓+CO32-(發生不完全雙水解),比如:Cu2+、Fe3+不能與OH-大量共存,因為Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓。
1.1.3有弱電解質生成
如OH-、CH3COO-、HCO3-與H+不能大量共存,NH4+與OH-不能大量共存,主要是由于OH-+H+=H2O、HCO3-+H+=CO2↑+H2O;一些酸式弱酸根不能與OH-大量共存,是因為H2PO4-+2OH-=PO43-+2H2O等。
1.1.4易發生水解的離子,其存在于溶液中需要特定的環境
如S2-、CO32-、C6H5O-需在堿性條件下方可在溶液中大量存在。
1.1.5限定“雙水解反應”型
雙水解反應可分為不完全雙水解和完全雙水解兩類,特別注意區分的是NH4+等會發生不完全雙水解反應能大量共存的情況。該類型需考慮離子組中是否存在會發生雙水解反應的陰、陽離子。如Fe3+與CO32-、ClO—;Al3+與CO32-、HCO3-、S2-、AlO2-。
1.1.6限定“絡合反應”型
題目限定詞為“絡合反應”,則考慮是否存在發生絡合反應的離子。如SCN-與Fe3+、Fe3+與C6H5O-等會發生絡合反應而不能大量共存。
1.2“三步法”突破離子共存題型
1.2.1第一步:“審清題干關鍵點”
(1)審清“一定大量共存”“可能大量共存”“不能大量共存”等關鍵的限定詞。
(2)審清“透明溶液”代表該液體體系中無難溶物和微溶物,但并不代表溶液無色。
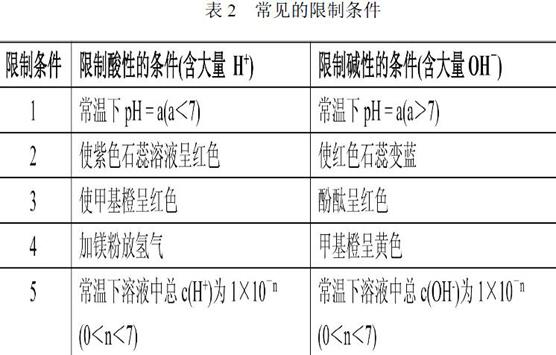
1.2.2第二步:“分析限制條件”
另外,包括如下可酸可堿的條件:常溫下由水電離c(OH-)或者c(H+)濃度為10-n(7 1.2.3第三步:“注意特殊情況” (1)NO3-氧化性的體現需在酸性溶液中; (2)ClO-在酸性、中性和堿性環境中均有較強的氧化性。 (3)一般來說,強氧化性粒子與強還原性粒子不能大量共存。如酸性條件下存在氧化性強的NO3-或MnO4-時,還原性強的Fe2+、S2-、I-、HS-、SO32-等也不能大量共存;存在強氧化性的Fe3+時,強還原性的S2-、I-、SO32-不能存在,但可能存在強還原性的Fe2+,因兩者沒有中間價態,不能發生氧化還原反應。 2.結語 綜上所述,有關離子共存問題在高考考查中一般會在題干部分附加條件,如有無顏色、因發生氧化還原反應而不能共存、常溫下pH=2或pH=12、溶液呈透明狀態等條件。通過對歷年高考題有關題型的整合研究發現,對廣西學生而言,在解答該題型時,由于不能清晰地解讀題目而導致答題錯誤。因此,在復習備考及平時的訓練中,教師應引導學生嚴格審題、避開陷阱,相信經過訓練之后學生能夠做到考慮全面,審題嚴格,答題準確。 參考文獻: [1]張世勇,胡喬生,鐘蕾.新課程背景下高考化學實驗題特點分析與啟示[J].教育理論與實踐,2010(7):15-17.

