超聲造影聯合聲輻射力脈沖成像技術在甲狀腺微小乳頭狀癌診斷中的研究
何燕蓮,余岳芬,徐小蘭,舒 婷,符春榮,李梅芬
(儋州市人民醫院超聲科,海南 儋州 571799)
甲狀腺微小乳頭狀癌(Papillary thyroid microcarcinoma,PTMC)是指甲狀腺癌原發病灶的最大直徑≤1 cm的乳頭狀癌,其發病率近年來有上升的趨勢且呈年輕化[1]。研究發現,超聲造影(Contrast-enhanced ultrasound,CEUS)及聲輻射力脈沖成像(A-coustic radiation force impulse-imaging,ARFI)技術對于良惡性腫瘤的鑒別有著重要的意義[2-3],但在甲狀腺病變的研究中正處于探索階段。本研究通過回顧性分析496例PTMC患者的CEUS及ARFI成像特征,探討CEUS及ARFI在PTMC診斷中的價值,旨在為PTMC的確診提供新的思路和方法。
1 資料與方法
1.1 研究對象
選取2013年1月—2016年12月海南省儋州市人民醫院行甲狀腺手術并在術前接受超聲檢查的患者496例,男 228例,女 268例,年齡18~63歲,平均(39.24±11.63)歲,共564個病灶。 納入標準:甲狀腺低回聲結節,結節最大直徑≤1.0 cm,經病理學證實者。排除囊性、囊實性或高回聲結節者。
1.2 儀器與方法
1.2.1 主要儀器
采用siemens Acuson S2000型超聲診斷儀,使用線陣探頭9L4,造影探頭頻率9.0 MHz,造影機械指數(MI)0.08,配備 ARFI技術及造影軟件。
1.2.2 檢查方法
先用常規彩色多普勒超聲對甲狀腺結節進行連續多切面掃查。常規超聲檢查后,啟用ARFI程序,取樣框置于結節中心,屏住呼吸,避免吞咽動作,將取樣框(大小6 mm×5 mm)置于甲狀腺結節最大切面處,獲得系統自動計算的剪切波傳導速度(Shear wave velocity,SWV),單位為 m/s,并測量患者遠離結節正常甲狀腺組織的SWV值,每個部位重復測值5次取中位值。儀器中出現x.xx m/s,在排除囊性病變后,將x.xx m/s記為9.00 m/s。進行CEUS時,使用萊科公司的造影劑聲諾維(SonoVue),將5 mL生理鹽水注入SonoVue凍干粉末中進行配置,振搖均勻。選擇合適切面的同時顯示完整的病灶及周邊正常組織,抽取1.8 mL造影劑經肘靜脈團注,隨后注入5 mL生理鹽水,保持切面不變,同時啟動計時器,連續觀察造影劑灌注過程,將CEUS動態全過程采集存儲于機器硬盤供后處理分析。
1.3 圖像分析
由兩位有10年以上工作經驗的醫師脫機分析所有腫塊的常規超聲圖像、ARFI圖像及CEUS圖像,均獨立完成診斷結果。如兩位醫師診斷結果不一致,則重新讀圖,達成一致后納入本研究。CEUS圖像分析結節為病灶顯影達峰時與周圍組織顯影強度比較,分為高增強、等增強及低增強。
1.4 統計學方法
采用SPSS 17.0統計軟件分析,計量資料以均數±標準差(±s)表示,兩組間比較采用獨立樣本t檢驗。計數資料以百分率(%)表示,組間比較采用χ2檢驗。評估常規超聲、CEUS及ARFI對PTMC的診斷效能,并應用受試者工作特征(ROC)曲線下面積(Area under cure,AUC)分析 SWV 對 PTMC 的診斷價值。P<0.05為差異有統計學意義。
2 結果
2.1 病灶特征
564個病灶中,良性病灶306個,包括結節性甲狀腺腫242個、甲狀腺炎38個、濾泡型腺瘤26個,最大直徑為0.5~≤1.0 cm的病灶197個,最大直徑<0.5 cm的病灶109個。惡性病灶258個,均為PTMC,最大直徑為0.5~≤1.0 cm的病灶142個,最大直徑<0.5 cm的病灶116個。
2.2 常規超聲特征
超聲聲像圖在鑒別PTMC中有統計學意義的是形狀、邊界、暈環、內部回聲及微小鈣化(P<0.01),而后方衰減差異無明顯統計學意義(P>0.05)(表1)。
2.3 CEUS特征
甲狀腺良性結節CEUS多表現為非向心性、環形增強、均勻增強,而PTMC多為向心性、不均勻低增強,造影劑早期消退明顯。以不均勻、低增強作為惡性結節的定性診斷標準。甲狀腺良性結節與PTMC在CEUS圖像特征中比較,差異均有統計學意義(P<0.01)(表 2)。
2.4 ARFI特征
PTMC結節內部SWV值及SWV比值明顯高于甲狀腺良性結節,差異有統計學意義 (P<0.05)。PTMC周邊組織SWV值與甲狀腺良性結節比較,差異無統計學意義(P>0.05)(表 3)。
2.5 CEUS、ARFI及兩者聯合對PTMC的診斷效能
CEUS或ARFI用于診斷PTMC的敏感度及特異度均明顯高于常規超聲,差異有統計學意義(P<0.05);CEUS聯合ARFI用于診斷PTMC的敏感度、特異度、準確率、陽性預測值及陰性預測值均優于CEUS 或 ARFI,差異有統計學意義(P<0.05)(圖 1,表 4)。
2.6 SWV對PTMC的診斷價值
SWV診斷PTMC的AUC及95%CI為0.894(0.836~0.958),當 SWV 取值為 3.65 m/s時,其診斷PTMC的敏感度、特異度、陽性預測值及陰性預測值均最好,分別為 87.3%、90.6%、92.3%和85.7%(圖1)。
3 討論
PTMC因其病灶較小,且無明顯臨床癥狀,給早期診斷帶來極大的困難。目前常規超聲對PTMC的診斷率較低,無法滿足臨床的需求。CEUS能夠檢出腫塊的微循環灌注情況和浸潤范圍,ARFI是一種定量評判組織硬度的技術,能夠獲得常規成像模式無法獲取的組織彈性信息,兩者為甲狀腺良惡性結節的鑒別診斷提供了新的技術支持。

表1 甲狀腺結節的常規超聲特征(例(%))
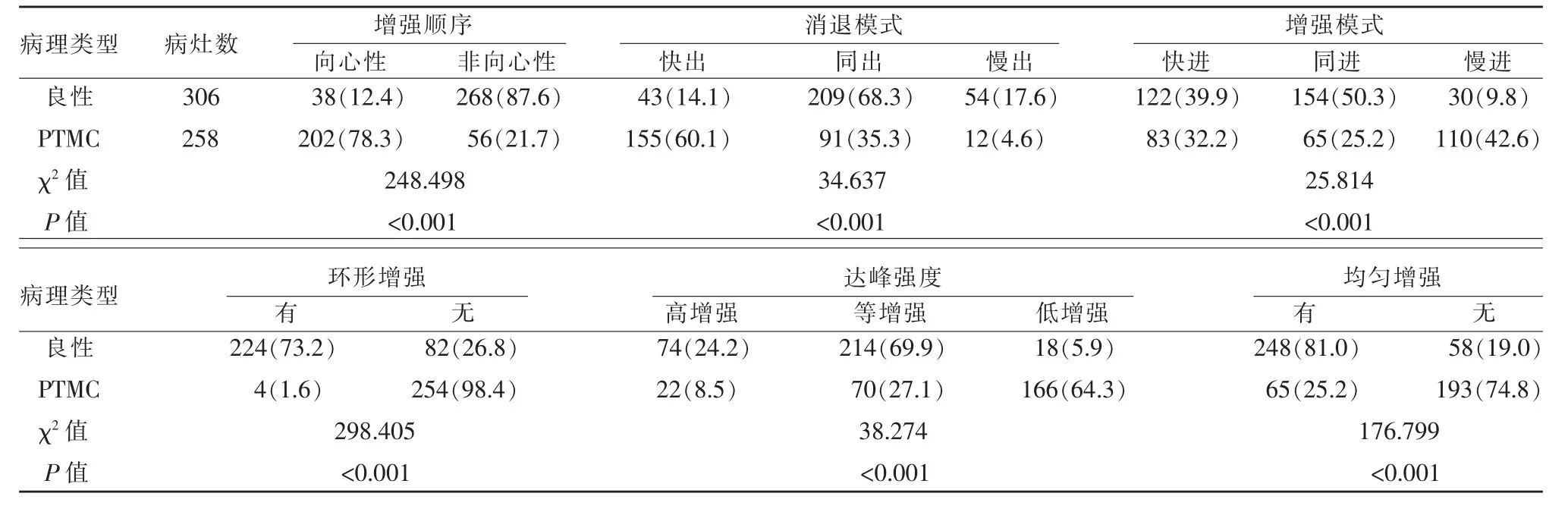
表2 甲狀腺結節的CEUS特征(例(%))
表3 甲狀腺結節的ARFI結果(±s)

表3 甲狀腺結節的ARFI結果(±s)
病理類型 結節內部SWV值 周邊組織SWV值 SWV比值良性 (2.02±0.93)m/s (1.96±0.84)m/s 1.05±0.46 PTMC (5.92±3.25)m/s (2.13±0.95) m/s 2.82±1.44 t值 6.914 1.062 5.017 P值 <0.001 0.358 0.023
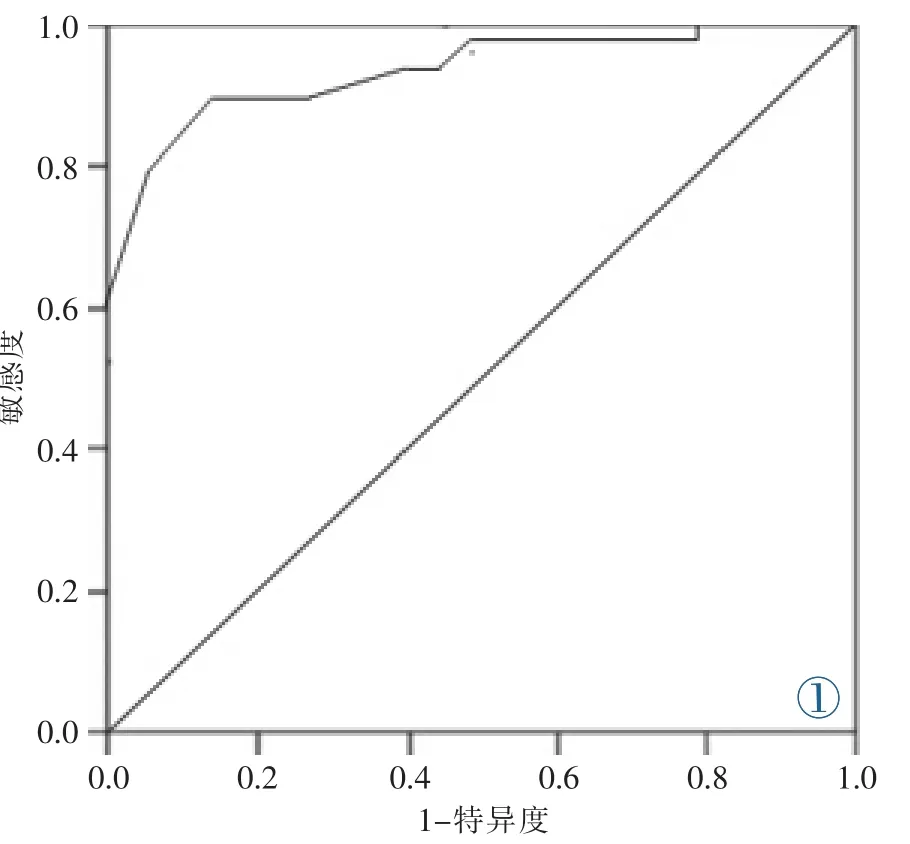
圖1 SWV診斷PTMC的ROC曲線。Figure 1.ROC curve of SWV for diagnosing PTMC.

表4 CEUS、ARFI及兩者聯合對PTMC的診斷效能
本研究中,良性結節常規超聲主要表現為形態規則、邊界清晰、無微小鈣化,CEUS表現為非向心性、環形增強、均勻等/高增強,ARFI顯示SWV值與周邊正常組織較接近,與既往研究[4-5]結果相似。結節性甲狀腺腫呈膨脹性生長,邊界清晰,形態規則(圖2)。良性結節在組織反復增生和修復的過程中,引起周邊纖維結締組織增生,故CEUS表現為環形增強。良性結節大多數表現為與周邊甲狀腺組織同進同退并等/高增強,是因為經歷了不同的增生、修復時期,在不同的病變發展的階段,結節內的血管分布特征不一,最終導致結節造影表現多種多樣。PTMC常規超聲表現為邊界不清、形態不規則、低回聲結節,CEUS大多數表現為向心性、不均勻低增強、造影劑早期消退明顯,ARFI顯示PTMC結節內部SWV值及SWV比值明顯高于甲狀腺良性結節,與王小燕等[6]研究結果相似。PTMC患者中有161個結節多次測量SWV值為“x.xx m/s”,經CEUS證實為實性病灶,說明甲狀腺結節硬度較硬,超出儀器的檢測上限,若實性結節測量SWV中出現“x.xx m/s”時,則高度提示惡性(圖3)。有研究表明,ARFI可反映甲狀腺腫瘤的硬度,有效評價腫瘤組織的彈性變化,從而有利于甲狀腺良、惡性病變的早期鑒別診斷[7]。He等[8]的研究也發現,ARFI通過SWV值的大小定量反映組織的彈性特征,SWV值越高,組織越硬、彈性越差,其惡性程度越高。國內外應用CEUS對甲狀腺結節的研究認為惡性結節多表現為不均勻低增強[9],也有研究指出CEUS增強程度與腫瘤大小相關[10],較大的惡性結節以高增強多見。

圖2 a 常規超聲表現為邊界清晰、形態規則。 圖2b CEUS表現為均勻高增強。 圖2c ARFI顯示SWV值為2.39 m/s。 圖3a 常規超聲表現為邊界不清、低回聲實性結節。 圖3b CEUS表現為不均勻低增強。 圖3c ARFI顯示SWV值為x.xx m/s(甲狀腺結節硬度超過上限)。Figure 2a. Conventional ultrasound shows clear boundary and regular shape. Figure 2b. CEUS shows homogeneous high en hancement.Figure 2c.ARFI shows that the SWV value is 2.39m/s.Figure 3a. Conventional ultrasound shows unclear boundary and hypoechoic solid nodule. Figure 3b. Contrast-enhanced ultrasound shows heterogeneous low enhancement. Figure 3c. ARFI shows that the SWV value is x.xx m/s(the hardness of thyroid nodules exceeds the upper limit).
我們應用不同超聲檢查方法評價其對PTMC的診斷價值,結果顯示CEUS或ARFI用于診斷PTMC的敏感度及特異度均明顯高于常規超聲,CEUS聯合ARFI用于診斷PTMC的敏感度、特異度、準確率、陽性預測值及陰性預測值均優于CEUS或ARFI。說明CEUS聯合ARFI應用在PTMC的診斷中較單一檢查方法具有更高的診斷價值,與Zhang等[11]研究結果相符合。有研究表明,CEUS、彈性成像及兩者聯合診斷甲狀腺癌的敏感度、特異度和準確率分別為 88.24%、90.34%、89.67%,85.29%、88.97%、87.89%,98.53%、96.55%、97.18%,兩者聯合的診斷效能明顯高于單一檢查方法[12]。此外,Liang等[13]研究也發現CEUS和ARFI對甲狀腺癌的檢出均有較高的價值,在<1 cm的PTMC診斷中兩者聯合檢出敏感性較高。本研究顯示,SWV診斷PTMC的AUC及 95%CI為 0.894(0.836~0.958),SWV 最佳診斷截點為3.65 m/s,診斷PTMC的敏感度為87.3%,特異度為90.6%,與Deng等[14]的研究結果相似。Friedrich-Rust等[15]的研究結果也表明,甲狀腺惡性結節的SWV值高于良性結節,將SWV≥3.30 m/s診斷為甲狀腺惡性結節,ARFI技術鑒別診斷良惡性結節的特異度為95%。
綜上所述,常規超聲能從形態學和血流動力學角度幫助判斷PTMC,CEUS及ARFI則從組織灌注血供及組織生物力學特性的角度提供常規超聲所不能顯示的診斷信息,CEUS聯合ARFI的應用能進一步提高PTMC診斷的準確率。

