大米中蛋白質含量測定方法初探
王 琦
(長治學院 生物科學與技術系,山西 長治 046011)
1 引言
蛋白質是食物的重要營養成分,對機體的生長、發育具有不可替代的作用。大米中所含蛋白因賴氨酸、蘇氨酸等幾種必需氨基酸的含量比其它禾谷類高[1],具有很高的營養價值。然而,當前以乳制品和糧食為代表的食品原料存在著較為嚴重的摻假現象,近年來陸續報道在糧食和乳制品中非法添加三聚氰胺等非蛋白含氮物質[2-4]。為降低生產成本,部分企業和商家向大米產品中添加非蛋白含氮物質以冒充高蛋白產品,干擾了市場秩序,對人體健康形成危害。
目前,國家標準規定的測定蛋白含量的方法是凱氏定氮法,其原理是通過檢測食品中氮的總含量來計算蛋白質含量,而非直接測量。此方法的弊端是在測定含有非蛋白氮的樣品時,結果會受到不同程度的干擾,從而使得蛋白質的表觀含量有所偏高[5]。針對該問題,建立一種不受非蛋白氮等其他因素干擾、能夠較準確地測定樣品中蛋白的方法來做為凱氏定氮法的補充就顯得勢在必行。
之前有學者采用考馬斯亮藍法(簡稱CBB法)測定了牛奶中蛋白質含量,發現在一定濃度范圍內,三聚氰胺、尿素和毛發水解物均不會對牛奶中蛋白質含量的測定結果造成干擾[6-9]。文章將以此為基礎,針對不同干擾物對三種大米蛋白含量測定方法的影響進行探究,旨在找到一種不受非蛋白含氮物干擾的測定來做為凱氏定氮法的補充,為相關食品檢驗提供一份有價值的參考數據。
2 材料與方法
2.1 材料
2.1.1 材料與試劑
大米粉、結晶牛血清白蛋白(BSA)、濃硫酸、硫酸鉀、硫酸銅、硼酸、甲基紅、考馬斯亮藍試劑(CBB試劑)、福林-酚試劑(Lowry試劑)。
2.1.2 儀器與設備
725S可見分光光度計、DK-S24型數顯電熱恒溫水浴鍋、BCD-290W型電子天平、K9840型全自動凱氏定氮儀、SH220型石墨消解儀。
2.2 方法
2.2.1 標準曲線的繪制
分別利用考馬斯亮藍G-250法(Bradford法)和福林-酚試劑法(Lowry法)繪制標準曲線[10]。
2.2.2 大米中蛋白質提取的正交實驗
文章采用堿消化法,依據下表所取NaOH濃度、溫度及時間,采用L9(34)正交表進行正交篩選實驗。

表1 正交實驗反應體系Table 1 Orthogonal experiment reaction system

圖1 考馬斯亮藍標準曲線數據圖

表2 考馬斯亮藍正交實驗結果和極差分析Table2 Coomassie brilliant blue of orthogonal experiment,the results and extreme difference analysis
2.2.3 大米中蛋白質含量測定方法比較
將大米粉以篩選的最佳消化條件進行處理,分別以CBB法和Lowry法測定蛋白質含量,并與凱氏定氮法測定結果作比較。
2.2.4 添加干擾物實驗比較
大米粉中添加無機非蛋白氮化合物對CBB法、Lowry法測定的影響,進一步確定方法的準確性和精確度。
3 結果
3.1 標準曲線的繪制
由圖1、2結果可以看出,測定的標準曲線線性回歸方程良好(R2>0.99),滿足后續實驗要求。
3.2 正交實驗
3.2.1 極差分析

表3 Lowry正交實驗結果和極差分析

表2 考馬斯亮藍正交實驗結果和極差分析Table 3 Lowry orthogonal experiment results,and extreme difference analysis
由表2、3可以看出,影響考馬斯亮藍法的主次因素是A(NaOH濃度);B(溫度);C(時間),其最優條件是:A3B2C1,即:0.1 mol/L NaOH,35℃,60 min;而影響Lowry法的主次因素是A(NaOH濃度);B(溫度);C(時間),其最優條件是:A3B2C1,即:0.1 mol/L NaOH,35℃,60 min。
3.2.2 方差分析
通過對表2,3的數據進行整理,分別繪制出兩種方法的方差分析表,見表4、5。
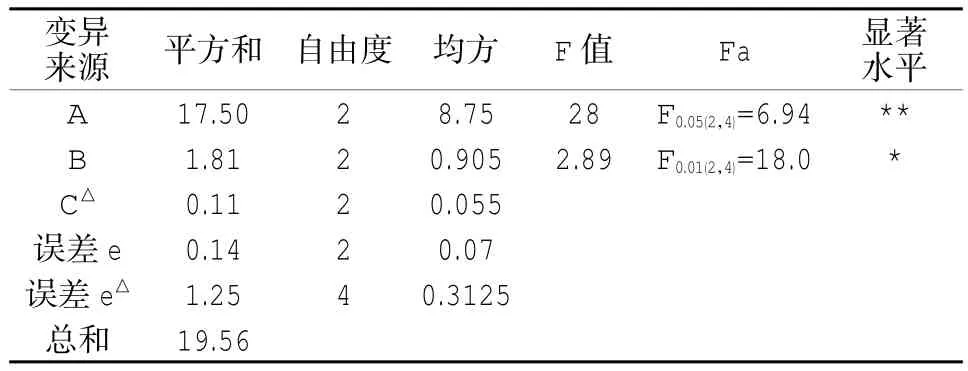
表4 考馬斯亮藍方差分析表Table 4 Coomassie brilliant blue difference analysis table
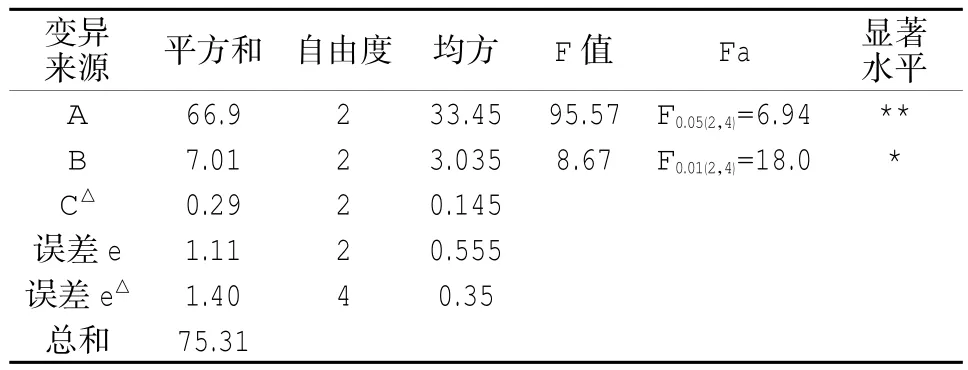
表5 Lowry方差分析表Table 5 Lowry anova table
據表4、5可以得出,因素A高度顯著,因素B顯著,因素C不顯著。因素主次順序A-B-C,與極差分析基本吻合。對因素A、B分析,確定優水平為A3、B2;因素C的水平改變對試驗結果幾乎無影響,可從經濟、操作等角度考慮取值,選C1。最優水平組合為 A3B2C1。即:0.1 mol/L NaOH,35℃,60 min;結合極差分析和方差分析可得采用考馬斯亮藍法測得的最優蛋白含量為7.14%,采用Lowry法測得的最優蛋白含量為9.26%,二者分別與凱氏定氮法測得的含氮量8.7%相比,可知Lowry法準確度更高。
3.3 三種測定方法的比較
由表6可以看出,CBB法測定蛋白質含量的結果較凱氏定氮法明顯偏低,從78.22%到80.33%不等。考馬斯亮藍主要與蛋白質中的堿性氨基酸和芳香族氨基酸結合,而不同種類的蛋白質中以上兩類氨基酸的含量和比例差別較大。Lowry法的測定結果與凱氏定氮法相比則表現出基本接近的趨勢,這是因為在Lowry法的顯色反應中起作用的有兩方面的因素:一是蛋白質肽鏈中的肽鍵與堿性銅溶液中的Cu2+結合在堿性條件下可以形成絡合物;二是絡合物將酚試劑還原生成鉬藍-鎢藍藍色化合物,兩步反應疊加的效果是減弱了因蛋白質種類所導致的誤差。

表6 凱氏定氮法、CBB法和Lowry法測定結果比較Table 6 Comparison of determination results by Kjeldahl,CBB and Lowry Method
3.4 干擾物添加實驗比較

表7 大米樣品添加干擾物實驗結果Table 7 Interference effect of supplements to protein determination of rice
由表7實驗結果表明,本次實驗嘗試的非蛋白氮干擾物中,三聚氰胺的加入量低于300 g/kg時,對測定結果無明顯干擾作用,誤差基本保持在3%以內,相比而言,對CBB法的影響更大一點。尿素的含量在低于100 g/kg時,對測定結果基本沒有影響,而隨著加入量的繼續增加,CBB法和Lowry法的測定數據均有一定程度的下降,其中CBB法表現更為明顯。硫酸銨對蛋白質含量的測定的影響最為微弱,添加量超過50 g/kg時,蛋白質的測定結果反而呈現下降的趨勢。
4 討論
(1)凱氏定氮法不是直接測出蛋白質的含量,而是通過測定樣品中氮元素的總含量來間接計算蛋白含量。通常情況下,糧食和食品中的含氮物質主要是蛋白質,因此利用凱氏定氮法測蛋白含量一般來說比較可靠。可是,一旦有人在樣品中添加非蛋白含氮物質,這個方法就不那么準確了,蛋白質含量的測定結果會不同程度地偏高,從而帶有虛假性和誤導性。
(2)CBB法操作簡單,只需加入一種染料;反應迅速,大約要2 min可以完成,且顯色結果能在1 h之內保持穩定,較Lowry法省時。但此法的缺點是由于考馬斯亮藍G-250與不同種類蛋白質的結合能力存在差異,因此可能引起不同程度的偏差。本次實驗結果與凱氏定氮法相比有較明顯的偏低,從78.22%到80.33%不等[11-13]。
(3)Lowry法作為一種公認的測定微量蛋白的方法,因其作用機制是由兩步疊加的顯色反應組成,克服了CBB法由蛋白質種類引起偏差的缺點[14-17]。但是Lowry法存在試劑乙的配制較為繁瑣、需嚴格控制反應時間以及耗時長等弊端,不過可以利用商品化的試劑盒,解決這一問題。本實驗的蛋白質含量測定的結果與凱氏定氮法相當,與前人文獻所述大體相同[18,19]。
三種方法對標準蛋白和大米蛋白的測定結果顯示:Lowry法的測定數據與凱氏定氮法的符合度達到90%以上,而CBB法的測定結果則較凱氏定氮法呈現偏低的趨勢,平均符合度為70%~80%,從而得出:Lowry法準確度更高。
5 結論
文章在非蛋白氮干擾物的添加實驗中,采用CBB法和Lowry法作為蛋白質含量的測定方法時,三種干擾物對大米蛋白質含量的測定結果均無明顯干擾作用。三聚氰胺在加入量低于300g/kg時對CBB法和Lowry法的測定結果基本無影響;尿素和硫酸銨對這兩種方法測定結果的干擾也較小,隨著添加量的增加,蛋白質含量的測定結果反而呈現下降趨勢。三聚氰胺作為一種化工原料,動物(及人類)長期攝入會造成生殖、泌尿系統的損害,引起尿路結石,所以我國嚴禁在食品、飼料中添加三聚氰胺。結合本實驗結果,我們可以推測:在加強國家食品藥品監管力度的同時,以凱氏定氮法為參考,選用其他一種或多種蛋白質檢測方法,盡量降低甚至避免非蛋白氮的干擾,以求更加準確地測定食品和飼料中蛋白質的實際含量,為人類和動物的健康筑起一道堅固的防線。

