心肌原位緩釋胎盤生長因子納米粒注射用于大鼠心肌梗死的效果評價
包華健,何 靜
0 引言
心肌梗死(Myocardial infarction,MI)使疤痕形成,影響心臟的收縮功能,最終導致心力衰竭[1],其治療方式包括藥物治療、心臟移植和植入式左心室輔助裝置(LVADs)。然而器官供體供應有限,LVAD并發癥發病率高[2]。理想的治療方法是能夠通過血管再生來促進新的心肌細胞生成并刺激缺血區的血管生成來保持心臟功能[1,3]。
胎盤生長因子(PLGF)可刺激新生血管形成,改善心臟功能。PLGF屬于血管內皮生長因子(Vascular endothelial growth factor,VEGF)家族成員,與VEGF比較,PLGF不僅具有更強的促進血管新生作用,且很少有低血壓、水腫、纖維素沉積以及刺激新生血管瘤等不良作用[4]。
盡管心肌梗死的藥物治療取得了進展,但遞送生長因子仍然是一個具有挑戰性的過程,因為大多數生物因子不留在指定的部位(即梗死組織)。原因可能包括遞送方式、局部酶退化、動物樣本的差異和收縮心肌“洗脫”機制[5-7],可通過納米粒子來實現藥物遞送。以往的PLGF遞藥途徑存在易分解代謝、分布不均等問題。殼聚糖和海藻酸鈉具有較好的生物相容性和極小毒性,可用于制備微膠囊,在臨床胰島細胞移植研究中可選擇殼聚糖/海藻酸鈉作為胰島細胞載體[8]。同時,海藻酸鈉是第一種進入臨床試驗治療心梗的材料,其缺點是親水性過強,不易與細胞結合,殼聚糖結合可以改善海藻酸鈉與細胞間的相互作用[9]。我們選擇殼聚糖/海藻酸鈉作為納米遞送材料,其主要優勢在于:納米粒性質穩定;一次給藥后,藥物可緩慢釋放較長時間;良好的生物相容性;降解產物無毒性[6]。本研究中,我們首次在心肌內注射載PLGF殼聚糖-藻酸鹽納米粒,推測其可提供持續緩釋保護效果,加速缺血性心肌病大鼠模型中的心肌恢復。
1 材料和方法
1.1 材料
1.1.1 實驗動物 雌性Lewis大鼠(體重200~250 g;由上海斯萊克實驗動物中心提供)。平衡飼養1周后,將大鼠分組。
1.1.2 主要試劑 來自棕藻的低黏度海藻酸鈉鹽(黏度:250 cP,2%水溶液),購自Sigma Chemicals(St Louis,MO)。殼聚糖(低黏度,73.5%脫乙酰),購自Wako BioProducts(Richmond,VA)。重組PLGF購自R&D Systems公司(Minneapolis,MN)。
1.1.3 儀器 微尖探頭超聲波超聲儀(Branson 2510;克利夫蘭,俄亥俄州);超速離心機(Optima MAX;美國Beckman公司);G1316A溫控箱;CM-200 FEG透射電子顯微鏡(Philips,Markham,加拿大);Zeta電位分析儀電泳激光多普勒測速儀(Brookhaven Instruments Corp,Holtsville,NY);ZetaPlus粒度測定儀(v4.11;BrookhavenInstruments Corporation);7/0聚丙烯縫合線(Ethicon Inc,Somerville,NJ);胸超聲心動圖(飛利浦IE33,12 MHz探頭)。
1.2 方法
1.2.1 殼聚糖-海藻酸鈉納米粒的制備 參考Rajaonarivony等[10]的方法。將氯化鈣溶液(2 ml,0.67 mg/ml)滴加至濃度為1.0 mg/ml PLGF的10 ml海藻酸鈉溶液(0.6 mg/ml),同時用微尖探頭超聲儀處理1 min(50 W)。將所得的藻酸鈣預凝膠移至燒杯中,攪拌30 min,然后加入3% v/v乙酸的殼聚糖溶液(2 ml,0.3 mg/ml)攪拌30 min。將所得懸浮液放置24 h,4 ℃ 140 000 g超速離心60 min分離納米粒;通過超聲處理將所得沉淀物重新分散于蒸餾水中1 min,通過超速離心將納米粒在水中洗滌2次。空白納米粒采用相同的制備方法,制備過程中不加PLGF。
1.2.2 載PLGF殼聚糖-藻酸鹽納米粒的體外釋放 載PLGF納米粒懸浮于20 ml磷酸鹽緩沖鹽水(pH=7.4)中,置于37 ℃的恒溫環境中水平搖動(100 r/min)。于適當時間間隔,分別取出1 ml培養基,并以等量磷酸鹽緩沖鹽水補充至釋放介質。通過PLGF酶聯免疫吸附測定法(ELISA)測定不同時間釋放的PLGF濃度。
1.2.3 納米粒子的形態及粒徑 Zeta Plus粒度測定儀和透射電鏡分別確定納米粒子尺寸分布和形態,Zeta電位分析儀測量Zeta電位。測量3次,取平均值。
1.2.4 動物模型建立與分組 大鼠隨機分為4組,除假手術組外,每組10只:對照組Ⅰ(空白殼聚糖-藻酸鹽納米粒),治療組Ⅱ(1 μg重組PLGF與生理鹽水稀釋成300 μl),治療組Ⅲ(1 μg重組PLGF殼聚糖-海藻酸鹽納米粒用生理鹽水稀釋成300 μl),組Ⅳ為假手術組(n=5)。大鼠心肌梗死模型建立步驟如下[5]:插管和機械通氣80次/min,5%異氟烷麻醉。無菌操作下于左胸前區第四肋間行胸廓切開術,暴露心臟,撕開心包膜,于左心耳下緣2 mm處用7-0縫合線結扎左冠狀動脈前降支。進針深度約2 mm(假手術組只穿線,不結扎)。導致游離左心室(LV)心肌梗死,隨后心力衰竭。結扎動脈15 min后,27-G針管行3次心肌梗死內注射,將物質注射至梗塞周圍區域。定期監測動物的體重和死亡率。PLGF殼聚糖-藻酸鹽納米粒經心肌內遞送至梗塞大鼠心臟的示意圖見圖1。

圖1PLGF殼聚糖-藻酸鹽納米粒經心尖原位注射遞送至梗塞大鼠心臟的示意圖
1.2.5 超聲心動圖 冠狀動脈結扎術前及術后2 d、1周、4周及8周,異氟烷麻醉下進行超聲心動圖檢查(2.5%氧氣,500~700 ml/min),以胸骨旁短軸切面,M超測量左室舒張末期內徑(LVEDD)、左室收縮末期內徑(LVESD)。LVEDD、LVESD以連續3個心動周期測量值的平均值作為監測數據。左心室縮短分數(LVFS)=(LVEDD-LVESD)/LVEDD×100。根據Teichholz公式[11]計算左室射血分數(LVEF)、左室舒張末期容積(LVEDV)和左心室收縮末期容積(LVESV)。
1.2.6 疤痕面積分析 術后8周,處死大鼠后迅速開胸切取心臟,生理鹽水清洗并去除心腔內殘余血液,于4%福爾馬林中性緩沖液中固定。保存24 h后經石蠟包埋,取5 μm厚的切片行病理組織學檢查,Masson染色定量測定疤痕組織(藍色)。應用圖像處理軟件Image J測量梗死面積并取平均值[12],梗死面積=(瘢痕內弧長+瘢痕外弧長)/(外周長+內周長)×100%。
1.2.7 免疫組化檢測梗死邊緣區評估血管生成 采用免疫組化技術檢測大鼠心肌梗死邊緣區血小板-內皮細胞黏附分子(CD31)陽性的內皮細胞數量,評估新生毛細血管情況,檢測抗α平滑肌肌動蛋白(α-SMA)陽性平滑肌細胞數量,評估新生小動脈情況。為測量毛細血管密度,5處梗死面積成像,對直徑<10 μm的毛細血管平均數計數。將毛細血管密度定量為(總CD31陽性微血管平均數)/mm2,使用3個組織切片跨越每個動物的梗死周圍組織區域。小動脈密度定量為(總平滑肌肉α-SMA陽性微血管平均數)/mm2。
1.2.8 可溶性細胞因子的血清濃度 8周后,通過直接心臟穿刺從每只大鼠的左心房收集心臟、血液樣本,14 000 r/min離心10 min,之后將樣品于-20 ℃條件下儲存。按照大鼠鈉尿肽ELISA檢測試劑盒(CBS-E07972R,CUSABIO,中國)說明書提供的實驗步驟進行檢測[13]。
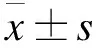
2 結果
2.1 樣本量和死亡率 35只雌性Lewis大鼠,8只大鼠死亡,死亡率為23%,其中27只大鼠存活至2個月的實驗終點,8只大鼠死亡發生在第1次冠狀動脈結扎后48 h。不同群體死亡率差異不明顯,48 h后大鼠無死亡情況。
2.2 納米粒子的表征 透射電鏡分析證實,PLGF殼聚糖-藻酸鹽納米粒的直徑約100~200 nm(圖2),球形,“毛絨”表面。粒子正極Zeta電位(7.2±0.5)mV,包封效率38.4%±3.4%。
2.3 體外釋放動力學 體外釋放研究中,在前24 h內,藥物釋放有限,但在48 h,由于納米粒隨著時間的推移逐漸降解,生長因子快速釋放,120 h后無藥物釋放(圖3)。

圖2 PLGF殼聚糖-藻酸鹽納米粒的表征

圖3 PlGF隨時間變化的體外釋放動力學
2.4 超聲心動圖測量
2.4.1 LVF測量 心肌梗死前,心肌梗死后注射空納米粒、PLGF及PLGF納米粒后2個月的大鼠心臟如圖4所示。術前和心肌梗死后2 d組間LVFS比較差異無統計學意義(P>0.05);雙向ANOVA分析顯示,心肌梗死后1周,組間LVFS平均值差異有統計學意義,組Ⅱ與組Ⅲ比較差異無統計學意義(95%CI-4.3~3.9,P>0.05),組Ⅱ和組Ⅲ高于組Ⅰ;在心肌梗死后4周,組間LVFS平均值差異有統計學意義,組Ⅱ低于組Ⅲ(95%CI-0.3~7.9,P<0.05),組Ⅱ和組Ⅲ高于組Ⅰ;在梗死后8周,組間LVFS平均值差異有統計學意義,組Ⅱ低于組Ⅲ(95%CI-0.2~8,P<0.05),組Ⅱ和組Ⅲ高于組Ⅰ。
2.4.2 LVEF測量 術前和心肌梗死后2 d,LVEF比較差異無統計學意義(P>0.05)。雙向ANOVA分析顯示,心肌梗死后1周,組間LVEF平均值差異有統計學意義,組Ⅱ與組Ⅲ比較差異無統計學意義(95%CI-6.9~5.5,P>0.05),但是組Ⅱ和組Ⅲ高于組Ⅰ;心肌梗死后4周,組間LVEF平均值比較差異有統計學意義,組Ⅱ低于組Ⅲ(95%CI-4.3~16.7,P<0.01),組Ⅱ和組Ⅲ高于組Ⅰ;在心肌梗死后8周,組間LVEF平均值差異有統計學意義,組Ⅱ低于組Ⅲ(95%CI3.3~15.7,P<0.01),組Ⅱ和組Ⅲ高于組Ⅰ。見圖4。
2.5 疤痕面積測量 單向ANOVA分析顯示,心肌梗死8周后組間疤痕面積百分比差異有統計學意義,即組Ⅰ與組Ⅱ比較,95%CI0.61~8,P<0.01;組Ⅱ與組Ⅲ比較,95%CI0.2~7.6,P<0.01;組Ⅰ與組Ⅲ比較,95%CI4.5~11.9,P<0.01。見圖5。

圖4 超聲心動圖分析心臟功能

圖5 各組急性心臟梗死程度比較
2.6 血管生成測量 單向ANOVA分析顯示,梗死后8周,組間毛細血管密度平均值差異有統計學意義,組Ⅰ與組Ⅱ比較,95%CI-66.2~-28.8,P<0.01;組Ⅱ與組Ⅲ比較,95%CI-66.6~-29.2,P<0.01;組Ⅰ與組Ⅲ比較,95%CI-114.1~-76.7,P<0.01(圖6A~圖6C)。每組平均毛細血管密度如圖6G所示。
在心肌梗死后8周,組間平均小動脈密度差異有統計學意義,組Ⅰ與組Ⅱ比較,95%CI-8.6~-2.3,P<0.01;組Ⅱ與組Ⅲ比較,95%CI-6.76~-0.3,P<0.01;組Ⅰ與組Ⅲ比較,95%CI-12.12~-5.8,P<0.01。見圖6D~圖6F。每組平均小動脈密度如圖6H所示。
2.7 血清細胞因子測量 單向ANOVA分析顯示,在心肌梗死8周后,組間平均細胞因子水平差異有統計學意義,見圖7。組間血清TNF-α水平比較:組Ⅰ與組Ⅱ比較,95%CI1.2~7.8,P<0.01;組Ⅱ與組Ⅲ比較,95%CI0.7~7.3,P<0.022;組Ⅰ與組Ⅲ比較,95%CI5.2~11.8,P<0.01)。組間血清IL-6水平比較:組Ⅰ與組Ⅱ比較,95%CI10.3~59.3,P<0.01;組Ⅱ與組Ⅲ比較,95%CI5.8~54.8,P<0.01;組Ⅰ與組Ⅲ比較,95%CI40.6~89.6,P<0.01。組間IL-10比較:組Ⅰ與組Ⅱ比較,95%CI-1.4~-0.04,P<0.01;組Ⅱ與組Ⅲ比較,95%CI-1.5~-0.1,P<0.01;組Ⅰ與組Ⅲ比較,95%CI-2.2~-0.8,P<0.01。
3 討論
心力衰竭最常出現的是缺血性心臟病[14],血管生成是一種治療缺血性心臟病的新方法,PLGF已在臨床應用了近20年。Kolakowski等[15]證明,PLGF直接心肌注射,對心肌梗死后的心臟有積極影響。本研究中,在比較組Ⅰ和組Ⅱ的LVEF、瘢痕面積和血管生成分析時得到類似的結果,本研究通過使用與先前研究相同的PLGF劑量來優化蛋白質遞送。

圖6 梗死周圍區域的血管生成和動脈生成比較

圖7 梗死后8周各組的血清細胞因子水平比較
PLGF納米粒的體外釋放時間數據和在4周時改善的心臟功能情況差異較大,可能的原因是心肌的恢復時間。急性心肌梗死后,心肌進入冬眠狀態或所謂的“心肌震顫”。這種異常可以持續幾個星期或幾個月,并有可能通過血運重建[16]。本研究中,血運重建通過PLGF注射完成。PLGF納米粒的體外釋放在第5天達到高峰,而在單獨注射PLGF的組Ⅱ中,PLGF沒有得到保護,大部分丟失,組Ⅲ中PLGF受到納米粒保護持續釋放5 d。與組Ⅱ比較,組Ⅲ血管生成更多。心肌需要一段時間才能恢復,因此,大部分心肌處于冬眠狀態。結果表明,與注射空納米粒子或單獨PLGF比較,PLGF納米粒子遞送增加心臟功能。此外,心肌梗死后,殼聚糖-藻酸鹽納米粒為PLGF提供了持續一段時間的緩釋保護機制。可以假設這些納米粒使PLGF免受局部酶促降解,從而延長了生長因子的作用。
LVEF、瘢痕面積和小動脈密度的顯著改變伴隨著血清細胞因子水平的明顯改變。以前的研究集中在MI后細胞因子的組織表達,而少數細胞因子研究實際上集中在血清水平的變化[17-18]。因此,我們的研究重點主要是TNF-α、IL-6和IL-10的血清水平。TNF-α和IL-6通過引起重構而對梗死心肌產生負面影響,而IL-10可以抵消這種影響。與其他組相比,組Ⅲ TNF-α和IL-6促炎細胞因子的血清水平明顯較低。此外,組Ⅲ IL-10抗炎心臟保護性細胞因子的血清水平明顯較高。與其他組比較,組Ⅲ左室重構更少,依據LVESD從基線變化最小,還有瘢痕形成的減少。MI后持續8周高水平的促炎細胞因子并不罕見,因為重塑過程可能會在MI后持續數周或者數月[18]。此外,研究表明,大鼠血漿TNF-α在MI后2周顯著升高,在8周逐漸達到峰值[19]。同樣,間充質干細胞通過減少炎癥/抗炎細胞因子的比例治療心肌重塑[20]。
與急性MI后直接應用生長因子比較,納米粒作為PLGF遞送載體的使用導致LV功能、血管密度和抗炎細胞因子IL-10顯著增加,瘢痕面積形成和促炎性細胞因子TNF-α和IL-6顯著減少。因此,可以使用納米粒來提供持續的緩釋保護性PLGF治療,增強生長因子在急性心肌缺血情況下的積極作用。此外,這種納米技術可以用作許多抗心力衰竭藥物的藥物遞送系統。這樣可以將大部分藥物保留在指定區域,并使全身毒性最小化,但仍需要進一步優化的方法進行實驗和研究,促進新的治療方式產生。

