不同水解度豬骨蛋白水解物對水包油型乳狀液乳化特性的影響
劉昊天,李媛媛,汪海棠,孔保華*
乳狀液是由一種液體以液滴的方式分散在另一種與其不相溶的液體中所組成的非均相體系[1]。乳狀液一般分為水包油(O/W)與油包水(W/O)兩種類型,這兩種類型的乳狀液被廣泛的應用于化妝品、護膚品,以及制藥業,但前者在食品領域中應用的更為廣泛[2]。乳狀液一經形成,隨后在預期的貨架期內使其保持穩定是至關重要的。乳狀液的分層,絮凝和聚集等機制都會對乳化體系的穩定性造成破壞[3]。而許多蛋白質是表面活性物質,可以作為乳化劑應用于乳狀液的制備中,因為在其多肽鏈上含有許多具有親水性和疏水性的氨基酸,它們可以吸附到油水界面上并包裹由均質化所形成的油滴[4]。同時因為它們含有帶負電(—COO-)以及帶正電荷(—NH3+)的氨基酸,因此可以產生靜電斥力,起到穩定液滴、防止聚集的作用[5]。
動物鮮骨是畜禽屠宰加工中主要的副產品,約占胴體的10%~15%[6]。鮮骨中含有許多營養物質,如礦物質、蛋白質、脂肪、磷蛋白和磷脂質等,蛋白質約占總體營養成分的11%~15%,其中90%為骨膠原及軟骨素。我國是畜肉生產大國,以往的加工過程中主要對象是肉類,而其副產物往往被忽視,大量的畜禽骨骼得不到利用或者加工產品價值低,從而使得資源浪費并造成了一定的環境壓力。國內外針對畜禽骨骼的加工主要是將其制成骨粉用作動物飼料,以及提取營養元素應用于保健食品中,此外,近年來有利用骨蛋白酶解產物制備功能性多肽的研究。酶法水解條件溫和,通過酶水解可以提高蛋白質的溶解度并使其位于內部的功能性基團更好地暴露出來。刁靜靜等[7]研究表明通過酶解處理可將短時間加熱處理或一般加工溫度難以利用的骨膠原蛋白水解成多肽及L-氨基酸以此來提高其營養價值。劉騫等[8]對不同水解度的豬血漿蛋白的抗氧化能力進行了研究,結果表明豬血漿蛋白水解物的抗氧化能力隨著水解度的提高而顯著增強,Xu Xingfeng等[9]的研究發現水解天然谷蛋白會改善其乳化活性(emulsion activity index,EAI)和乳化穩定性(emulsion stability index,ESI),并且適度水解的谷蛋白水解物具有最高的物理穩定性。李媛媛等[10]利用堿性蛋白酶對玉米蛋白進行水解,探討了水解后玉米蛋白乳化能力及抗氧化能力提高的機制,為制備乳化能力高且具有一定抗氧化能力的玉米蛋白水解物提供一定的理論參考依據。
目前,現有關于酶水解的研究主要集中在單相(溶液)體系中,缺乏在多相體系中的深入探討,因此本實驗以不同水解時間為出發點,對不同水解度的豬骨蛋白水解物(porcine bone protein hydrolysates,PBPH)在乳化體系中的作用機理進行探討,優化出可以應用于乳狀液體系中的PBPH乳化性的平衡點,探討不同水解度的PBPH增強乳化性的作用機制,以此提高豬骨蛋白利用價值并為后續其在乳化體系中的應用提供數據基礎。
1 材料與方法
1.1 材料與試劑
豬腿骨 北大荒肉業有限公司;堿性蛋白酶Alcalase 丹麥Novo公司;鄰苯二酚紫、菲啰嗪、Ans-熒光探針 美國Sigma公司;九三一級大豆色拉油九三糧油工業集團有限公司;磷酸氫二鈉、磷酸二氫鈉、硫酸銅、氫氧化鈉、十二烷基硫酸鈉(sodium dodecyl sulfate,SDS);過硫酸鉀、鹽酸、亞硫酸鈉、氯化亞鐵、三氯乙酸、硫代巴比妥酸、3%過氧化氫等均為國產分析純。
1.2 儀器與設備
FE20K型pH計、AL-104型精密電子天平 上海梅特勒-托利多儀器設備有限公司;DK-8B電熱恒溫水浴鍋上海精宏實驗設備有限公司;JB-2恒溫磁力攪拌器上海雷磁新徑儀器有限公司;722可見光分光光度計上海第三分析儀器廠;XW-80A渦旋混合器 上海精科實業有限公司;FD-2A冷凍干燥機 北京博醫康試驗儀器有限公司。
1.3 方法
1.3.1 豬骨蛋白的制備
剔除豬腿骨上的非骨物質(肉、皮、骨膜等),將骨骼粉碎至1~2 cm3,在室溫下將骨碎片以10%的比例置于0.6 mol/L鹽酸溶液中浸泡24 h以除去鈣、磷等有機成分,浸泡結束后用自來水沖洗骨碎片,再將骨碎片移至0.1%的氫氧化鈣中浸泡至骨碎片呈現潔白色時,用稀鹽酸將骨碎片pH值調節至7,再用清水清洗除去雜質,將處理過的骨碎片在90 ℃煮制5~6 h,過篩后再除去油脂得到骨膠溶液,再將骨膠溶液進行冷凍干燥,所得骨蛋白粉利用雙縮脲法測量蛋白含量。
1.3.2 不同水解度PBPH的制備
參照刁靜靜等[7]的方法并稍作修改。將制備好的豬骨蛋白粉配制成底物質量分數為7%的蛋白溶液,置于初始溫度為25 ℃的水浴中進行加熱并將溶液的pH值調節至9.0,當溫度達到50 ℃時,加入堿性蛋白酶,使酶與底物質量比為1∶100,再進行振蕩水解,水解時間分別為0、1、2、3、4 h和5 h,反應過程中不斷加入1 mol/L的NaOH溶液使pH值保持恒定,記錄耗堿量,用于水解度的計算。水解結束后將溶液pH值調至7.0,之后將溫度升高至95 ℃,保持10 min使酶滅活。所得溶液在4 ℃ 、5 000×g離心15 min,經雙縮脲法測定蛋白含量后,取上清液進行真空冷凍干燥得到凍干粉,用于各項指標的測定。
1.3.3 水解度的測定
水解度的測定采用pH-stat法[11],水解度的計算公式如下:

式中:DH為水解度/%;h為單位質量蛋白質中被水解的肽鍵的量/(mmol/L);htot為單位質量蛋白質中肽鍵的總量/(mmol/L),骨蛋白htot為11.1 mmol/L;B為水解過程中的耗堿量/mL;Nb為堿液濃度/(mol/L);MP為水解液中蛋白質質量/g;1/α為校正系數(堿性蛋白酶為1.01)。
豬骨蛋白經過0、1、2、3、4、5 h的水解所得到的水解度經過計算分別為0%、5.6%、7.8%、11.1%、14.3%、17.2%。
1.3.4 不同水解度PBPH乳化性質的測定
1.3.4.1 EAI及ESI的測定
參照Pearce等[11]的方法并稍做修改,取8 mL 1 mg/mL PBPH溶液加入2 mL一級大豆色拉油于直徑2.5 cm的離心管中,內切式勻漿機17 500 r/min勻漿2 min,勻漿后立即從離心管底部0.5 cm處取樣0.5 μL,用0.1% SDS溶液稀釋100 倍,振蕩混勻后以SDS溶液作為空白,讀取樣品在500 nm波長處的吸光度記作A0,樣品放置10 min后再次在相同位置取勻漿液50 μL,重復上述步驟記錄A10。樣品的EAI和ESI分別通過下列公式進行計算:
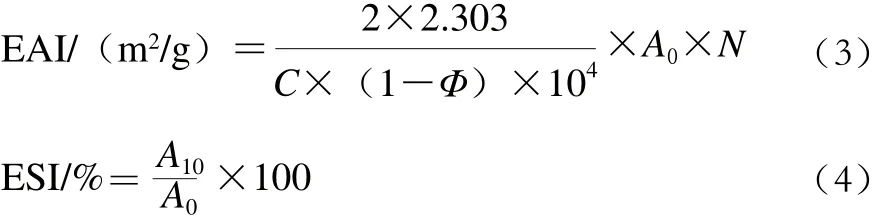
式中:C為樣品質量濃度/(g/L);Φ為油相比例;A0為樣品初始吸光度;N為稀釋倍數;A10為樣品放置10 min后的吸光度。
1.3.4.2 表面疏水性的測定
參照Xu Xingfeng等[9]的方法,使用1-苯胺基-8-萘磺酸鹽(1-anilino-8-naphthalenesulfonate,ANS)作為疏水熒光探針。樣品溶液用10 mmol/L磷酸鹽緩沖液(pH 7.0)稀釋至質量濃度范圍為0.01~0.1 mg/mL。將20 μL 8 mmol/L的ANS溶液加入到2 mL的樣品溶液中,并在室溫及避光條件下反應20 min。利用熒光光譜儀測量不同濃度樣品的熒光強度,激發波長與發射波長分別為390 nm與470 nm。在通過線性回歸分析計算不同濃度對應不同熒光強度的初始斜率。
1.3.4.3 Zeta電位和粒徑的測量
參照Yin Baoru等[12]的方法并稍作修改,取均質后的乳狀液50 μL,利用0.1 mol/L、pH 6.5的磷酸鹽緩沖溶液將其混勻稀釋100 倍,在注入到彎曲毛細管中,在常溫下使用Malvern激光粒度儀測定出含有不同水解度PBPH乳狀液的Zeta電位與粒徑。
1.3.4.4 光學顯微鏡觀察
使用光學顯微鏡對不同水解度的PBPH制備的乳狀液進行微觀結構觀察,取1.3.4.1節中均質后的乳狀液7 μL于載玻片上,然后蓋上蓋玻片后,在XPS-8C型光學顯微鏡下,在SP 40/100的物鏡下,觀察樣品,進行顯微照片的拍攝。
1.3.5 蛋白質相對分子質量分布的測定
采用Sionkowska等[13]的方法并作適當修改,將凍干所得的不同水解度的樣品分散于含0.3 mol/L NaCl的50 mmol/L磷酸鈉緩沖液(pH 7.0)中,配制成最終質量濃度為1 mg/mL的蛋白溶液。10 000×g離心10 min,取上清液過濾膜,孔徑為0.45 μm,利用Water 2690型液相色譜系統進行相對分子質量分布的測定,流動相為磷酸鈉緩沖液。色譜柱為Shodex protein KW-804型(300 mm×8 mm,7 μm),檢測器為Waters 996光電二極管陣列檢測器,紫外檢測波長280 nm,流速1 mL/min,柱溫25 ℃。標準蛋白用Marker(分子質量為6.5~200 kDa)進行校正,并繪制標準曲線。
1.4 統計分析
每個實驗重復3 次,結果表示為 ±s。數據統計分析采用Statistix 8.1(分析軟件,St Paul,MN)軟件包中Linear Models程序進行,差異顯著性(P<0.05)或差異極顯著性(P<0.01)分析使用Tukey HSD程序,采用Sigmaplot 12.5軟件作圖。
2 結果與分析
2.1 不同水解度PBPH的乳化性質
2.1.1 EAI及ESI
從表1可知,豬骨蛋白經過水解處理后EAI與ESI顯著提高,并且隨著水解度的增高呈現先升高后降低的趨勢(P<0.05),在水解度為11.1%時表現出較好的EAI和最高的ESI。乳狀液體系是一種多相體系,并且液滴有自發結合以降低體系總界面自由能的傾向,Hou Zhanqun等[14]研究表明界面張力越低,乳狀液越穩定。因此,為了減少這種不穩定程度,就需要降低油水界面的張力,使乳化劑快速吸附到油水界面上,增加乳狀液的穩定性。由于經過水解后多肽鏈數量增加,PBPH分子柔性增加并且構象迅速發生變化,使得親水基延伸至水相,疏水基延伸至油相從而快速的吸附到油-水界面上以此來降低界面張力,因此經過水解處理會提高PBPH的EAI和ESI[15]。但是水解度7.8%的樣品EAI高于11.1%的樣品,其ESI卻低于11.1%的樣品,可能是由于11.1%的PBPH的表面疏水性較大,所以在乳狀液均質過程中的高速旋轉可能會導致由疏水相互作用所引起的部分蛋白質絮凝,使得粒徑稍大于7.8%的樣品,從而影響到EAI的測定結果,但經過放置后,11.1%的樣品較之其他水解度的樣品是趨于穩定的,而水解度為7.8%的樣品會由于靜電排斥力(表面電荷),空間位阻效應(界面膜厚度、表面疏水性、吸附能力)等機制的影響而發生部分液滴的聚集,使得ESI低于水解度為11.1%的PBPH。而對于水解度為14.3%和17.2%樣品而言,隨著水解時間延長,水解度增大,維持蛋白質的內部結構力(氫鍵、范德華力、離子鍵等)遭到破壞,使得液滴表面的界面膜變薄,增大了其界面張力,進而導致PBPH的EAI與ESI的降低[16]。Xu Xingfeng等[9]的研究表明,水解時間較短的蛋白質水解物在均質期間可以快速吸附到油滴表面上并能有效防止液滴間的聚集,表現出很高的乳化能力,這與本實驗水解時間3 h,相應水解度為11.1%的PBPH樣品的ESI最好的研究結果一致。Cheng Yu等[17]對馬鈴薯蛋白水解物的乳化性進行研究,結果表明,過度水解所得到的小肽或者肽段可能不是兩性分子,不能很好地吸附于油水界面,因此乳化性較差,這進一步證明了水解度為17.4%的樣品乳化性降低的原因。
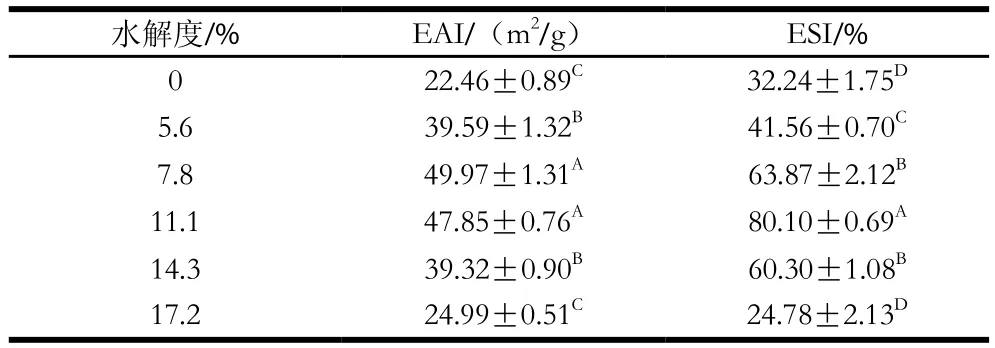
表1 水解度對PBPH的EAI和ESI的影響Table 1 Effects of different degrees of hydrolysis on EAI and ESI of porcine bone protein hydrolysates
2.1.2 表面疏水性分析
蛋白質的表面疏水性對蛋白質的構象及其功能性質有著非常重要的作用,對于高分子化合物為乳化劑的乳狀液體系來說通過空間穩定作用液滴表面的高分子吸附層可以阻止液滴間的相互碰撞和聚合,增加乳狀液的穩定性[18]。在乳化體系中,空間穩定作用的強度通常隨著界面層的厚度以及疏水性的增加而增加[5],這也就意味著表面疏水性越高,其空間穩定作用力越強。因此為觀察不同水解度的PBPH在油滴上的吸附效果,本實驗測定表面疏水性的變化趨勢,結果見圖1。
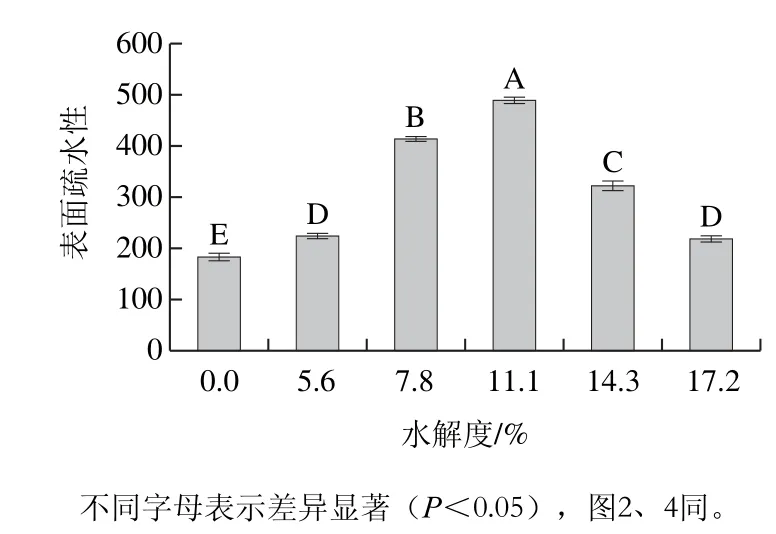
圖1 不同水解度對PBPH表面疏水性的影響Fig. 1 Effects of different degrees of hydrolysis on surface hydrophobicity of porcine bone protein hydrolysates
由圖1可以觀察到,不同水解度的PBPH的表面疏水性隨著水解度的增加呈現先增加后降低的變化趨勢(P<0.05),未經水解的豬骨蛋白的表面疏水性僅為182.25,而經過水解后,水解度為5.6%、7.8%、11.1%、14.3%、17.2%的PBPH的表面疏水性分別增加至223.18、413.39、488.15、321.49、218.28。其中水解度為11.1%的樣品顯示出最高的表面疏水性,與未經水解的豬骨蛋白相比其表面疏水性增長到近3 倍。在適度水解條件下,PBPH的表面疏水性與未水解的樣品相比顯著增加,這可能是由于適度水解后,蛋白質內部結構發生分解,β-折疊結構展開,使包埋在蛋白質內部的疏水性位點暴露出來,因此增加了蛋白水解物的表面疏水性[19]。但當水解達到一定程度時表面疏水性會降低,導致這一現象的原因可能有兩點:一是由于水解時間過長,蛋白質的疏水區域被破壞導致表面疏水性的降低;二是由于水解度的增加提高了PBPH的表面疏水性,表面疏水性的增加會使PBPH間的疏水相互作用增強,當疏水相互作用達到一定程度時,蛋白質之間會發生聚集形成蛋白質-蛋白質復合物,復合物的形成會掩蓋之前暴露出來的疏水性位點,從而降低了PBPH的表面疏水性[19]。可以發現不同水解度的表面疏水性的變化趨勢與ESI的測定結果基本一致,因此可以認為PBPH的表面疏水性的大小與ESI之間存在正相關的關系,這是由于蛋白質表面疏水性的增加,增大了其在油滴上的吸附能力,使疏水基團快速延伸至油相,蛋白質更加快速、致密地吸附到油滴上從而形成帶電界面層,提高了界面處的蛋白質濃度,從而達到了降低表面張力、穩定乳狀液的目的[1]。但由于11.1%的PBPH具有相對較高的表面疏水性,因此在乳狀液均質期間可能會發生由疏水相互作用所導致的部分蛋白質的聚集,進而造成EAI的降低。
2.1.3 Zeta電位分析
在乳狀液體系中,相對于空間穩定作用,靜電相互作用也同樣是一種維持乳狀液穩定的一種重要的作用力[20],靜電相互作用的存在可以有效防止由范德華力及疏水相互作用所導致的液滴間的聚集,以此來穩定乳狀液。Zeta電位絕對值的大小是衡量靜電相互作用程度的重要指標,因此Zeta電位與乳狀液的物理穩定性具有正相關性,可以作為評定乳狀液物理穩定性的一個重要指標。Zeta電位的測定結果如圖2所示,無論是未水解的豬骨蛋白還是經過水解的豬骨蛋白,所制備的乳狀液都顯示為高度負電,這是由于此時pH值處于中性,H+濃度較高,羧基(—COOH)和氨基(—NH3+)沒有發生質子化,導致負電荷的產生[21]。隨著水解時間的延長,水解度增大,Zeta電位的絕對值呈現先增高后降低的趨勢(P<0.05),水解度為11.1%的樣品組顯示帶有最高的凈負電荷。這就進一步解釋了在此水解度條件下具有較高ESI的原因。水解后的PBPH樣品顯示出相對較高的靜電荷是由于豬骨蛋白經過水解后,蛋白結構發生改變,使得更多的極性基團暴露出來,增加了其表面電位[22]。隨著水解度的增加,Zeta電位的降低可能與表面疏水性過高所引起的蛋白質間的聚集有關,隨著水解的進行,PBPH相互聚集形成復合物,復合物吸附在界面處,包埋了界面蛋白所暴露出的極性基團從而導致表面電位的降低。
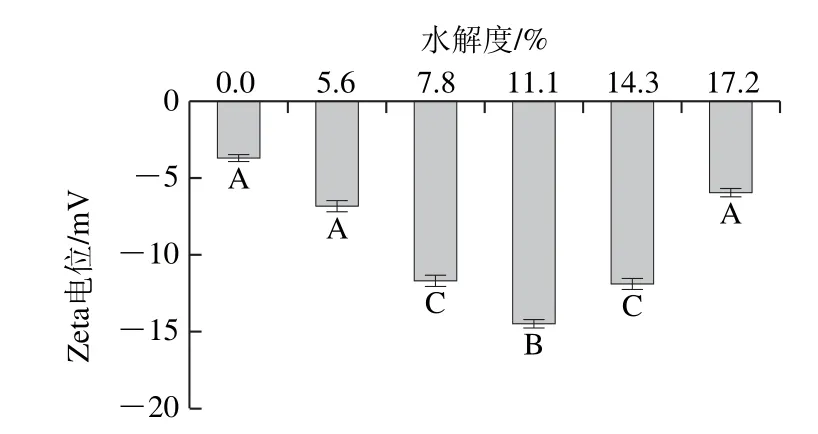
圖2 不同水解度對PBPH乳狀液Zeta電位的影響Fig. 2 Effects of different degrees of hydrolysis on zeta potential of porcine bone protein hydrolysates in emulsion
2.1.4 粒徑與乳狀液光學顯微鏡結果
為進一步分析不同水解度PBPH的乳化能力,測定不同水解度PBPH制備的乳狀液的光學顯微結果見圖3,比表面積平均粒徑見圖4。隨著水解度的增加,粒徑的變化呈現先降低后增加的趨勢(P<0.05),水解度為11.1%的PBPH顯示出最小的平均粒徑,這表明在適度水解條件下PBPH能夠在乳化過程中更快速地吸附到液滴表面形成帶電界面層,降低界面張力從而有效防止液滴的聚集,所形成的乳狀液穩定性較好。Li Yuanyuan等[23]對利用玉米蛋白水解物所制備的乳狀液進行了激光共聚焦的觀察,發現蛋白質可以吸附到油水界面上并在油滴周圍形成一層帶電蛋白質薄膜,從而增加界面膜的厚度。此外,Wooster等[24]研究表明在乳清蛋白質作為乳化劑的水包油乳狀液中,蛋白質形成較厚的界面膜的同時可以和碳水化合物通過空間位阻效應有效降低乳狀液的絮凝和聚集。多肽所形成的界面膜是不需要通過非共價相互作用的聚集體[25]。He Dong等[26]研究表明靜電相互作用是這一過程中的重要作用力,強烈的靜電相互作用力與疏水鍵以及氫鍵一起作用會促使多肽鏈聚集在乳狀液液滴表面最終形成界面膜,而本實驗結果表明未經過水解的豬骨蛋白的表面疏水性和表面電位較低,所以其吸附到液滴表面的能力較差,所形成的乳化液滴界面膜薄而不均,EAI與ESI較差。而經過適當水解的豬骨蛋白吸附性較好,形成的界面膜致密而均勻,可以很好地防止液滴間的聚集及降低界面張力,所制備的乳狀液的平均粒徑較小,因此EAI與ESI較高[1]。這也進一步說明了表面電位、表面疏水性與平均粒徑之間的相互關系。而隨著水解度的提高,平均粒徑變大原因同樣與蛋白質-蛋白質復合物的形成及油滴間的聚集有關,這與之前表面疏水性的研究結果形成了對應。
為更直觀地觀察用不同水解度的PBPH所制備乳狀液的乳化效果,采用光學顯微鏡對放置10 min后的不同水解度PBPH所制備的乳狀液進行液滴大小及分布情況的微觀觀察(圖3)。未經過水解的豬骨蛋白所制備的乳狀液的液滴粒徑較大,且分散不均勻,部分還具有聚集的趨勢,而由于水解后提高了豬骨蛋白的乳化能力,因此所形成的乳狀液的液滴粒徑明顯變小,具體的液滴大小及分散情況與水解度有關,總體趨勢與粒徑的測定結果相符。利用PBPH制備的乳狀液其液滴大小隨著水解度增加呈現先減小后增大的趨勢(P<0.05),在適度水解條件(11.1%)下液滴粒徑相對較小且分散均勻,而水解度過高時(14.3%和17.2%)液滴分散不均勻,粒徑變大并有聚集的趨勢,此時乳液的穩定性較差。這與之前平均粒徑以及ESI的測量結果相吻合。

圖3 不同水解度PBPH制備的乳狀液的光學顯微照片Fig. 3 Optical photomicrographs of emulsions prepared with porcine bone protein hydrolysates with different DHs
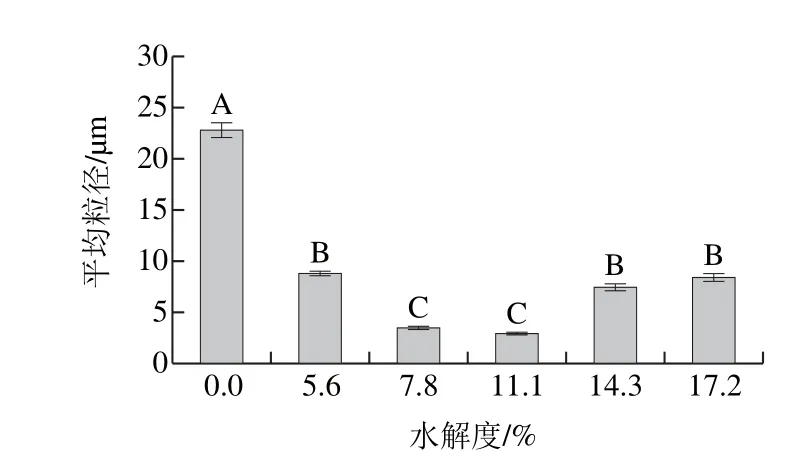
圖4 不同水解度PBPH制備的乳狀液比表面積平均粒徑Fig. 4 Specific surface area average particle size of emulsions prepared with porcine bone protein hydrolysates with different DHs
2.2 PBPH的相對分子質量分布
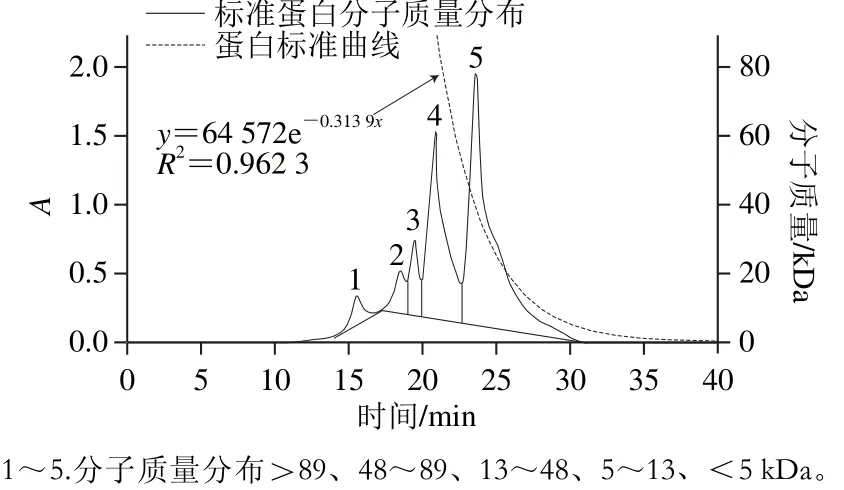
圖5 蛋白標準曲線與標準蛋白分子質量分布圖Fig. 5 Standard curve of molecular mass and molecular mass distribution of protein marker
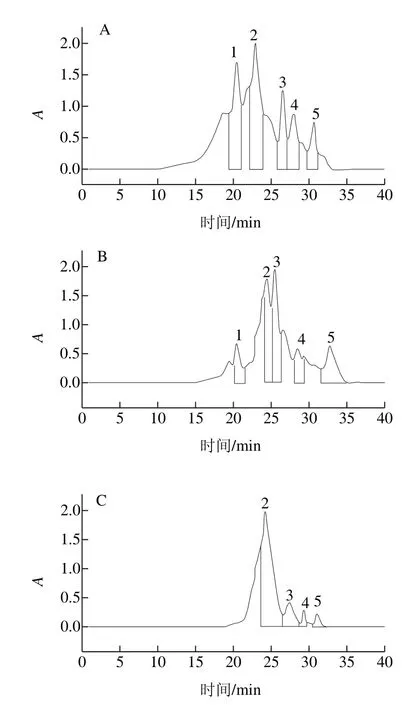
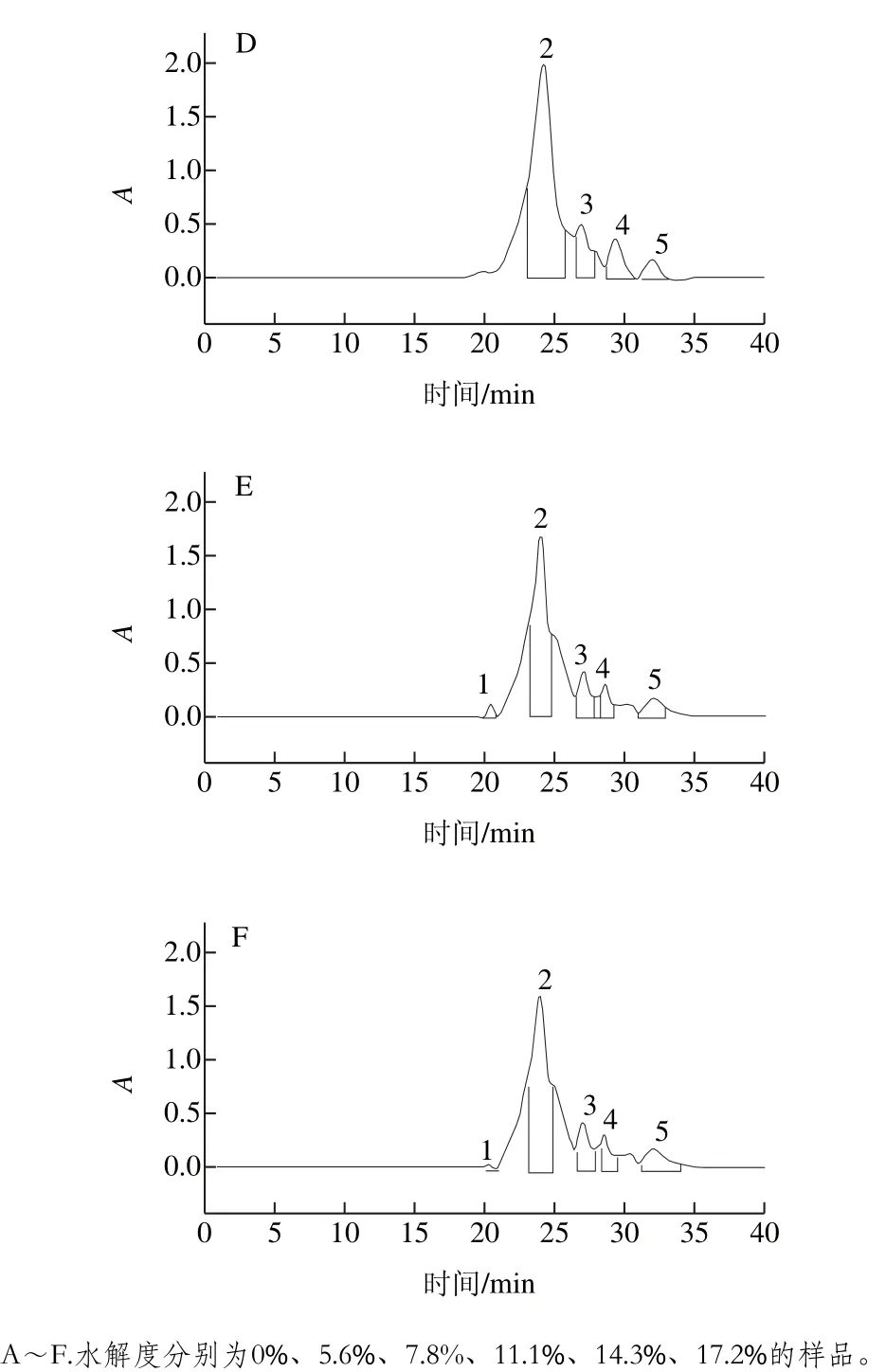
圖6 不同水解度對PBPH分子質量分布的影響Fig. 6 Effect of different degrees of hydrolysis on molecular mass distribution of porcine bone protein hydrolysates
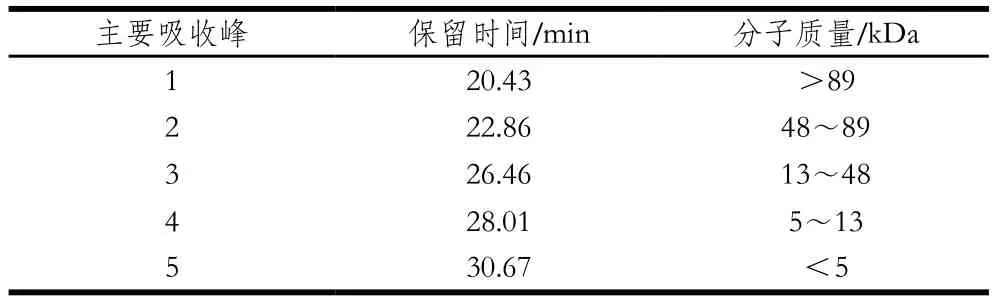
表2 不同吸收峰的保留時間與分子質量分布Table 2 Retention times and molecular mass distribution of different absorption peaks
為觀察不同水解度的PBPH分子質量分布情況的變化,采用分子排阻色譜對其分子質量分布進行測定。蛋白標準曲線與標準蛋白分子質量分布圖見圖5,不同水解度的PBPH的凝膠色譜圖見圖6。未經水解的豬骨蛋白的分子排布圖顯示出了5 個主要吸收峰,具體見表2。通過圖6可以觀察到,與未水解的豬骨蛋白圖譜相比,隨著水解度的增加,峰1逐漸減少直至消失,而在保留時間23~27 min之間相繼出現較強的譜峰吸收并不斷積累,說明大分子肽在反應過程中易于解聚,并且分離的單體被堿性蛋白酶專一切割成較為集中的片段組成(23~27 min),并不斷有小分子肽段(>31 min)生成[27]。
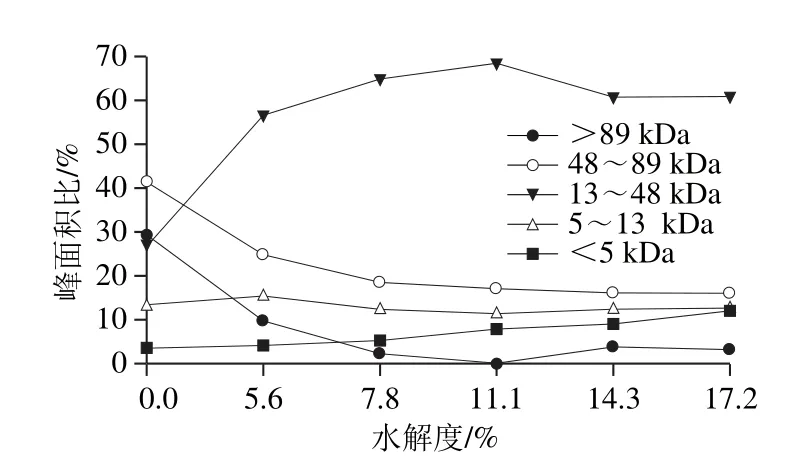
圖7 不同水解度對水解豬骨蛋白分子質量分布的影響Fig. 7 Percentage peak areas obtained with high-performance size exclusion chromatograph for porcine bone protein hydrolysates with different DHs
由圖7可見,從反應進程看,隨著水解度的增加,大分子肽(>89、48~89 kDa)的所占比例迅速減少,小分子比例不斷增加,當水解度達到11.1%時,分子質量高于89 kDa的肽段消失,而水解度進一步增加時又有小部分大分子肽生成,說明此時發生了蛋白質的聚集。而13~48 kDa的肽段起初隨著水解度的增加而增加,當達到一定程度時會降低,說明水解過程中既有多肽鏈的斷裂,同時也伴有蛋白質的聚集,二者是交互進行的[28]。結合前面的實驗結果,即水解度為7.8%與11.1%時的乳化性較好,此時13~48 kDa肽段所占比例較高,水解度為11.1%時乳化性達到了最大(68.47%),說明此范圍的肽段對乳化性的提高有著重要的作用[29]。分子質量在5~13 kDa范圍的肽段總體呈現上下浮動的變化且漲落較小,也就是說其降解速率接近生成速率,說明這段范圍內的分子間存在高度偶聯且相互制約的關系[30]。分子質量低于5 kDa的小肽含量隨著水解度的增大而顯著增加,這是由于豬骨蛋白的空間結構較為松散,易于降解以及堿性蛋白酶的高度專一性的切割特點所致。
3 結 論
本實驗以不用水解時間為出發點,對不同水解度PBPH在乳化體系中的作用機制進行探討,結果表明PBPH的乳化特性受水解度的影響,對比未經水解的豬骨蛋白,PBPH的EAI、ESI、表面疏水性、Zeta電位,均得到顯著提高,并隨著水解時間和水解度的增大,呈先增加后降低的趨勢,水解度為11.1%的PBPH表現出最好的乳化能力,并具有最小粒徑及最均勻的液滴分布。總之,水解處理可以顯著提高豬骨蛋白在乳化體系中的乳化能力,并且水解時間為3 h,水解度11.1%的PBPH作為天然乳化劑可以有效提高食品乳狀液體系的物理穩定性。

