中藥標準品對人肺癌耐藥細胞A549/DDP的逆轉效果研究*
楊新階,王婧筱,王 琳,遲笑怡,遲佳琦,周 天,劉銅華,胡凱文**
(1.北京中醫藥大學 北京 100029;2.北京中醫藥大學腫瘤研究所 北京 100029;3.北京中醫藥大學東方醫院 北京 100078;4.北京中醫藥大學中醫養生學教育部重點實驗室 北京 100029)
肺癌是全世界發病率最高的惡性腫瘤,其發病率和死亡率目前仍居高不下[1,2]。盡管以EGFR-TKIs為代表的靶向藥物極大地改善了肺癌的治療和預后,但化療在臨床治療中仍然占據十分重要的地位,而化療耐藥的發生是導致臨床治療失敗、疾病進展和預后不良的主要原因[3,4]。
腫瘤耐藥發生的機制復雜,包括ATP結合盒轉運體(ATP-Binding Cassette Transporters,ABCs)高表達、肺耐藥相關蛋白(Lung resistance-related protein,LRP)表達上調、谷胱甘肽S轉移酶(Glutathione-S-transferases,GSTs)作用增強以及DNA拓撲異構酶II(DNA topoisomerase II,Topo II)低表達等[5]。
在上述機制中,ABC的藥物泵出作用最為重要,其逆轉劑研究最為深入[6,7]。目前,第三代逆轉劑Tariquidar專門針對ABC蛋白跨膜片段的半胱氨酸交聯區并發揮作用[8]。據報道,A549/DDP耐藥的發生可能與ABC家族中ABCB1和MDR1基因的高甲基化有關[9]。其產物為耐藥相關的ABC蛋白,均為Tariquidar作用靶點。
Tariquidar開發伊始,因其在體內外試驗的中良好耐受性和療效而被寄予厚望[10]。但其臨床試驗均以失敗告終[11]。腫瘤耐藥的逆轉藥物開發進入了平臺期。有數據顯示,1999年至2008年的18年間,美國FDA批準上市進入臨床的小分子化合物類藥物中,36%為天然存在的化合物及其衍生物[12]。中藥體系龐大,涵蓋物質廣泛,逆轉腫瘤耐藥的有效成也存在于中藥之中[13]。
我們挑選既往報道具有逆轉腫瘤耐藥作用的5種中藥標準品:川芎嗪、苦參堿、鹽酸小檗堿、北豆根堿(蝙蝠葛堿)和冬凌草甲素等(表1)。這些標準品對白血病耐藥細胞、胃癌耐藥細胞、乳腺癌耐藥細胞等均具有一定的逆轉效果,但對于肺癌耐藥細胞株的逆轉作用尚不明確。本研究以人類肺腺癌耐順鉑細胞株A549/DDP為模型,研究其對肺癌耐藥的逆轉效果,為解決臨床肺癌耐藥問題、開發新型耐藥逆轉劑提供初步依據。
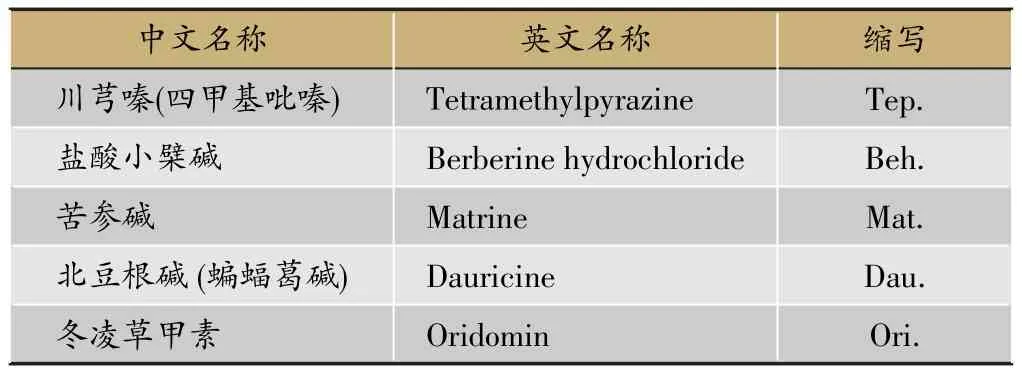
表1 實驗選擇的中藥標準品
1 實驗儀器和材料
1.1 實驗儀器
HERACell 150i恒溫培養箱(Thermo scientific,USA),HDLDL-CJ-2ND I型潔凈工作臺(北京東聯哈爾儀器制造有限公司),Olympus IX7型倒置顯微鏡(Olympus,Japan),Sigma 3K15型低溫高速離心機(Sigma,USA),Promega E9032型酶標儀(Promega,USA),Sartorius R200D 型 分 析 天 平(Sartorius,Germany),DZKW-4型電子恒溫水浴鍋(北京中興偉業儀器有限公司)。
1.2 實驗材料
RPMI Medium 1640培養基(Invitrogen,USA),胎牛血清(Gibco,USA),TRYPSIN-EDTA 胰酶消化液(Invitrogen),青霉素-鏈霉素混合液(Invitrogen,USA),磷酸鹽緩沖液(PBS,Invitrogen,USA),25cm2細胞培養瓶(Corning,USA),15mL離心管(Corning,USA),Cell Counting Kit 8(CCK-8,Dojindo,Japan,批號:CK04-500)等。
1.3 藥物與細胞
順鉑(DDP,Bioruler,USA,批號:RH66694-100 mg),Tariquidar(Selleck,USA,批 號 :S8082),川 芎 嗪(Bioruler,USA,批號:RB14186-20 mg),鹽酸小檗堿(Bioruler,USA,批 號 :RB11146-20 mg),苦 參 堿(Bioruler,USA,批號:RB10662-20 mg),蝙蝠葛堿(Bioruler,USA,批號:RB15517-20 mg),冬凌草甲素(Bioruler,USA,批號:RB13949-20 mg)
人肺腺癌細胞株A549,購自ATCC上海細胞庫,A549耐順鉑細胞藥株(A549/DDP)購自北納聯創生物技術研究院(BeNa Culture Collection,北京),該細胞株為A549細胞通過階梯誘導法獲得,歷時12個月。以上細胞均儲存于液氮存儲系統之中。
2 實驗方法
2.1 細胞培養
將儲存于液氮中的A549和A549/DDP細胞迅速置于37℃水浴鍋中5 min內復蘇。立即移入含有10%胎牛血清、1%青霉素-鏈霉素的1 640完全培養基中,反復吹打混勻,4℃,1 000rpm離心5 min后棄上清,加入5 mL 1 640完全培養基后混勻,移入25 cm2培養瓶,置于37℃,5%CO2恒溫培養箱中培養。觀察細胞生長情況,待A549細胞融合度達到80%以上時,用PBS清洗2次,加入1 mL胰蛋白酶消化,鏡下觀察細胞變圓時加入2 mL 1 640完全培養基停止消化,收集細胞置于15 mL離心管中,4℃,1 000 rpm離心5 min后棄上清,培養瓶傳代培養。A549/DDP細胞融合度達到80%時,更換含5.67 μM(μ2 g/ml)DDP的完全培養液,部分細胞死亡漂浮,更換培養基繼續培養,以維持A549/DDP對順鉑的耐藥性。根據細胞生長情況進行傳代,取對數期細胞進行實驗,A549/DDP細胞實驗前用不含DDP的培養基培養3天。
2.2 細胞標準曲線
為確定96孔板每孔細胞接種數量、貼壁孵育時間、加入CCK-8后的O.D.值讀數時間等,需制作A549、A549/DDP細胞的增值標準曲線。將2株細胞分別梯度濃度接種于96孔板中(周圍一圈孔加入PBS),設計梯度為:10 000、5 000、2 500、1 250、625/孔,貼壁生長24 h后加入CCK-8,間隔讀取450 nm處的吸光值,間隔時間設計為15 min。分別以時間(min)為橫軸、O.D.(450 nm)為縱軸制作曲線,以細胞濃度為橫軸、O.D.(450 nm)為縱軸制作標準曲線,以此確定適宜的細胞接種數量和O.D.值讀數時間。
2.3 A549/DDP耐藥指數測定
取對數生長期的A549、A549/DDP細胞,按照每孔5 000個接種于96孔板中,培養箱貼壁生長24 h,加入梯度濃度含順鉑的1 640培養基。順鉑設計5個梯度濃度(每個濃度5個復孔):A549細胞100 μM、50 μM、25 μM、12.5 μM、6.25 μM;A549/DDP 細胞 2 560 μM、1 280 μM、640 μM、320 μM、160 μM。培養24 h后,每孔加入10 μL CCK-8,恒溫箱孵育60 min,讀取450 nm處O.D.值。根據CCK-8試劑盒說明計算細胞的活性及半數抑制濃度(Half inhibitory concentration,IC50)IC50。
耐藥指數=IC50(A549/DDP)/IC50(A549)。
2.4 A549/DDP對中藥標準品耐受實驗
既往研究報道[14],有機溶劑DMSO體積濃度<0.1%或AEA體積濃度<1%時,A549細胞增殖未見明顯受益。但A549/DDP細胞對其耐受性并不明朗,本研究取0.001%、0.01%、0.1%、1%、10%五個體積濃度梯度的二甲基亞砜(DMSO)和無水乙醇(AEA),用CCK8法確定A549/DDP對其耐受情況。
將選定的中藥標準品溶解于不含血清的1 640培養基中,不溶于水的標準品加入DMSO或AEA助溶。等比梯度濃度配制工作液。取對數期A549/DDP細胞,5 000/孔接種于96孔板中,貼壁生長24 h后給予梯度濃度中藥標準品溶液,恒溫培養箱孵育24h,加入CCK8溶液,37℃孵育60 min后讀取450 nm處吸光值。回歸分析計算中藥標準品對A549/DDP細胞的5%抑制濃度(5%inhibitory concentration,IC5)、10%抑制濃度(10%inhibitory concentration,IC10)以及 IC50。選取IC5作為逆轉A549/DDP細胞耐藥的工作濃度。
2.4 中藥標準品逆轉耐藥實驗
選取對數期A549/DDP細胞接種于96孔板中,貼壁后加入含有工作濃度中藥標準品的1 640完全培養基,37℃恒溫孵育24 h,棄去含藥培養基,加入含梯度濃度順鉑的1 640培養基,孵育24 h后進行CCK8實驗,計算IC50,對比逆轉實驗前后IC50值,計算逆轉指數(Reversal Index)。除中藥標準品之外,本研究以Tariquidar為陽性對照藥,其工作濃度為1 μM,干預方法及CCK8實驗同上。
2.5 數據分析方法
數據處理采用GraphPad Prism 7.0分析并作圖,實驗數據以平均數加減方差(±s)表示。多組比較采用單因素方差分析,兩組間比較采用LSD檢驗;P<0.05有統計學差異,P<0.01有顯著差異。
3 結果
3.1 標準曲線
A549/DDP是在A549細胞系基礎上通過階梯誘導傳代獲得的細胞株,經過長時間培養,有老化趨向,其代謝較A549細胞略緩慢(圖1a)。根據標準曲線及吸光值,確定后續實驗中96孔板接種細胞數目為5 000/孔,CCK8實驗讀數時間為60 min(圖1b,c)。

圖1 細胞增殖標準曲線
3.2 耐藥指數
DDP對A549細胞的IC50為32.71±2.8 μM,DDP對A549/DDP 細胞的 IC50為 1040±30.1 μM,耐藥指數(resistance index,RI)為31.79(圖2)。
3.3 A549/DDP對中藥標準品耐受
實驗結果顯示,有機溶劑助溶,DMSO的體積百分比<0.1%或者AEA的體積百分比<1%時,A549/DDP細胞增殖未見明顯受抑(圖3a)。故中藥標準品溶液配制時,應將有機助溶劑的體積百分比控制在此范圍之類,以免影響實驗結果。
研究發現,A549/DDP細胞對川芎嗪(Tep.)和苦參堿(Mat.)耐受良好,高濃度下(500 μM)仍未見明顯生長受抑,均選取100 μM作為工作濃度,其余中藥標準品對A549/DDP細胞增殖的抑制效果(圖3b)及確定的工作濃度見下表2。
3.4 逆轉A549/DDP順鉑耐藥
工作濃度中藥標準品各組IC50與A549/DDP組比較具有顯著性差異,說明其對A549/DDP細胞的耐藥性具有不同程度的逆轉作用。陽性對照藥物Tariquidar(Tari.)的逆轉效果與既往文獻報道相近。(表3、圖4)
圖2 細胞對DDP的耐受情況
圖3 A549/DDP對DMSO、AEA的耐受(a),鹽酸小檗堿、北豆根堿(蝙蝠葛堿)和冬凌草甲素對A549/DDP細胞增的抑制作用(b)
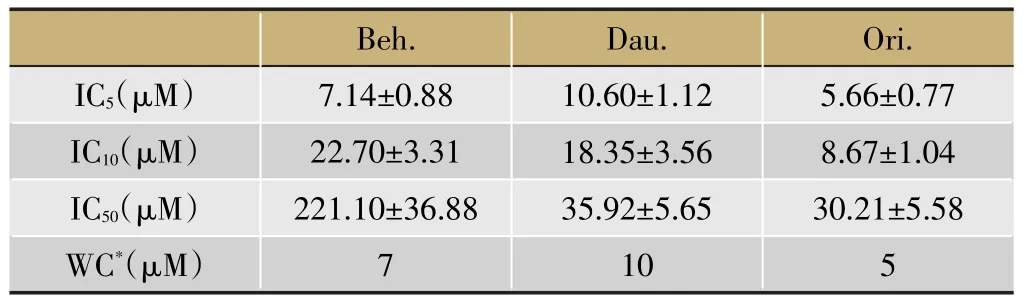
表2 A549/DDP對中藥標準品的耐受情況
4 討論
腫瘤耐藥的發生是多因素、多機制共同作用的結果[6]。主要包括:增強細胞膜上ATP依賴的泵蛋白(ABC蛋白)的表達,將細胞內的藥物泵出;改變腫瘤細胞的藥物吸收特性,減少抗腫瘤藥物吸收;增加抗腫瘤藥物的代謝速度;改變抗腫瘤藥物的靶點;通過改變細胞周期檢測點和影響凋亡通路阻礙細胞的死亡。Tariquidar能特異性地拮抗ABC轉運通道,并在轉錄后水平下調耐藥相關ABC的表達[15]。盡管如此,臨床上腫瘤化療耐藥的現狀仍舊未能得到絲毫的緩解。本實驗中,Tariquidar對A549/DDP具有逆轉效果(圖4),提示其耐藥機制可能與ABC高表達相關。而Tariquidar逆轉以后的A549/DDP細胞仍具有一定的順鉑耐受性,說明其耐藥性的發生可能是多因素作用的結果。

圖4 中藥標準品及陽性逆轉劑對A549/DDP耐藥逆轉效果對比。
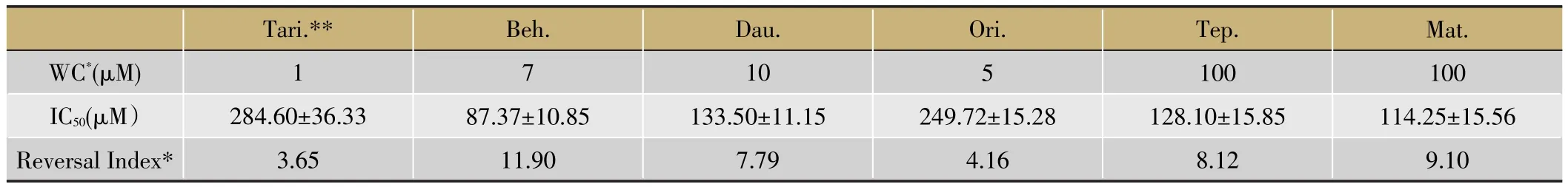
表3 中藥標準品及陽性對照藥物對A549/DDP耐藥性的逆轉效果
中藥及復方被報道具有逆轉腫瘤耐藥活性由來已久[13,16]。川芎嗪能逆轉血液腫瘤細胞K562和肝癌細胞HepG2對阿霉素的耐藥性,其作用機制與川芎嗪下調ABCB1的表達有關[17,18];苦參堿通過抑制P-gp蛋白表達、降低P-gp ATP酶活性來增加阿霉素在細胞內的蓄積,逆轉膀胱癌細胞BIU-87和乳腺癌細胞MCF-7對阿霉素的耐受[19,20];鹽酸小檗堿不僅能通過下調P-gp的表達逆轉血液腫瘤細胞K562的耐藥性,而且還能通過下調Pho P和Pho R基因的表達逆轉結核桿菌的細菌耐藥性[21,22];北豆根堿能通過抑制自噬溶酶體的降解增強Hela細胞對喜樹堿的敏感性[23];冬凌草甲素通過下調MDR1基因及P-gp的表達逆轉胃癌細胞SGC7901、乳腺癌細胞MCF-7和血液腫瘤細胞K562的耐藥性[24-25]。但是,這些藥物對肺癌耐藥的逆轉作用及機制尚不明確。
本實驗中所用細胞模型A549/DDP是在A549細胞系基礎上,用DDP濃度遞增法經過長時間誘導所獲得。相比較于親代細胞,A549/DDP在代謝和增殖速度上呈現出明顯的老化趨勢(圖1)。經過長期的順鉑刺激,A549/DDP的耐藥性也明顯強于A549細胞系(P>0.01)(圖2)。本實驗所選中藥標準品中,川芎嗪和苦參堿的細胞毒性較弱,其余三種標準品均表現出劑量依賴的細胞毒性。中藥標準品作用于A549/DDP的結果顯示,所遴選的5種中藥標準品均能有效逆轉A549/DDP細胞的耐藥性(與A549/DDP模型比較,P>0.01)。為今后解決臨床肺癌耐藥、為開發出新的耐藥逆轉劑提供線索。efflux pump inhibitor.Expert Rev Anticancer Ther,2007.7(4):p.447-59.

