頭頂一顆珠水煎液對阿爾茨海默病模型大鼠認知功能障礙的保護作用
謝文執,羅洪斌,2,3,4,謝楓楓,楊晨宇
(湖北民族學院1. 醫學院生物化學與分子生物學教研室、2. 科技學院醫學系生物化學與分子生物學教研室、3. 生物資源保護與利用湖北省重點實驗室、4. 神經精神共患病研究所,湖北 恩施 445000)
阿爾茨海默病(Alzheimer’s disease,AD)是與年齡高度相關的神經退行性疾病,可導致腦萎縮、神經元與突觸的丟失和大腦皮層神經遞質的減少,最終導致老年人認知功能障礙和生活行為的困難。其主要病理改變為腦海馬神經元周圍的老年斑(amyloid-β protein,SP)、神經元內神經纖維纏結(neurofibrillary tangles,NFTs)、長期炎癥反應和神經元凋亡等[1]。主要發病機制包括淀粉樣蛋白級聯反應、Tau蛋白過度磷酸化、遺傳因素、神經遞質釋放異常、細胞凋亡等學說。NFTs是AD的特征性病理特征,主要由過度磷酸化的Tau蛋白構成,在AD患者大腦皮層和海馬中NFTs的數量多少及其分布與癡呆嚴重程度呈正相關[1-2]。而Tau蛋白是一種微管相關蛋白,主要分布于中樞神經元軸突中,與微管的穩定、物質的運輸以及神經信息的傳遞密切相關[2]。
蛋白磷酸酶2A (protein phosphatase 2A,PP2A)是一種絲氨酸/蘇氨酸蛋白磷酸酶,廣泛參與細胞信號傳導、物質代謝、細胞增殖分化、細胞凋亡等反應。研究發現[2],PP2A其催化亞基PP2Ac能明顯降低Tau蛋白的過度磷酸化,而AD患者腦內PP2Ac表達量及活性卻較低。岡田酸 (okadaic acid,OA) 是一種海洋生物提取物,也是PP2A的特異性抑制劑,廣泛應用于AD的實驗研究[3-4]。體內和體外實驗均證明,OA能特異性抑制PP2A活性[4-5],引起Tau蛋白多個位點的過度磷酸化,最終導致認知功能障礙[5]。
頭頂一顆珠 (TrilliumTschonoskiiMaxim,TTM) 為土家族道地藥材,多在我國土家族民間使用,常用于眩暈、跌打損傷、神經衰弱的治療[6-7]。其主要成分為甾體皂苷,現代醫學研究發現該藥具有抗腫瘤、消炎鎮痛、免疫調節、改善心功能等功效[8]。有研究證明,TTM可通過增強大腦海馬和皮質超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)活性,減少丙二醛 (malonaldehyde,MDA)含量,通過抗氧化起到延緩衰老的作用[9]。TTM是否具有調節PP2A活性的作用目前尚不清楚,因此,有必要進行深入研究,并掌握其詳細作用機制,促進該藥開發利用。
1 材料與方法
1.1藥物與試劑按人(60 kg)為標準,TTM每人每千克用藥的低、中、高劑量分別為0.083、0.167、0.333 g·kg-1,成人與大鼠的折算系數為6.25,大鼠(250 g)相當于人的臨床等效低、中、高劑量分別為0.125、0.25、0.5 g·kg-1·d-1。TTM水煎液制備方法:稱量100 g TTM并切碎,煎取2次、混勻、過濾,再濃縮定量至0.4 kg·L-1備用。OA購自美國Sigma公司;BCA蛋白濃度測定試劑盒,北京康為世紀生物科技有限公司;Tau-5抗體,美國Abcam公司;M-PP2Ac、DM-PP2Ac、PS307-PP2Ac,美國Cell Signaling Technology公司;pS396、pS404抗體,美國SAB公司;β-actin抗體,美國Proteintech公司。
1.2儀器DMS-2型Morris水迷宮測試系統(中國醫學科學院藥物研究所);099C K5424組織勻漿機(美國Glas-Col公司);電泳槽、濕轉槽、PowerPacTM基礎電泳儀電源(美國伯樂公司);Odyssey雙色紅外熒光成像系統(美國LI-COR公司);VT1200S振蕩切片機(德國徠卡公司);E200三目顯微鏡(日本尼康公司)。
1.3實驗動物與分組♂SD大鼠110只,體質量(250±30)g,購自湖北省實驗動物研究中心,合格證號:42000600017418。大鼠適應性飼養2周后,隨機分為10組:DMSO 1周組、OA 1周組、TTM灌胃1周低、中、高劑量組、DMSO 2周組、OA 2周組、TTM灌胃2周低、中、高劑量組,每組10只。另選10只SD大鼠備用。
1.4造模和水迷宮訓練給藥1周組、給藥2周組分別給予TTM灌胃1周、2周;OA 1周、OA 2周組、DMSO 1周、DMSO 2周組分別用飲用水灌胃。用藥1周組在灌胃d 2同時進行水迷宮訓練(水迷宮訓練方法參照文獻[10]),在灌胃d 7行海馬注射OA,測試前24 h,OA組和治療組雙側海馬注射OA各1.5 μL(濃度均為0.392 mmol·L-1),DMSO組同樣位置各注射10% DMSO 1.5 μL。用藥2周組在灌胃d 9開始水迷宮訓練,訓練和測試方法同用藥1周組。
1.5海馬勻漿蛋白Westernblot分析實驗方法參照本課題組前期實驗[10]。一抗(p-Tau-Ser 396、p-Tau-Ser 404、Tau 5、M-PP2Ac、DM-PP2Ac、PS307-PP2Ac等);熒光二抗(IRDye 800CW 羊抗小鼠IgG、IRDye 800CW 羊抗兔IgG)。Odyssey系統掃描成像,Image J計算灰度值。
1.6腦片尼氏染色用顯微鏡挑選大小合適、無破損的海馬腦片,用PBS清洗后,置于載玻片上,滴加適量的尼氏染色液,室溫孵育20 min,脫水、透明后封片觀察。
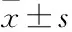
2 結果
2.1TTM對AD模型大鼠空間認知功能的影響Fig 1的水迷宮實驗結果顯示,注射OA后的大鼠逃避潛伏期明顯長于注射前,OA組大鼠逃避潛伏期明顯長于DMSO組,且游泳軌跡穿越第3象限平臺的目的性弱,總的游泳路程長,用時長,說明AD模型大鼠空間學習記憶有障礙。預先給予TTM低、中、高劑量組逃避潛伏期均明顯短于OA組,用藥2周者具有劑量依賴性,且游泳軌跡穿越第3象限平臺的目的性強,總的游泳路程短,用時少。上述結果提示,TTM低、中、高劑量均能有效改善OA大鼠空間學習記憶障礙。
2.2TTM對AD模型大鼠腦海馬PP2A活性的影響Fig 2的Western blot結果顯示,與DMSO組比較,OA組甲基化水平明顯下降,去甲基化水平明顯上升,PP2Ac Y307磷酸化水平上升,表明PP2Ac活性降低。與OA組比較,TTM中、高劑量組甲基化水平升高,去甲基化水平和PP2Ac 在Y307位點上磷酸化水平明顯降低,表明PP2Ac活性升高。結果表明,中、高劑量的TTM能提高PP2A活性,特別是高劑量組效果更為明顯,并具劑量依賴性。
2.3TTM對AD模型大鼠腦海馬Tau蛋白磷酸化的影響如Fig 3所示,OA組Tau蛋白pS396、pT404位點的磷酸化水平明顯高于DMSO組,而TTM治療1周高劑量組和治療2周中、高劑量組的Tau蛋白pS396、pT404位點的磷酸化水平低于模型組,并呈劑量依賴性,說明高劑量TTM能有效降低Tau蛋白的磷酸化水平。
2.4尼氏染色法結果如Fig 4所示,在海馬CA1和CA3區,DMSO組尼氏小體數量明顯多于OA組。TTM治療組與OA組相比,治療1周中、高劑量組CA1和CA3區尼氏小體數量多于OA組。TTM治療2周高劑量組CA1區尼氏小體數量多于OA組,而在CA3區TTM低、中、高劑量組尼氏小體數量多于OA組,且高劑量組最為明顯。提示TTM高劑量組能明顯增加AD大鼠海馬區尼氏小體的數量,修復損傷神經元。

Fig 1 1 week and 2 weeks of TTM administration prevented rats from OA-induced spatial memory retention
A: The 1 week and 2 weeks of TTM administration repaired the swimming pathway recorded 24 h after OA injection; B: The 1 week and 2 weeks of TTM administration prevented rats from OA-induced spatial memory retention dysfunction. 1:DMSO;2:OA;3:OA+TTM 0.125 g·kg-1·d-1;4:OA+TTM 0.25 g·kg-1·d-1;5:OA+TTM 0.5 g·kg-1·d-1.**P<0.01vscontrol;##P<0.01vsbefore OA injection;ΔP<0.05vsafter OA injection.

Fig 2 Effects of 1 week(A) and 2 weeks(B) of TTM administration on OA-induced inhibition of
1:DMSO;2:OA;3:OA+TTM 0.125 g·kg-1·d-1;4:OA+TTM 0.25 g·kg-1·d-1;5:OA+TTM 0.5 g·kg-1·d-1.*P<0.05,**P<0.01vscontrol;#P<0.05vsOA injection

Fig 3 Effects of 1 week(A) and 2 weeks(B) of TTM administration on OA-inducedTau hyperphosphorylation in SD rat
1:DMSO;2:OA;3:OA+TTM 0.125 g·kg-1·d-1;4:OA+TTM 0.25 g·kg-1·d-1;5:OA+TTM 0.5 g·kg-1·d-1.*P<0.05,**P<0.01vscontrol;#P<0.05vsOA injection.

Fig 4 Effects of 1 week (A) and 2 weeks (B) of TTM administration on OA-induced Nissl'sbodies' decrease in SD rat
1:DMSO;2:OA;3:OA+TTM 0.125 g·kg-1·d-1;4:OA+TTM 0.25 g·kg-1·d-1;5:OA+TTM 0.5 g·kg-1·d-1.**P<0.01 and*P<0.05vscontrol;#P<0.05vsOA injection.
3 討論
AD是與神經退行性病變相關的疾病,不僅導致認知功能下降,而且會引起心理或行為的一系列變化,導致一系列社會經濟問題[11]。文獻報道[1],AD患者腦組織中PP2A的表達和活性均明顯下降,其與毒性淀粉樣蛋白Aβ1-40,42的增多呈負相關,而AD患者腦內特征性病理改變SP的主要成分即為神經元外的Aβ1-40,42,該淀粉樣蛋白可導致神經元損傷和凋亡,最終導致腦萎縮和認知功能障礙。PP2A的表達和活性下降還可導致Tau蛋白過度磷酸化,并形成AD的另一個特征性病理改變NFTs,也可導致認知功能障礙。大鼠腦海馬內注射OA可有效抑制PP2A的活性,誘導記憶損傷,常伴有明顯的神經病理變化,包括Tau蛋白的過度磷酸化和Aβ淀粉樣斑塊[12-13],可有效構建AD模型,并反映其認知功能障礙。因此,本課題通過大鼠腦海馬區注射OA抑制PP2A活性,誘導構建AD模型,然后給予TTM處理,以觀察該藥是否能通過調控PP2A活性,進而逆轉該模型大鼠的認知功能障礙。已有文獻報道[7,9],TTM作為土家族特色藥材在抗AD方面有一定療效和研究基礎,其作用機制可能是通過升高AD大鼠腦組織的SOD、GSH-Px活性,從而抗氧化,降低MDA蓄積,最終達到延緩衰老作用。但TTM能否上調PP2A表達及活性,進而逆轉Tau蛋白的過度磷酸化和Aβ 1-40,42的表達,目前尚未見文獻報道。為了觀察TTM不同劑量和不同的給藥時間對AD的影響,本實驗TTM分為低、中、高3個劑量[14],在給藥時間長度上分為1周、2周,以摸清不同劑量和不同時間點其藥效如何。
水迷宮行為學實驗測試結果顯示,無論是用藥1周還是2周,用藥組大鼠穿過目的象限的次數增多,逃避潛伏期縮短,游泳軌跡穿越第3象限平臺的目的性強,總的游泳路程短,用時少,呈一定的搜索策略,且與劑量具有一定依賴性。用藥2周組整體水平略好于用藥1周組。這一結果表明TTM可有效改善AD大鼠空間學習記憶能力,并具有劑量-時間依賴性。
Western blot結果發現,TTM用藥1周和2周的中、高劑量組PP2A甲基化水平升高,而去甲基化水平和PP2Ac在Y307位點上的磷酸化水平明顯降低,PP2A甲基化水平與其活性呈正相關,PP2Ac去甲基化水平和Y307位點的磷酸化水平與其活性呈負相關。該結果說明,兩個時間點的TTM可有效提高OA抑制的AD大鼠腦海馬PP2A活性。同時結果顯示,兩個時間點TTM的中、高劑量組中,Tau蛋白pS396、pT404兩個位點的磷酸化水平低于OA組,特別是2周時間點更明顯,而低劑量與OA組差異不明顯,表明TTM能有效降低AD模型大鼠腦海馬Tau蛋白磷酸化水平,并呈劑量依賴性。
尼氏體可反映神經細胞的功能活性[15],當神經元受損時,尼氏小體將會溶解,直至完全消失,但該病變具有可逆性。因此,有必要檢測尼氏體以掌握TTM能否修復或改善受損神經元的功能活性。本實驗用尼氏染色法檢測海馬區尼氏體的數量和分布情況,結果表明用藥1周組,在海馬CA1和CA3區,TTM中、高劑量組尼氏小體數量多于OA組,而在2周組中海馬CA1區,TTM高劑量組尼氏小體數量明顯多于OA組,在CA3區,低、中、高劑量組均明顯多于OA組。此結果提示,TTM中、高劑量組在不同時間點均能明顯增加AD大鼠海馬區尼氏小體的數量,修復受損神經。
上述實驗結果表明,TTM能有效提高OA抑制的AD大鼠腦海馬PP2A活性,降低其誘導的Tau蛋白過度磷酸化水平,增加海馬區尼氏小體的數量,從而改善AD大鼠空間記憶能力,并呈現一定的劑量依賴性,且與用藥時間具有一定相關性。而TTM是否與用藥時間呈更廣范圍的依賴性還有待于進一步的研究和探討。

