牛源MRSA新疆流行株毒力基因檢測及Agr分子分型研究
孟 丹, 孟慶玲, 喬 軍, 蔡擴軍, 于偉偉, 伍曄暉, 才學鵬, 陳創夫
(石河子大學動物科技學院,新疆石河子 832003)
金黃色葡萄球菌是一種感染人畜最為常見的病原菌[1]。目前,人類醫源感染的病原菌多為耐甲氧西林金黃色葡萄球菌(methcillin resistantStaphylococcusaureus,MRSA),會引起深部感染以及皮膚感染,具有較高的發病率和病死率[2]。動物源特別是牛源MRSA感染易引起奶牛嚴重的乳房炎和子宮內膜炎,給奶牛養殖業帶來嚴重的經濟損失。美國疾病預防控制中心報告,在細菌感染引起的疾病中,由金黃色葡萄球菌引起的感染占第2位,僅次于大腸桿菌[3]。此外,一些致病性金黃色葡萄球菌能夠產生多種致病因子,如lukF、lukS、hla、hlb等,這些致病因子可誘發炎癥,并引起組織損傷,加劇了臨床治療難度[4]。
金黃色葡萄球菌能夠分泌多種毒素和酶,這些毒力蛋白的表達由RNA Ⅲ調控,它是Agr(accessory gene regulator)位點轉錄的一個中心多向調節因子。目前,認為RNAⅢ至少是由2個雙組分系統激活,這2個雙組分系統一個是由agr位點編碼的AgrC與AgrA,在金黃色葡萄球菌中,研究最清楚的雙組分調節系統是AgrCA[5]。金黃色葡萄球菌的大多數毒力因子是由Agr位點調控,基于Agr編碼的自動誘導肽和相關受體的氨基酸序列多態性,學者們把金黃色葡萄球菌Agr分成4個主要基因型(Ⅰ~Ⅳ)[6]。為此,本研究利用多重PCR技術,分析了新疆地區MRSA不同流行株的Agr基因型的流行狀況,并檢測了MRSA流行株的部分毒力基因攜帶狀況,以期了解MRSA新疆流行株的分子特征,為進一步研究毒力基因與Agr不同基因型之間的內在聯系,以提供流行病學資料。
1 材料與方法
1.1 主要試劑
甘露醇高鹽瓊脂培養基、BHI液體培養基,購自青島高科園海博生物技術有限公司;大腸桿菌(E.coli)DH5α菌種,由筆者所在實驗室保存;細菌基因組DNA提取試劑盒、pMD19-T載體,DNA Marker,均購自TaKaRa公司;生化鑒定管,購自杭州濱和微生物試劑有限公司;抗菌藥物紙片,購自杭州微生物試劑有限公司;質粒小量提取試劑盒和DNA凝膠回收試劑盒,購自諾維森(北京)生物科技有限公司。
1.2 樣品的采集
分別從新疆五家渠、石河子、沙灣、烏魯木齊4個地區的規模化奶牛場,采集臨床型乳房炎和子宮內膜炎樣品221份,乳樣采集通過溫水清洗乳房并使用75%乙醇棉球對乳頭進行消毒處理,收集第3把奶后的奶樣。子宮內膜炎樣品通過直腸把握子宮直接采樣法收集,放于滅菌的試劑管中,置于冰盒中,運送實驗室進行分離培養。
1.3 引物
根據GenBank中已公布的金黃色葡萄球菌的耐藥基因mecA序列和部分毒力基因序列,應用primer 5軟件設計引物,再送至北京華大生物科技有限公司合成備用。本研究中所用的主要耐藥基因和部分毒力基因的引物設計見表1。

表1 耐藥基因和部分毒力基因的引物
1.4 分離鑒定
將采集的樣品接種于甘露醇高鹽瓊脂培養基,放置于 37 ℃ 恒溫箱培養12~48 h。挑取具有典型特征的單菌落,在營養瓊脂培養基上進行純化培養,對純化菌進行涂片、革蘭氏染色、鏡檢。隨機選取分離株用SA生化鑒定管測定其生化反應特性,根據GenBank中已公布的金黃色葡萄球菌16S rRNA的序列設計通用引物,對SA分離株進行16S rRNA序列比對分析,鑒定分離株為金黃色葡萄球菌。將分離的金黃色葡萄球菌在BHI肉湯中37 ℃培養24 h,再將500 μL所得新鮮菌液加入到500 μL 40%甘油中振蕩混合均勻制成20%甘油菌,-20 ℃保存備用。
1.5 藥敏試驗及MRSA確證方法
用無菌接種環挑取單個菌落,接種于BHI培養液于 37 ℃ 培養20~24 h,再用滅菌生理鹽水將細菌濃度調至0.5麥氏濁度,取200 μL均勻涂布于MHA培養基,涂布均勻后貼上苯唑西林藥敏紙片,用鑷子輕壓紙片使其與培養基表面緊密接觸。放置37 ℃恒溫培養箱中培養48 h后測量抑菌圈直徑。進一步通過PCR方法擴增mecA來確定MRSA陽性菌。判斷30 μg苯唑西林抑菌環直徑≤1 cm的菌株,即為MRSA。
1.6 毒力基因的檢測
采用多重PCR的方法[7]對毒力基因白細胞毒素基因(PVL、lukED、lukM)、溶血素基因(hla、hlb、hld)、表皮剝脫素基因(eta、etb)、中毒休克綜合征毒素基因tst和黏附素基因edin進行檢測。
1.7 菌株基因組DNA提取
用無菌接種環挑取單個菌落接種至無菌BHI培養液于37 ℃振蕩過夜,取1.5 mL細菌培養液于無菌EP管內在 12 000 r/min 下高速離心,棄去上清后,按細菌基因組DNA提取試劑盒的操作說明進行后續試驗。DNA提取結束后,采用4 μL PCR產物用1%瓊脂糖凝膠電泳檢測,EB染色后在凝膠成像系統上照相。DNA模板于-20 ℃保存,用于Agr分型研究。
1.8 Agr基因分型
根據Agr等位基因(Ⅰ~Ⅳ)4種類型,引物合成參照文獻[8]進行。采用多重PCR擴增4種類型的基因,PCR擴增條件如下:95 ℃,5 min;95 ℃,40 s,58 ℃ 50 s,72 ℃ 50 s,進行35個循環;72 ℃延伸10 min;4 ℃保存。擴增后,取其產物10 μL進行瓊脂糖凝膠電脈(1.5%),80 V40 min,凝膠成像系統照相,觀察擴增條帶,比較電泳圖像。
2 結果與分析
2.1 MRSA的分離與鑒定
從新疆4個不同的牛場采集了221份樣,共分離到71株金黃色葡萄球菌,在甘露醇高鹽培養基中長出黃色或乳白色菌落(圖1)。其中MRSA有13株,4株來自沙灣,4株來自烏魯木齊,2株來自石河子,3株來自五家渠(表2)。并且13株菌的mecA基因檢測均為陽性。MRSA流行株占5.9%(13/221)。

表2 13株MRSA毒力基因的檢測結果
2.2 MRSA毒力基因的檢測
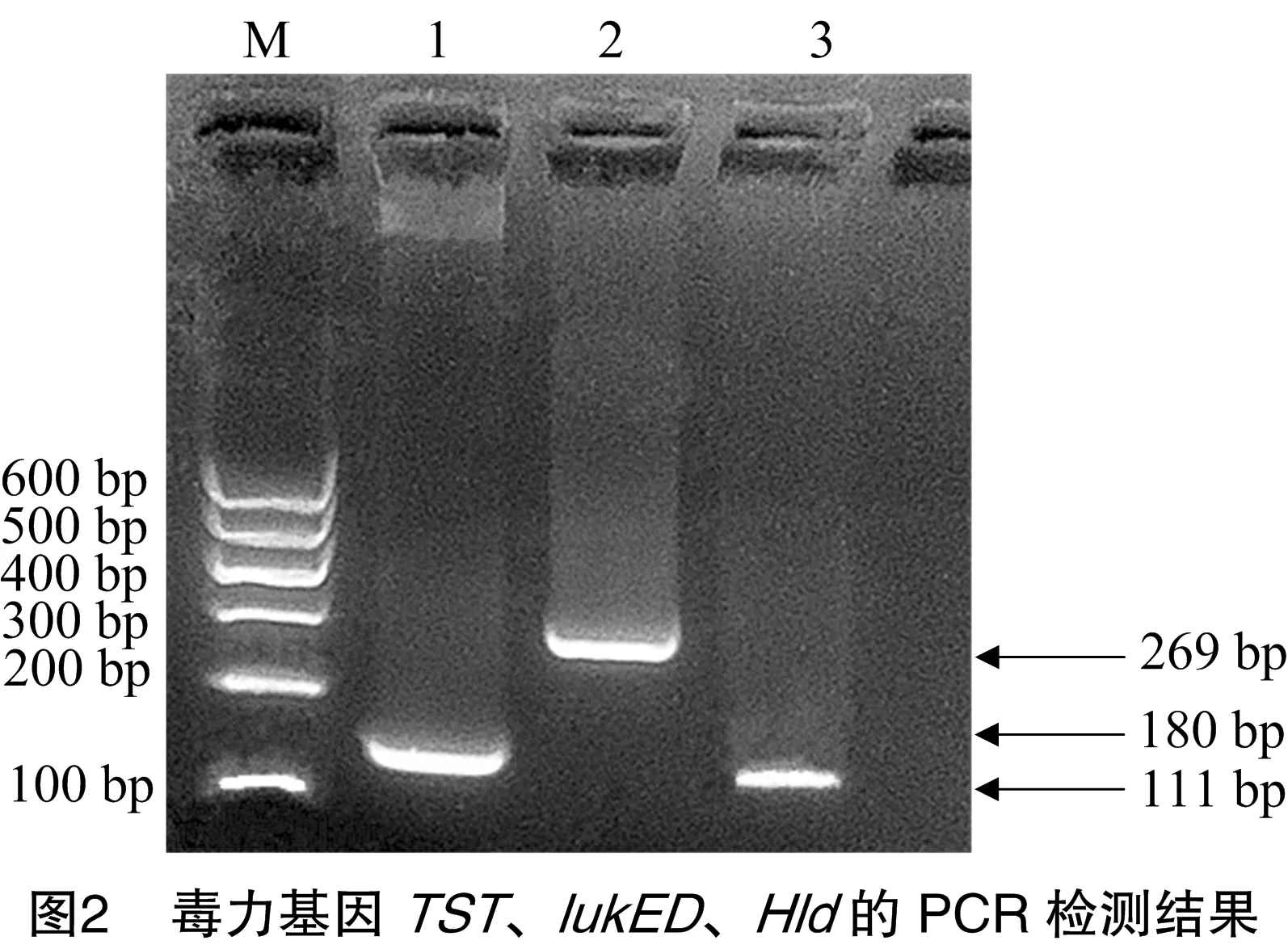
13株MRSA經PCR擴增10對毒力基因,出現3種毒力基因特征性條帶(圖2)。其中,2株同時檢出毒力基因hld、lukED、tst,1株同時檢出毒力基因hld、tst,2株僅檢出毒力基因TST,其他菌株均檢出毒力基因lukED、TST,可見除3株菌檢出溶血素毒力基因hld外,白細胞毒素基因lukED和中毒休克綜合征毒素基因tst為主要檢測出的毒力基因(表2)。
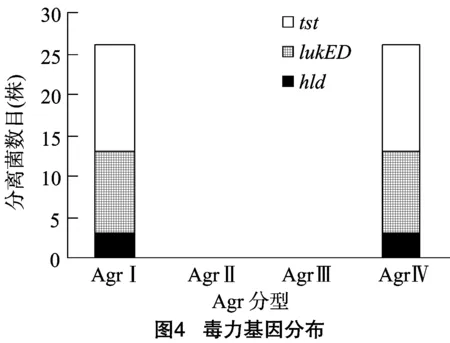
2.3 Agr基因分型結果
由圖3、表3、圖4可知,13株MRSA流行株Agr分型出現2種特征性條帶,均為AgrⅠ型和AgrⅣ型,且每株菌同時具有2種分型,其中AgrⅡ型和AgrⅢ型均未檢出,Agr分型與毒力基因的分布存在一定的差異。
3 討論
目前,MRSA仍然是全世界感染的最嚴重的病原菌之一,并且呈不斷增加的趨勢[9]。與甲氧西林敏感金黃色葡萄球菌相比, MRSA具有更強的引發患畜感染及發生菌血癥的能力[10],而這與MRSA攜帶的獨特的毒力因子密切相關。一般來說,MRSA的主要毒力因子有腸毒素、殺白細胞毒素、溶血素、毒性休克綜合征毒素等,這些毒力因子因具有不同的生物學特性而呈現出不同的致病特征[11]。在本研究中,從13株MRSA中共檢出hld、ukED、tst這3種毒力基因,其中lukED和tst檢出率相對較高, 且出現同一株菌攜帶3種或2種毒力基因的情況,表明MRSA的毒力差異不僅體現在菌株之間,還與細菌本身的進化以及宿主因素的影響關系密切。而對于檢出的hld是1種溶血素,可在宿主細胞膜上形成小孔,造成細胞內液外流而導致細胞破壞[12]。lukED屬于一種白細胞毒素,是MRSA的重要毒力基因,可以對抗宿主的免疫系統[13]。tst主要與編碼基因的一些特定可移動序列有關,可表達tst-1,是一種超抗原,能夠直接活化T淋巴細胞,使其在感染患者體內釋放出炎癥介質而導致機體發病[14]。MRSA及其攜帶的hld、lukED、tst毒力基因的流行,使其成為牲畜感染的主要致病菌,給患畜的抗感染臨床治療帶來了嚴峻挑戰。因此,檢測MRSA的毒力基因可為臨床治療及感染控制提供依據。
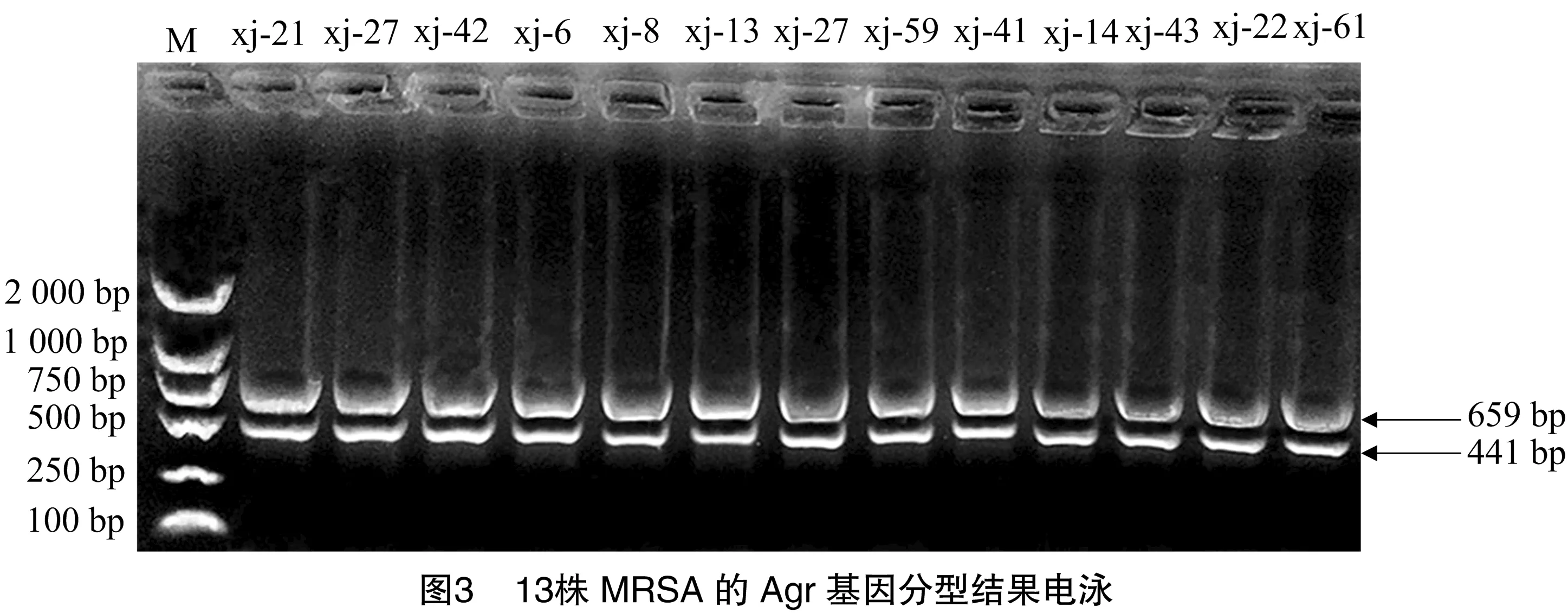
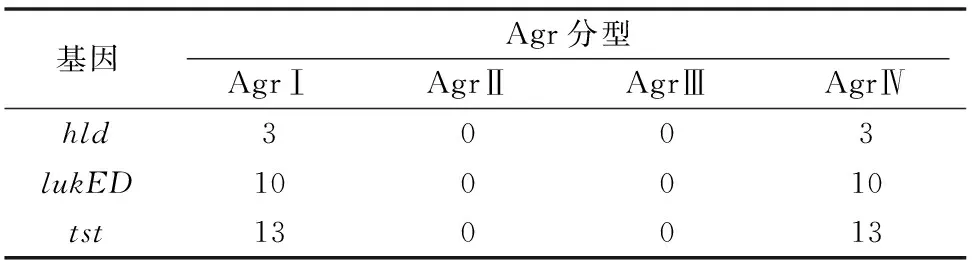
表3 13株MRSA流行株Agr分型
金黃色葡萄球菌附屬基因調節系統Agr是最早發現的金黃色葡萄球菌調控位點[15]。同時,也被認為是金黃色葡萄球菌最重要的群集感應系統,它影響著許多外毒素和胞外蛋白的分泌表達[16]。金黃色葡萄球菌附屬基因調節子(Agr)位點是一個全面的群集感應系統并且控制著毒力因子的產生。盡管Agr基因在細菌的毒力調節上具有重要的影響,研究表明大量的抗生素使用會造成金黃色葡萄球菌出現Agr陰性,抗生素產生的耐藥也會使毒力出現一定程度的下降[17-18]。可見Agr基因與抗生素、毒力因子之間可能存在一定的聯系。王瓊等針對人源、牦牛源、食品源、雞源和羊源金黃色葡萄球菌分離菌株進行Agr基因分型檢測出AgrⅡ、AgrⅢ、AgrⅣ 3種型[19]。Xie等的研究表明,108株醫院源菌株分離菌株中,AgrⅠ型占據最流行地位[20]。在本研究中,從新疆牛源MRSA菌株中檢出Agr Ⅰ和Agr Ⅳ型,Agr Ⅳ與王瓊等從不同來源的樣品中檢出的Agr型相同,Agr Ⅰ與Xie等從醫院源菌株檢出的Agr型[20]相同,可見MRSA有可能在Agr基因水平上有人畜間傳播的可能。本研究為MRSA分離株的分子分型奠定一定基礎,同時也為進一步探討MRSA毒力因子與Agr之間的相關性奠定基礎。
近年來,隨著新疆地區奶牛飼養方式的改變,奶牛規模化養殖迅速發展,乳房炎和子宮內膜炎已經成為奶牛的高發病和常發病,成為制約新疆奶牛業發展的瓶頸。為了防治奶牛乳房炎和子宮內膜炎,在獸醫臨床上大量使用抗菌藥物,導致MRSA菌株不斷出現,給該病的防控和人們健康帶來了嚴重的威脅。國內外學者在奶牛上檢出MRSA菌株日益增多,而且隨著MRSA菌株的不斷遺傳進化,耐藥表型、傳播規律和致病機理越來越復雜,提示牛源的MRSA與人源MRSA之間的關系越來越密切,MRSA在人畜之間,甚至不分國界的傳播與擴散也越來越嚴重。因此,開展牛源MRSA分子流行病學和毒力基因檢測研究,對于防控型人-畜之間MRSA的相互傳播至關重要。

