HNO/HON和HNO+/HON+基態的異構化及電離能的理論計算
◎ 陳夢元,趙文武
(貴州省產品質量監督檢驗院仁懷分院,貴州 仁懷 564500)
硝酰基(HNO)分子在大氣化學和燃燒中都有很重要的意義。HNO還具有生物活性,它能夠作為一個有力的細胞劑,增加DNA中雙滯留時間,損耗細胞酶,使肌肉得以放松。HNO作為一個強有力的酶抑制劑,削弱了經硫醇修正的NMDA感受器的活性,從而使神經得到保護[1]。HNO的異構體已在理論和實驗上證明了它的存在[2],但是NOH是否參與了HNO生理化學反應還有待進一步的研究[3]。環境中存在很多硝酰基參與的生物作用,所以硝酰基基態的異構化問題受到廣泛的關注。此外,HNO還在一些藥物釋放系統中具有特別的生物學意義。HNO及其衍生物在大氣化學中有重要的作用,例如其在化學污染形成、推進劑中能量的釋放和燃料燃燒等過程中均發揮了一定的作用[4-5]。考慮到HNO及其衍生物在生物體以及氣象化學中的重要性,許多工作者致力于HNO電子態特征以及不同結構性質的實驗及理論研究并取得一些認識。大量理論研究和實驗驗證,大氣中HNO或NOH不僅擁有復雜的分裂方式,還有復雜的異構化機理[6]。迄今為止,有大量關于HNO和NOH的研究,但是關于HNO和NOH的光學特征研究較少。文獻中,還研究了水HNO/HON體系質子轉移的催化作用,HNO/HON的互變異構機理以及最佳的互變異構路徑[7],由于文獻對硝酰基基態異構化的報道較少,因此研究HNO+/NOH+互變異構機理以及互變異構的最優路徑有重要的現實意義和科學研究價值。
1 計算方法
本文使用Gaussian03程序,分別采用密度泛函理論的B3LYP方法分別在6-311++G(3df,3pd)和augcc-pVTZ基組水平上對HNO/HON和HNO+/ HON+的結構及異構化反應進行了計算,通過振動分析確定反應物、產物和過渡態,并計算了異構化反應的內稟反應坐標(IRC),確定了過渡態的存在。
2 結果與討論
2.1 HNO/HON體系
2.1.1 HNO/HON平衡構型及過渡態
用密度泛函理論的B3LYP方法分別在6-311++G(3df,3pd)和aug-cc-pVTZ基組水平上對HNO/HON體系的分子HNO→HON過渡態TS1的結構進行優化,見表1,基態HNO、HON和過渡態TS1的幾何構型如圖1所示。
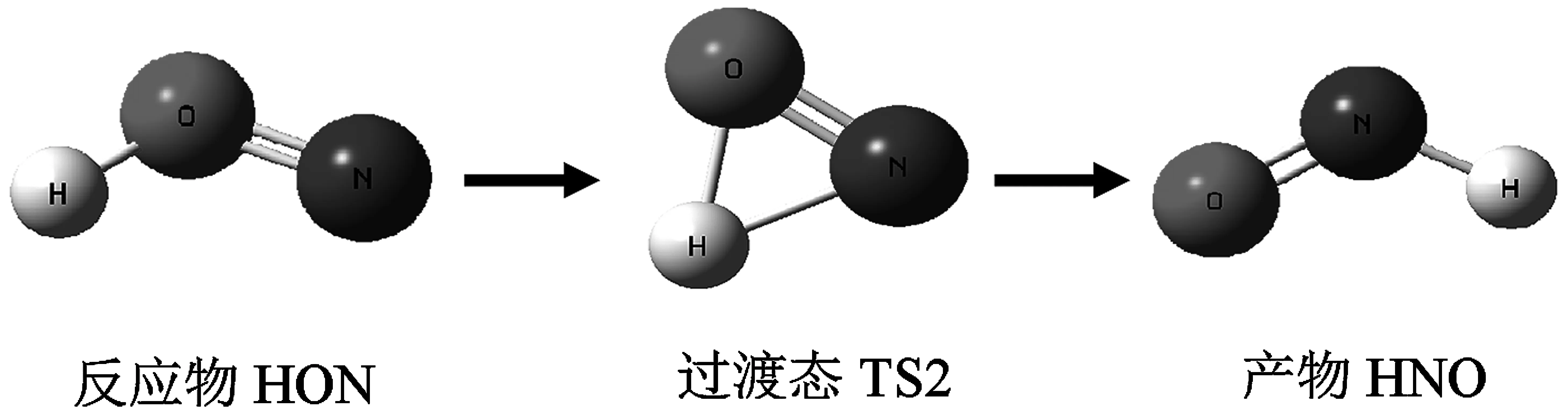
圖1 HON→HNO異構化反應示意圖
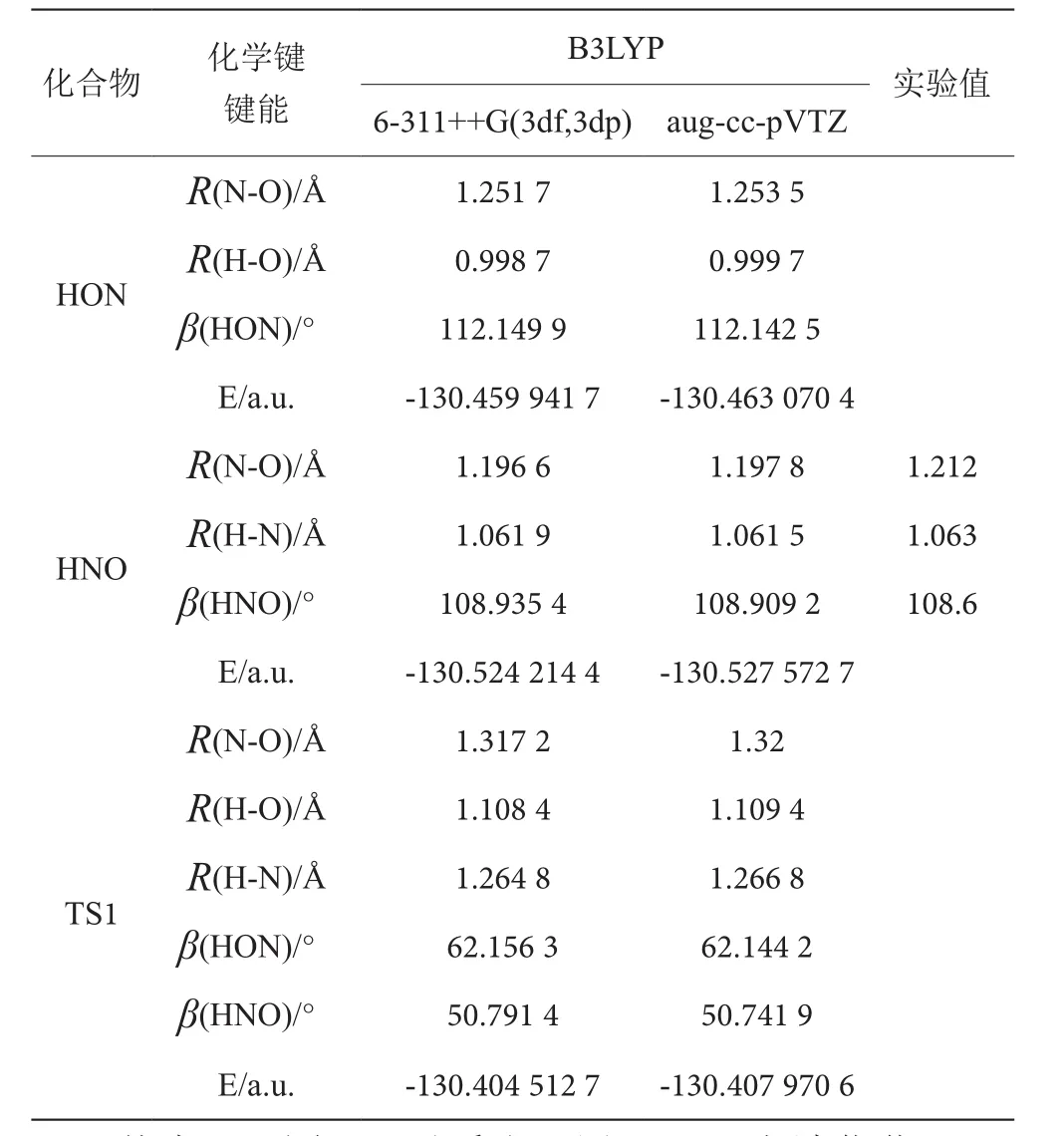
表1 HNO、HON及過渡態TS1的結構參數和能量表
總體來說,用B3LYP/aug-cc-pVTZ優化計算HNO分子的平衡幾何結構參數比用B3LYP/6-311++G(3df,3pd)優化計算的結果較好,并且計算的能量較低。因此,可以用B3LYP/6-311++G(3df,3pd)和B3LYP/aug-cc-pVTZ方法對HNO/HON及HNO+/HON+作對比計算,從表1還可以看出,優化HNO、HON及過渡態TS1分子得到的幾何結構均具有Cs對稱性。在同一基組下,優化HNO、HON分子在平衡幾何結構時的能量,其HNO分子比HON分子的能量低,HNO分子比HON分子穩定,且基態HNO/HON及過渡態TS的電子態均為1A′。
2.1.2 HNO/HON頻率振動
計算HNO/HON異構化過程中反應物、TS1及產物的振動頻率,見表2。
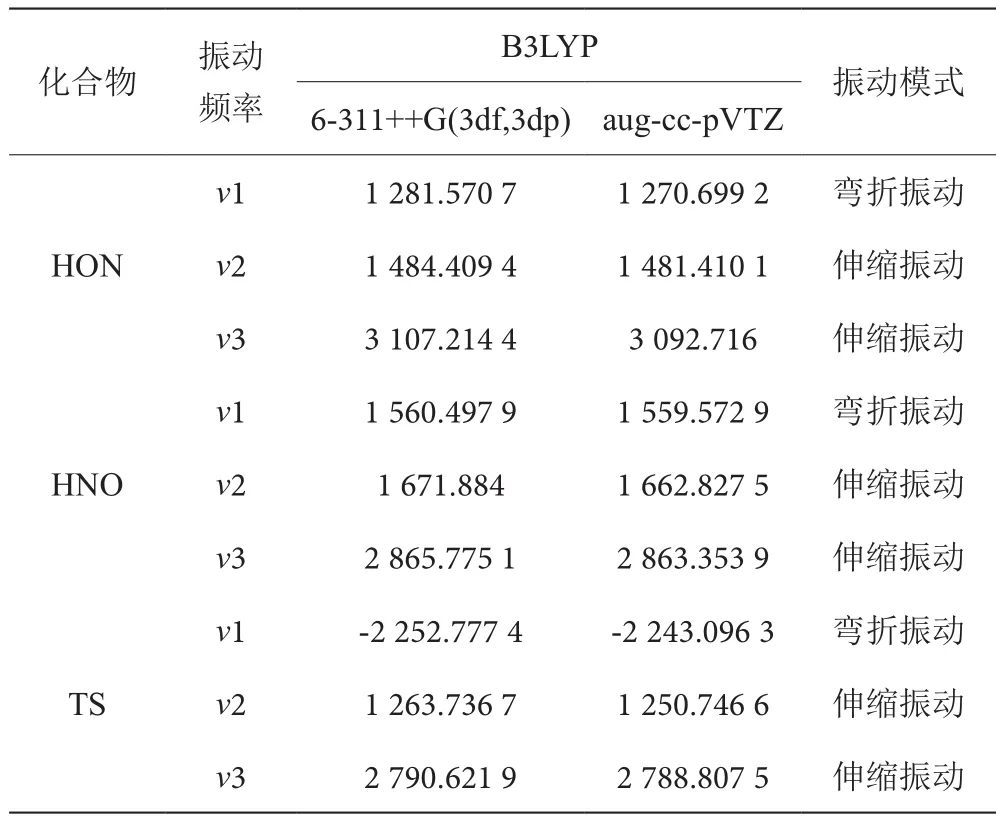
表2 HNO、HON及過渡態TS1的振動頻率和振動模式表
從表2可得出的結論是:對于HON,v1是N-H鍵的彎折振動,v2為O-N的伸縮振動,v3為O-H鍵的伸縮振動。而HNO的v2是N-H鍵的彎折振動,v2為N-O的伸縮振動,v3為N-H鍵的伸縮振動。從基態HON和HNO的振動頻率可以看出,所有的頻率均為正值,說明基態HON、HNO駐點是分子勢能面上的極小點,為穩定構型。
2.2 HNO+/HON+體系
2.2.1 HNO+/HON+體系的平衡構型及過渡態
使用B3LYP方法分別在6-311++G(3df,3pd)和aug-cc-pVTZ基組水平上對HNO+/HON+的結構進行優化,同時計算HNO+/HON+異構化過程中的能量以及過渡態TS的結構和能量,其結果見表3,基態HNO+、HON+和過渡態TS2的幾何構型如圖2所示。
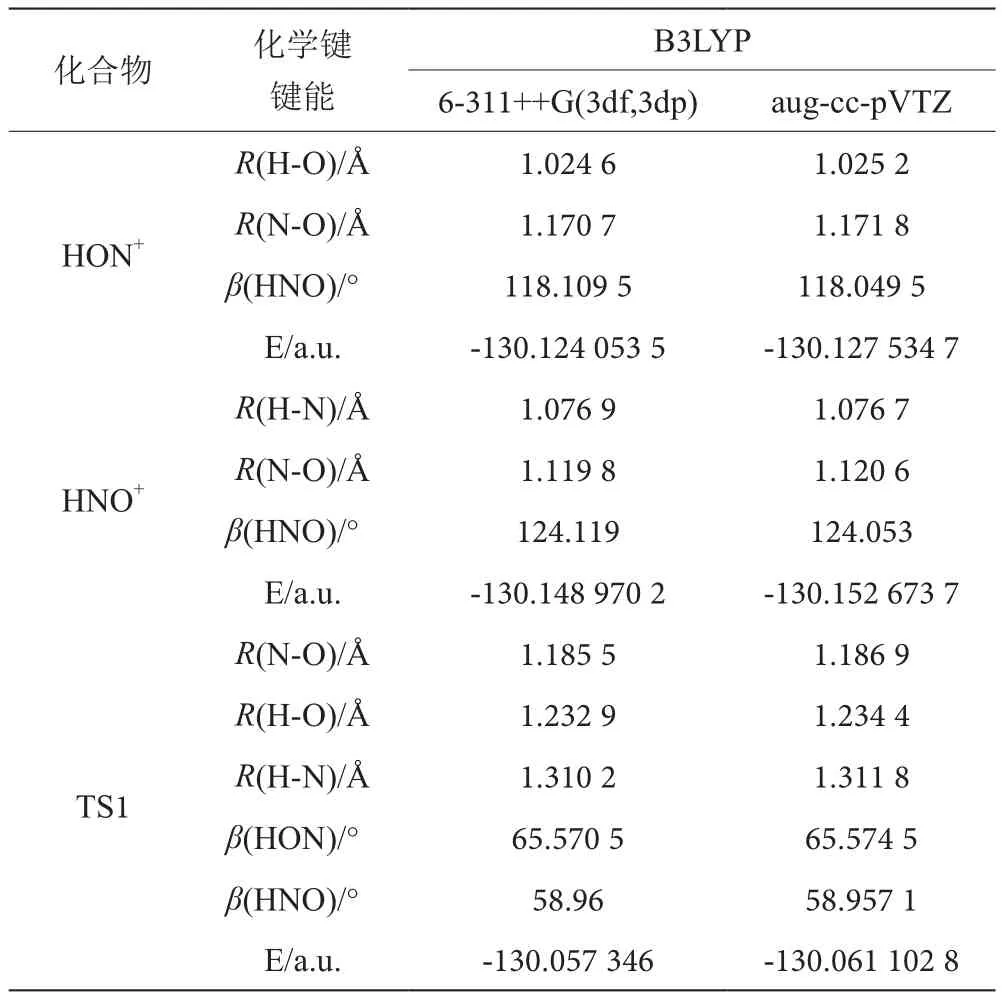
表3 HNO+、HON+及過渡態TS1的結構參數和能量表
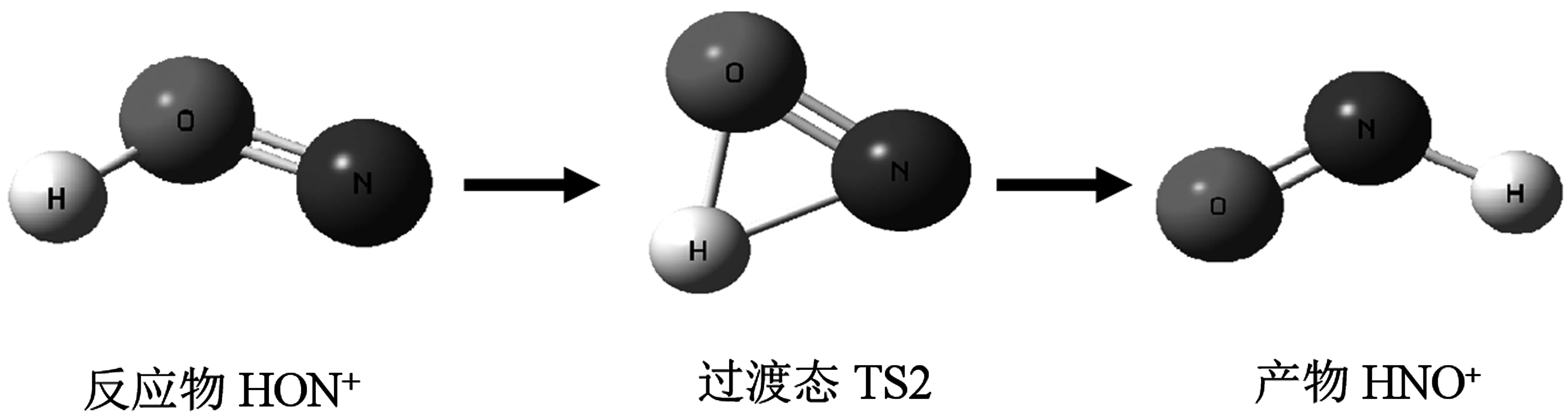
圖2 HON+→HNO+異構化反應示意圖
從圖2可以看出,優化HNO+、HON+及過渡態TS2得到的幾何結構均具有Cs對稱性。在同一基組條件下,對HNO+、HON+離子在平衡幾何結構時的能量進行分析,用B3LYP/6-311++G(3df,3dp)方法計算得到:HON+的能量為-130.124 053 5 a.u,HNO+的能量為-130.148 970 2 a.u.。用B3LYP/aug-cc-pVTZ計算得到:HON+的能量為-130.127 534 7 a.u.,HNO+的能量為-130.152 673 7 a.u.。可見,HNO+離子比HON+離子的能量低,所以HNO+離子比HON+離子穩定。
目前我國大部分職前體育教師的自主實習流于形式,實習質量難以保證。在職教師沒有對實習生進行規范指導,而大學也沒有對職前教師提出明確的實習目標與要求,職前體育教師自身也沒有對實習采取充分的重視,浪費了就職前寶貴的“練兵”機會。建議體育類高校嘗試與中小學建立穩定的合作關系并逐步建立成熟的實習生管理模式,高校提供優秀體育教師后備人才和理論導向的支持,中小學提供實習場所和實踐經驗豐富的在職教師的指導,兩者職責明確,且實習生接受雙方的監管。這有利于高等教育與基礎教育進行優勢互補,共同承擔職前體育教師的教育實習責任,提高實習質量,為職前體育教師的成長共同努力。
2.2.2 HNO+/HON+頻率分析
表4列出了基態HNO+、HON+及過渡態TS的振動頻率以及離子的振動模式。
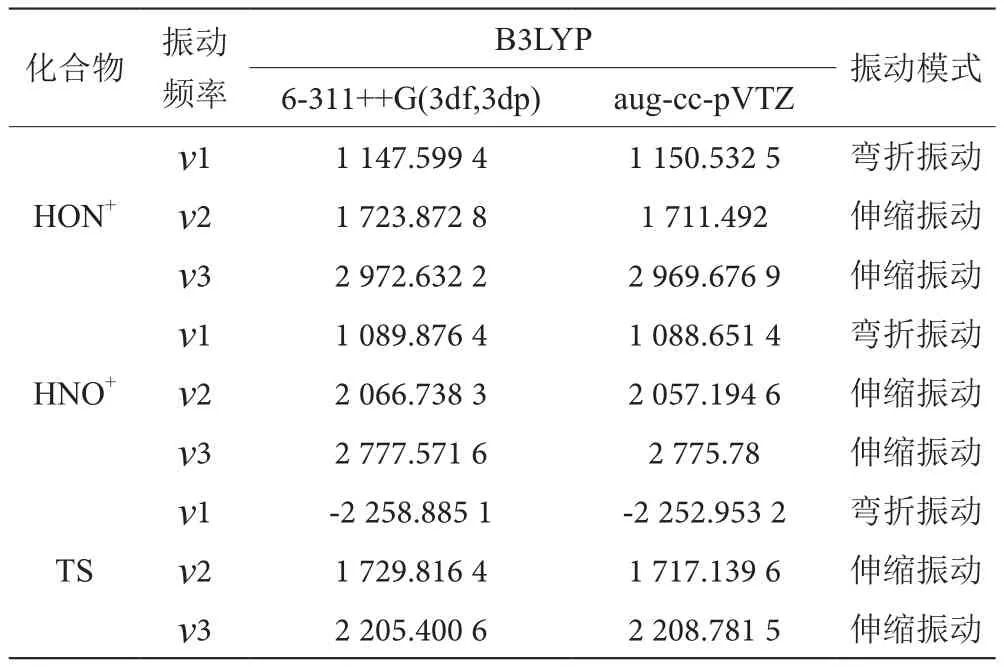
表4 HNO+、HON+及過渡態TS2的振動頻率和振動模式表
從表4可得出的結論是:對于HON+,v1是N-H鍵的彎折振動,v2為O-N的伸縮振動,v3為O-H鍵的伸縮振動。而HNO+的v1是N-H鍵的彎折振動,v2為N-O的伸縮振動,v3為N-H鍵的伸縮振動。從基態HON+和HNO+的振動頻率可以看出,所有的頻率均為正值,說明基態HON+、HNO+駐點是離子勢能面上的極小點,為穩定構型。
從以上的圖表中可以得到HNO+/HON+的平衡幾何構型優化和過渡態TS計算的結果顯示,基態HNO+/HON+及過渡態TS2電子態均為2A’。
在計算得到過渡態TS的振動頻率中,僅有唯一虛頻率,根據過渡態理論的判據,說明我們找到的過渡態是真實的。為了進一步論證過渡態TS的真實性,進一步計算了HNO→HON以及HNO+→HON+異構化反應的內稟反應坐標(IRC),得到異構化反應體系的能量隨反應坐標的變化曲線,如圖3、4所示。
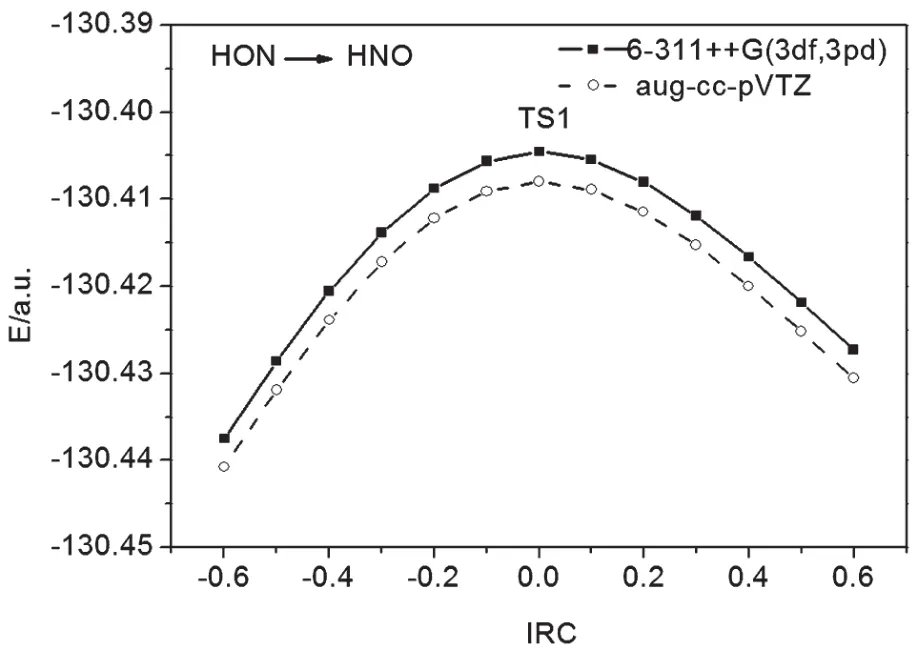
圖3 HON→HNO內稟反應坐標IRC的計算圖
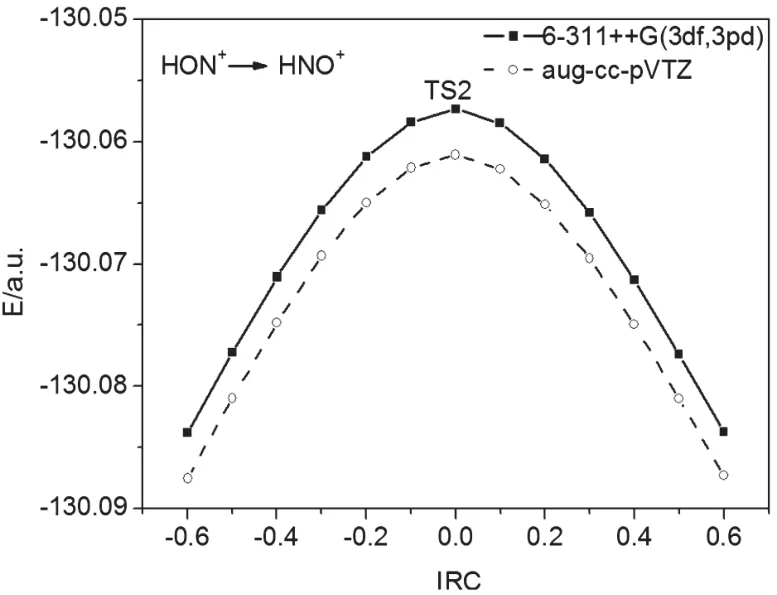
圖4 HON+→HNO+內稟反應坐標IRC的計算圖
從圖3、4可看出,在反應坐標中點,過渡態TS處于異構化反應體系能量的最高點,當反應坐標向正的方向進行,過渡態TS轉化為產物HNO及HNO+,當反應坐標向負的方向進行,過渡態TS轉化為反應物HON和HON+,TS1和TS2分別是HON→HNO及HON+→HNO+異構化反應途徑的能量極小點(鞍點)[10],如圖5、6所示。
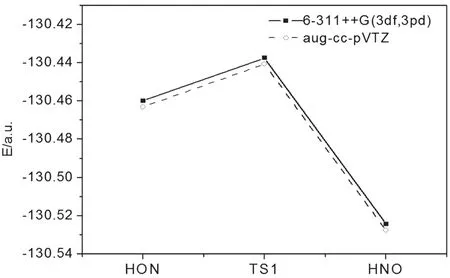
圖5 HON→HNO反應途徑的極小能量圖
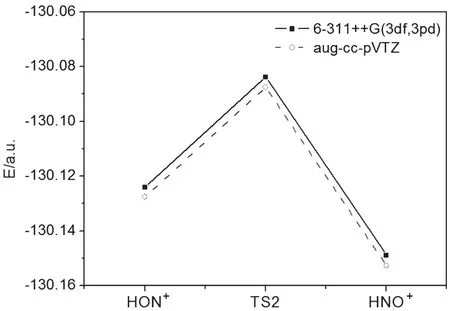
圖6 HON+→HNO+反應途徑的極小能量圖
2.3 反應的活化能和熱效應
2.3.1 反應活化能的計算
計算反應活化能的公式[11]為:

式(1)中,Eb是過渡態與反應物的能量差(勢壘高度),ε≠0是過渡態的零點振動能,ε0(R)是反應物分子的零點振動能。
計算得到HON→HNO及HNO+→HON+異構化反應的活化能分別見表5、6。

表5 HON→HNO異構化反應的活化能表(kJ/mol)

表6 HON+→HNO+異構化反應的活化能表
從表5可以看出,對于正向HON→HNO的異構化反應,用B3LYP/6-311++G(3df,3pd)方法計算的活化能是48.07 kJ/mol,用B3LYP/aug-cc-pVTZ方法計算的活化能是47.73 kJ/mol。而對于逆向HNO→HON的異構化反應,用B3LYP/6-311++ G(3df,3pd)方法計算的活化能是215.47 kJ/mol,用B3LYP/aug-cc-pVTZ方法計算的活化能是215.73 kJ/mol。通過對正向和逆向異構化反應的活化能進行比較,得到正向異構化反應比逆向異構化反應容易進行。
用上述同樣的討論方法,從表6中可以看出,對于正向HON+→HNO+的異構化反應,用B3LYP/6-311++G(3df,3pd)方法計算的活化能是94.211 kJ/mol,用B3LYP/aug-cc-pVTZ方法計算的活化能是93.59 kJ/mol。而對于逆向HNO+→HON+的異構化反應,用B3LYP/6-311++G(3df,3pd)方法計算的活化能是159.09 kJ/mol,用B3LYP/aug-cc-pVTZ方法計算的活化能是159.06 kJ/mol。通過對正向和逆向異構化反應的活化能進行比較,得到正向異構化反應比逆向異構化反應容易進行[12]。
2.3.2 計算反應熱效應
計算反應熱效應的公式為:

式(2)中,H298K(P)是產物的焓值,H298K(R)是反應物的焓值。
將計算得到HON→HNO及HNO+→HON+異構化反應的熱效應分別列于表7和表8中。

表7 HON→HNO異構化反應的熱效應表(kJ/mol)

表8 HON+→HNO+異構化反應的熱效應表(kJ/mol)
從表7和表8可以得出,HON→HNO的異構化反應中,ΔH是負值,說明正向反應是放熱反應;同樣的,HON+→HNO+異構化反應中,ΔH是負值,正向反應也是放熱反應。
3 結論
本文用B3LYP/6-311++G(3df,3pd)和B3LYP/aug-cc-pVTZ方法分別優化計算HON→HON和HON+→HNO+及過渡態的結構、振動頻率以及HON→HON和HON+→HNO+異構化反應的活化能和熱效應,經計算分析得到如下結果:①HON及HNO分子和HON+及HNO+離子均能穩定存在,均具有Cs對稱性。且HNO和HNO+的能量較低,因此HNO比HON穩定,HNO+比HON+穩定。②在HON→HNO和HON+→HNO+的異構化反應中,正向反應的活化能較低,逆向反應的活化能較高,且正向反應為放熱反應。希望本研究可以為進一步研究HON→HNO和HON+→HNO+異構化反應的動力學特征提供理論依據和參考。

