丹紅注射液對大鼠局灶性腦缺血再灌注后腦血管內皮損傷的保護作用*
羅 霞 胡 彬 王欣玲 秦桂芳 吳勝英
(1.湖北省十堰市太和醫院,湖北醫藥學院附屬醫院,湖北 十堰 442000;2.湖北省十堰市人民醫院,湖北 十堰 442000;3.湖北醫藥學院基礎醫學院,湖北 十堰 442000)
血管內皮細胞可通過內分泌、旁分泌和自分泌等途徑分泌血管活性物質內皮素-1(ET-1)、一氧化氮(NO)等。ET-1和NO在抑制血管壁炎癥反應及平滑肌細胞增殖、抗血栓形成、調節血管緊張性等方面發揮著重要作用[1]。NO是血管內皮細胞分泌的舒血管因子,L-精氨酸在NO合酶 (eNOs)作用和催化下產生NO,后者通過激活鳥氨酸環化酶,介導cGMP而發揮調控血管舒張功能[2]。不僅如此,NO還具有抑制平滑肌細胞增殖、血小板聚集及單核細胞黏附性等重要功能[3]。然而在缺血再灌注等有害因素作用下,內皮細胞釋放的舒血管因子NO減少,縮血管因子ET-1增多,造成血管平衡穩態失衡,血管內皮功能發生紊亂[4]。除上述血管活性物質外,缺血再灌注后還會引起白細胞介素-10(IL-10)、轉錄因子(NF-κB)、轉錄激活蛋白-1(AP-1)、細胞間黏附分子-1(ICAM-1)、血管細胞黏附分子-1(VCAM-1)等多因素參與缺血再灌注后血管內皮炎癥反應[5]。臨床收治的急性腦梗死患者在經溶栓治療后,由于血流再通,常出現缺血再灌注后損傷而加重臨床癥狀,患者因急性腦功能缺損而致殘甚至死亡。中藥制劑丹紅注射液在抑制缺血再灌注后氧化應激反應、促進血管新生等方面有一定的作用,但針對缺血再灌注后損傷造成的血管內皮炎癥性損傷的相關研究還不夠系統[6]。本研究采用線栓大腦中動脈willis環缺血45 min后再灌注的方法模擬人急性腦梗死后缺血再灌注后損傷,并用丹紅注射液進行治療,分析其干預機制,為臨床治療急性腦梗死提供實驗和理論基礎。
1 材料與方法
1.1 實驗動物 雄性SD大鼠共72只,體質量(180±20)g,實驗動物購自湖北醫藥學院動物中心,許可證:SCXK(鄂)2017-0008。動物房12 h交替光照,22℃恒溫,濕度控制在70%~80%,動物自由飲水,分籠、普通飼料適應性喂養1周。
1.2 試藥與儀器 丹紅注射液(云南生物谷藥業股份有限公司,批號:16061034);麻醉用水合氯醛(上海展云化工有限公司,批號:20170119);奈必洛爾(杭州甫洛生物科技有限公司,批號:152520-56-4);鼠抗FLK-1、VEGF及eNOs檢測用ELISA試劑盒 (上海酶聯生物科技有限公司,批號:2017360323,20170412,218360343);NO試劑盒 (上海勁馬生物科技有限公司, 批號:20170743);NF-κB 和 AP-1激活-核轉運檢測試劑盒 (北京百奧萊博科技有限公司,批號:2180124,201711294);ICAM-1、VCAM-1 和 ET-1 檢測用ELISA試劑盒 (上海信帆生物科技有限公司,批號:XFR31370,XFR31374);FlexStation 3 多功能酶標儀[美谷分子儀器(上海)有限公司)];752N紫外可見分光光度計(上海儀電分析/上海精科)。
1.3 造模及分組 實驗前將直徑為0.22 mm的尼龍釣魚線消毒剪成4 cm長,將一端用細沙布打磨平滑,然后消毒備用。配制10%水合氯醛備用。將丹紅注射液和奈必洛爾均配制成0.1%溶液備用。選取60只體質量相近的SD大鼠進行線栓大腦中動脈willis環缺血45 min后再灌注手術,造模參考文獻[7]執行,術前動物禁食禁水12 h,稱質量后腹腔注射水合氯醛(3.0 mL/kg)麻醉,待大鼠麻醉后固定,用電動剃須刀清理頸胸部鼠毛,碘伏消毒,切開皮膚,分離左側頸總動脈和頸內動脈,延頸內動脈分離進入顱內的翼腭動脈并分別夾閉。然后用眼科剪將左側頸總動脈剪一V形口,將備用的栓線緩慢插入,插入深度約18 mm,或有阻力感為即止,待尼龍栓線進入willis環后,阻斷willis環供血45 min,然后將絲線抽出約10 mm,使willis血液再通。剪去突出在皮膚上的尼龍栓線,使部分尼龍栓線保留在左側頸總動脈中以防止出血,然后縫合創口并消毒。成模標準以大鼠行為學改變為準:1)12 h后大鼠出現左前爪內收,動物行走時向左側偏轉。2)將大鼠提起,出現左前爪內收或不能伸展,動物因此出現步態不穩或轉圈。術后挑選造模成功的36只大鼠隨機均分為模型組、奈必洛爾組和丹紅組,每組12只,另12只未手術的SD大鼠設為對照組作為對照,對照組手術步驟同上,但在分離出左側頸總動脈后不插入栓線造模。
1.4 干預方法 治療前先將丹紅注射液和奈必洛爾配制成0.1%的溶液備用,治療前根據人與實驗動物用藥換算公式,計算丹紅注射液和奈必洛爾的用藥量分別是 5 mg/(kg·d)和 2.5 mg/(kg·d)。 模型組和對照組每只大鼠尾靜脈注射0.9%氯化鈉注射液0.2 mL。奈必洛爾組每只大鼠尾靜脈注射β1受體阻滯劑奈必洛爾0.2 mL。丹紅組每只大鼠尾靜脈注射丹紅注射液0.2 mL。4組均治療14 d。
1.5 標本采集與檢測 治療結束后先采眶靜脈血,再處死動物取willis動脈環編號后凍存。采用硝酸還原酶法檢測血清NO含量(用752N紫外可見分光光度計讀取所測值);雙抗體酶聯免疫吸附試驗(ELISA法)檢測血清ICAM-1含量:檢測時取眶靜脈血0.1 mL,4℃過夜后,1000g離心15 min,取上清檢測。加樣前先設空白孔、標準孔和待測樣品孔,空白孔加標準品樣品稀釋液100 μL,其它分別加標準品或待測樣品100 μL,37℃孵育90 min。倒去孔內液體,加入100 μL生物素抗體工作液,37℃孵育60 min。洗滌3次,加入100 μL酶結合物工作液,37℃孵育30 min。洗滌5次,加入50 μL底物溶液,37℃孵育 15 min。 加入 50 μL終止液,在酶標儀450 nm波長處測量ICAM-1的OD值。然后以OD值為橫坐標,標準品的濃度為縱坐標,繪出標準曲線,由標準曲線查出樣品的相應的實際濃度。NF-κB、AP-1、VCAM-1、IL-10 和 ET-1 參考以上方法嚴格按檢測說明操作。
1.6 統計學處理 應用SPSS13.0統計軟件。計量資料以(±s)表示。先進行方差分析,對于方差齊、正態分布的組間比較采用t檢驗,當方差不齊時組間比較采用校正t檢驗。P<0.05為差異有統計學意義。
2.結 果
2.1 各組 NF-κB、AP-1、ICAM-1和 VCAM-1水平比較 見表1。與對照組比較,模型組靜脈血NF-κB、AP-1、ICAM-1、VCAM-1 和 ET-1 含量均升高 (P<0.05)。奈必洛爾組 NF-κB、AP-1、ICAM-1、VCAM-1 與模型組比較均有一定程度降低(P<0.05)。與模型組和奈必洛爾組比較,丹紅組 NF-κB、AP-1、ICAM-1、VCAM-1均明顯降低(P<0.05)。
表 1 各組 NF-κB、AP-1、ICAM-1 和 VCAM-1 水平比較(±s)

表 1 各組 NF-κB、AP-1、ICAM-1 和 VCAM-1 水平比較(±s)
與對照組比較,*P<0.05;與模型組比較,△P<0.05;與奈必洛爾組比較,▲P<0.05。 下同
組 別 n NF-κB(ng/mL) AP-1(pg/mL)ICAM-1(ng/mL)VCAM-1(pg/mL)對照組 12模型組 12奈必洛爾組 12 4.97±0.24 2.14±0.13 36.01±2.51 17.80±2.29 6.69±0.47* 3.64±0.22* 44.20±5.03* 26.34±1.53*5.10±0.33*△ 3.02±0.10*△ 39.25±2.97*△ 22.37±2.54*△丹紅組 124.76±0.36△▲ 2.35±0.07△▲ 37.14±4.05△▲ 19.30±1.94△▲
2.2 各組NO、eNOs、ET-1及 IL-10水平比較 見表2。與對照組比較,模型組NO、eNOs和IL-10均降低,ET-1升高(P<0.05)。奈必洛爾組NO、eNOs均顯著升高,與模型組比較差異有統計學意義 (P<0.05),但ET-1和IL-10與模型組比較差異無統計學意義 (P>0.05)。丹紅組與模型組比較,NO、eNOs和IL-10均顯著升高(P<0.05)。但丹紅組NO、eNOs與奈必洛爾組比較,無明顯差異(P>0.05),而ET-1降低程度和IL-10升高程度比較,差異均有統計學意義(P<0.05)。
表 2 各組 NO、eNOs、ET-1 及 IL-10 水平比較(±s)
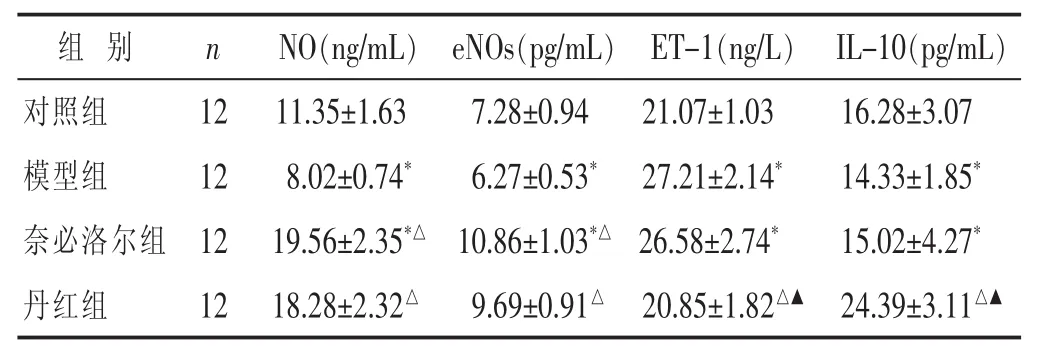
表 2 各組 NO、eNOs、ET-1 及 IL-10 水平比較(±s)
組 別 n NO(ng/mL) eNOs(pg/mL) ET-1(ng/L) IL-10(pg/mL)對照組 12模型組 12奈必洛爾組 12 11.35±1.63 7.28±0.94 21.07±1.03 16.28±3.07 8.02±0.74* 6.27±0.53* 27.21±2.14* 14.33±1.85*19.56±2.35*△ 10.86±1.03*△ 26.58±2.74* 15.02±4.27*丹紅組 1218.28±2.32△ 9.69±0.91△ 20.85±1.82△▲ 24.39±3.11△▲
3 討 論
臨床收治的急性腦梗死患者其起病急驟,且在溶栓治療后常因血液再通而引起嚴重的腦缺血-再灌注損傷,而缺血-再灌注后的氧自由基的產生和清除失衡造成氧化應激反應,這一反應會通過降解細胞外基質、促進內皮細胞凋亡、促進炎癥細胞的生長和遷移并激活轉錄因子AP-1、NF-κB,促進黏附分子ICAM-1,VCAM-1及ET-1過表達而引起血管內皮損傷[8]。急性腦梗死患者患者常因以上級聯反應,使該病病死率和致殘率居高不下,故如何消除“氧化應激”反應,降低腦缺血-再灌注后血管內皮損傷對提高臨床療效具有重要意義。
丹紅注射液提取自中藥丹參和紅花,其中丹參味辛,性涼,主治心腦腹痛,而《藥品化義》記載紅花“味辛性溫”,善通利經脈,因其具有“活血、化瘀、通經、祛瘀、止痛”之功,現臨床上常用于防治心腦血管系統疾病[9-10]。
在本研究中,陽性藥組(奈必洛爾組)尾靜脈注射β1受體阻滯劑奈必洛爾,作為高選擇性的β1腎上腺素受體阻滯劑,奈必洛爾可刺激血管內皮細胞eNOs釋放NO,從而增加血流介導的血管舒張功能,達到降低外周血管阻力和抗氧化應激反應的目的。實驗發現,丹紅組NO、eNOs均顯著升高,且與奈必洛爾組比較差異無統計學意義(P>0.05)。提示丹紅注射液有與陽性藥奈必洛爾相同的藥理作用,可通過提高內皮細胞eNOs活性,促進NO釋放而產生保護損傷內皮的作用,與鄧芬等研究發現丹紅注射液可提高大鼠局灶腦缺血后eNOs含量一致[11]。腦缺血-再灌注后炎癥反應是腦組織損傷的重要機制,而轉錄因子NF-κB和AP-1的激活在炎癥反應中發揮重要轉錄調控作用[12]。ICAM-1、VCAM-1和ET-1也參與炎癥反應,可促進單核細胞、淋巴細胞和中性粒細胞向血管內皮黏附,而這會造成白細胞向炎癥區移行,使白細胞與內皮細胞牢固黏附,造成腦組織微血管阻塞,使炎癥反應加重。ET-1是血管活動的重要調節因子之一,具有強效的調節血管收縮作用,其參與新生血管生成和血管重塑,促進細胞外基質合成,尤其在血栓性疾病的病理改變過程中發揮著重要的調節作用[13]。對心腦血管疾病的預后具有重要意義,高水平ET-1常預示發生血栓性疾病的機會遠高于ET-1正常人群[14]。因此,調控或抑制腦缺血-再灌注時VCAM-1、ICAM-1和 ET-1的表達可減輕腦缺血時的氧化應激反應,降低腦缺血-再灌注損傷的程度。實驗還觀察到丹紅組靜脈血NF-κB、AP-1、ICAM-1、VCAM-1 和 ET-1 均明顯降低 (P<0.05)。提示丹紅注射液通過抑制缺血-再灌注后NF-κB信號通路的激活,減少炎性細胞因子及VCAM-1和ICAM-1的生成,從而減輕腦缺血-再灌注后腦組織繼發性炎癥反應引起的血管內皮損傷,從而發揮對腦組織腦缺血-再灌注損傷的保護作用[15-16]。研究表明,炎癥反應也是腦缺血-再灌注損傷的重要機制之一,IL-10來源于調節性T細胞和Th2,具有抑制Th1細胞應答、抑制巨噬細胞的抗原提呈和合成細胞因子等功能,可促進B細胞分化、增殖及抗體產生,是機體重要的抗炎細胞因子,在腦缺血后發揮著重要的神經保護作用[17]。有學者[18]發現IL-10基因敲除小鼠腦梗死24 h后腦梗死面積和質量均較正常腦缺血-再灌注小鼠高,且在體外模型中,IL-10基因敲除小鼠與來源于野生型小鼠的神經元原代細胞對氧-糖剝奪及興奮性毒性更加敏感;由此得出,不論是外源性IL-10,還是內源性IL-10,在腦缺血-再灌注時均具有神經保護作用[19-20]。本實驗證實丹紅注射液可提高內源性IL-10,這可能是丹紅注射液保護腦缺血-再灌注損傷的重要機制之一。以上諸多觀察結果證實丹紅注射液在治療急性腦梗死時的神經保護功能方面雖無β1受體阻滯劑奈必洛爾強,但可通過多機制發揮缺血-再灌注損傷的保護作用。
綜上所述,丹紅注射液有與β1受體阻滯劑奈必洛爾相同的腦血管內皮損傷保護作用,但其除可提高內皮細胞eNOs及靜脈血NO含量而保護損傷內皮外,還可通過提高內源性IL-10表達,降低VCAM-1和ICAM-1的生成,抑制缺血再灌注后氧化應激造成的血管內皮炎癥性損傷,從而改善血管內皮功能紊亂現象。

