3-硝基-1, 2, 4-三唑-5-酮自催化分解反應特性與熱安全性研究
王凱, 王俊林, 徐東, 郭天吉, 王偉, 涂建
(北京航天長征飛行器研究所, 北京 100076)
0 引言
3-硝基-1, 2, 4-三唑-5-酮(NTO)是一種白色晶體,是近年來受到人們普遍重視的一種高能量密度化合物[1],其密度高達1.93 g/cm3. 它的爆轟能量接近于黑索今(RDX),但感度近似于三氨基三硝基苯(TATB),是一種很有應用前景的低易損性鈍感炸藥。NTO毒性小、原材料價廉易得且容易制備,與其他材料相容性好,有關其合成、性能及應用等方面的研究受到了國外普遍的關注,并得到廣泛應用[2-9]。
Kondrikov等[10]利用波爾登管式壓力計研究了NTO在溫度區間200~260 ℃內的分解反應動力學,結果發現在此區間內其分解反應分為兩個截然不同的階段:快速1階分解和隨后的自催化反應。Greory等[11]利用熱重(TGA)與差示掃描量熱(DSC)試驗方法研究了NTO的分解反應,計算了其活化能和分解反應方程,通過計算得到其分解反應活化能平均值在130~140 kJ/mol之間,在反應的不同階段其活化能不同。
自催化分解反應在含能材料中很常見,由于這類反應容易受到未知的外部影響而被意外引發,并伴隨著熱量的突然釋放,因此十分危險。不同于一般的n級動力學分解反應,自催化反應在發生劇烈反應前,很長一段時間內都不會有明顯的溫升現象,而一旦發生明顯溫升,就會迅速發展成熱爆炸[12]。因此,研究NTO的反應類型及其特性具有重要意義。本文用中斷回歸法[13]研究了NTO的自催化分解特性。瑞士安全技術與保障研究所提出了一種比較有效可靠且具有較高統計學意義的鑒別自催化反應的方法——瑞士方法[14-15]。本文同樣利用該方法研究了NTO的自催化分解特性,同時利用等溫法對上述兩種方法的實驗結果進行了驗證。
1 實驗條件及方法
1.1 實驗樣品與儀器
樣品:NTO,實驗室自制,純度大于99%.
儀器與材料:DSC-1專業型差示掃描量熱儀,瑞士Mettler-Toledo公司生產;坩堝為高壓密封不銹鋼坩堝并配有鍍金墊片[16];吹掃氣與保護氣均為高純氮氣,流量為40 mL/min;所用參比為空的不銹鋼坩堝。
1.2 實驗方法
1)動態DSC實驗。升溫速率分別為2 ℃/min、5 ℃/min、10 ℃/min、20 ℃/min,溫度范圍50~400 ℃.
2)中斷回歸法實驗。步驟1:對待測樣品進行完整的動態DSC實驗,升溫速率為10 ℃/min,得到第1條DSC曲線。從第1條DSC曲線中得到起始反應溫度T0、峰值溫度Tp、放熱量ΔHr等數據,曲線標記為10 ℃/min-1. 步驟2:重新裝樣,在同樣的實驗條件下,升溫至中斷溫度Ts,然后將樣品冷卻。對冷卻后的樣品進行完整的DSC實驗,得到第2條DSC曲線。同樣得到第2條DSC曲線的T0、Tp、ΔHr等數據。如果第2條曲線的T0、Tp低于第1條曲線,則判定其分解反應為自催化反應。為了驗證該方法的可重復性,Ts取3個溫度,得到的不同曲線標記為10 ℃/min-2、10 ℃/min-3、10 ℃/min-4.Ts的取值方法是:對步驟1得到的曲線進行面積積分,得到轉化率α為0.1、0.2和0.3時所對應的反應溫度,此溫度為Ts所取的3個溫度[16]。
3)瑞士方法實驗。取DSC曲線剛剛偏離基線時的溫度T0為開始溫度,q0為開始溫度對應的放熱速率。在T0時轉化率α非常小,可以認為接近于0,因此反應初期的放熱速率可用(1)式表示:
(1)
式中:Eα為表觀活化能(kJ/mol);R為理想氣體常數(kJ/(mol·K));T為反應的溫度(℃)。利用(1)式對物質反應初期的DSC曲線數據進行擬合,得到最大相關系數時的表觀活化能Eα. 當表觀活化能大于220 kJ/mol時,則判定其分解為自催化反應;當表觀活化能小于180 kJ/mol時,則判定其分解為n級反應[12]。需要強調的是,這里的表觀活化能只用來判定物質分解的自催化反應特性,不代表任何意義。
4)等溫DSC實驗。實驗溫度為200 ℃. 當DSC實驗儀器升溫至200 ℃并穩定一段時間后,放入盛有樣品的坩堝,記錄樣品放熱情況。當放熱速率曲線回歸到基線位置時,實驗結束。
2 實驗結果與討論
2.1 DSC動態實驗
NTO在不同升溫速率下的DSC動態曲線如圖1所示,實驗條件及結果如表1所示。從圖1可以看出,隨著升溫速率的升高,NTO的放熱分解峰向高溫方向偏移[16]。在溫升速率分別為2 ℃/min、5 ℃/min、10 ℃/min、20 ℃/min條件下,其起始分解溫度分別為249.4 ℃、260.3 ℃、267.2 ℃、271.2 ℃,峰值溫度分別為251.9 ℃、262.7 ℃、270.8 ℃、276.3 ℃,比放熱量的平均值為2 189.2 J/g.
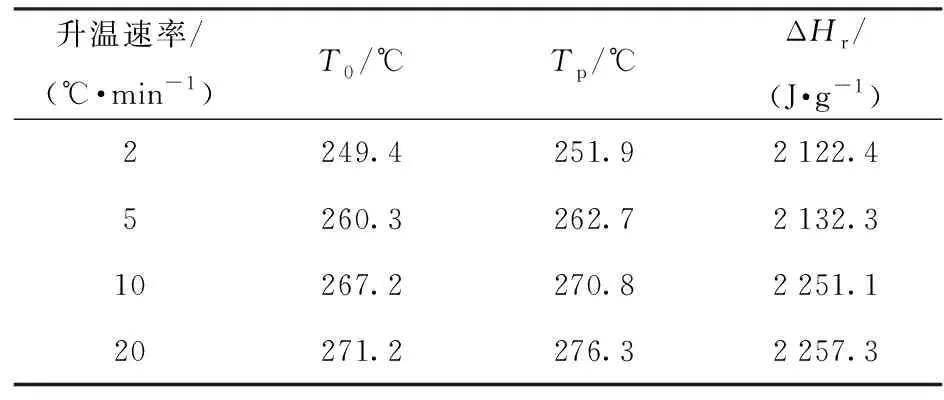
表1 NTO DSC動態實驗條件及結果
由圖1和表1可以看出,NTO放熱峰峰形尖銳,表明其分解反應較為劇烈。NTO熱分解反應曲線的上述特點說明,其分解反應傾向于自催化反應,本文將繼續利用中斷回歸法以及瑞士方法鑒別NTO的反應類型。
2.2 中斷回歸法實驗
為了研究NTO的自催化熱分解反應特性,同時研究熱履歷對NTO熱安全性的影響,應用1.2節中介紹的中斷回歸法對NTO進行研究。本文中Ts取值是根據多次摸索實驗所得到的結果,其具體取值在表2中列出。圖2為該方法得到的DSC曲線,表2為其實驗條件及結果。
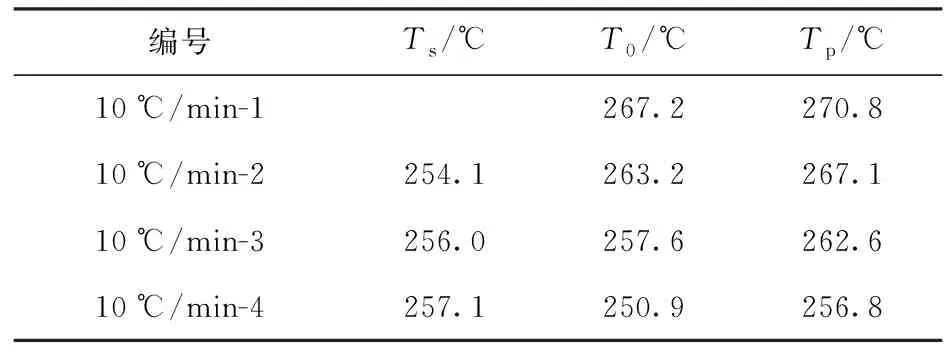
表2 NTO中斷回歸法實驗條件及結果
由圖2及表2可以看出,中斷回歸法步驟2得到的曲線分解放熱峰明顯向低溫方向偏移,且隨著中斷溫度的增大,分解放熱峰向低溫方向的偏移越為嚴重[16]。中斷實驗之后,NTO的DSC曲線起始分解溫度和溫度峰值均降低,在曲線10 ℃/min-4中,T0為250.9 ℃,大大低于中斷之前NTO的T0為267.2 ℃,這意味著其熱安全性降低,即熱履歷顯著降低了NTO的熱安全性。在步驟2中斷實驗之后,NTO部分分解產生了一定量的對分解反應具有催化作用的產物,這些產物將對NTO的熱分解產生促進作用[16]。根據中斷回歸法的判定依據,NTO的熱分解是自催化反應。
上述實驗結果表明,在經歷過熱履歷之后(如發生火災或意外加熱,以及長期貯存),NTO的熱分解特性會發生很大變化,其起始分解溫度大大降低,即其熱安全性會降低。
2.3 瑞士方法實驗
利用瑞士方法實驗對NTO的自催化反應特性進行研究,圖3為該實驗獲得的不同升溫速率下實驗曲線與擬合曲線,表3為該實驗條件及結果。
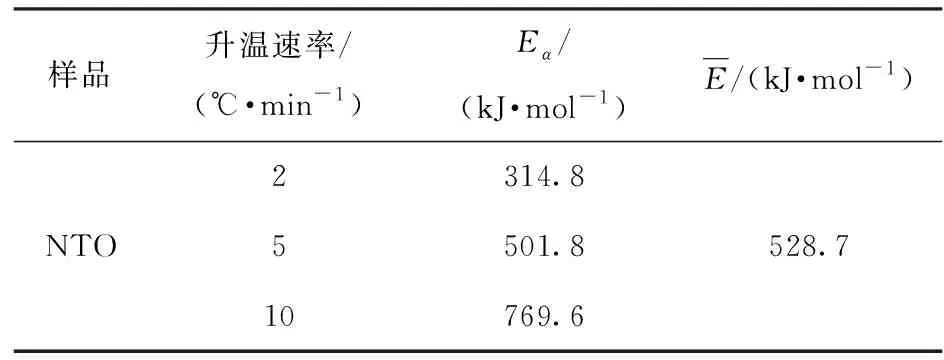
表3 瑞士方法實驗條件及結果
NTO的分解放熱峰都受到熔融吸熱峰的影響。NTO的熔點為262 ℃,與其起始分解溫度接近。對于上述情形,瑞士方法則不適用。因此,本文中只對NTO部分升溫速率下的曲線進行擬合。由圖3及表3可以看出,NTO升溫速率分別為2 ℃/min、5 ℃/min與10 ℃/min時,其實驗曲線的初始階段均得到了很好的擬合,擬合曲線與實驗曲線的相關系數均高于0.99. 在不同升溫速率條件下,NTO擬合曲線的表觀活化能Eα分別為314.8 kJ/mol、501.8 kJ/mol、769.6 kJ/mol,均大于220 kJ/mol,Eα平均值為528.7 kJ/mol. 根據瑞士方法的判定準則,NTO的分解為自催化反應。
2.4 等溫法實驗
等溫DSC實驗可檢測和表征自催化分解:若物質放熱速率隨時間逐漸下降,則說明其分解遵循n級規律;若物質在等溫實驗中出現鐘形放熱速率曲線,則說明這種物質的分解具有自催化特性[17-18]。NTO的DSC等溫實驗結果如圖4所示。由圖4可以看出,NTO的等溫放熱曲線為鐘形曲線,證明其熱分解為自催化反應。圖4中NTO的放熱峰為兩個未完全分離的峰,說明其熱分解并不是單一的反應機理,可能是多種反應的相互耦合[16]。
2.5 動力學曲線與絕熱誘導期
Friedman法[19]同時使用幾條熱分析曲線上同一轉化率α處的數據信息,在不假定動力學模式函數前提下計算出較為可靠的活化能值,從而得到活化能隨著反應進度變化而變化的曲線。Friedman法的動力學方程如(2)式所示。
(2)
式中:β為升溫速率(℃/min);A為指前因子;f(α)為分解反應方程。
圖5為利用熱動力學分析AKTS軟件法求得的Eα與ln[Af(α)]值隨轉化率α的變化情況。
由圖5可以看出,在反應的開始階段,隨著反應的進行,活化能逐漸增大,直至達到最大值,然后其活化能隨著反應的進行又逐漸減小,直至反應結束。這主要是因為NTO的熱分解反應比較復雜,在不同階段其反應類型不同。
TMRa即最大反應速率到達時間,又稱絕熱誘導期,是衡量事故發生可能性的一個重要指標[20]。
本文用Friedman法得到動力學方程結合NTO的熱平衡方程求得其絕熱誘導期相關指標。(3)式為熱平衡方程:
(3)
式中:t為反應時間(s);ΔTa為絕熱溫升(℃)。
在線性升溫實驗中β=dT/dt,(2)式可變形為
(4)
將Eα與ln[Af(α)]代入(4)式,可求得dα/dt在不同轉化率α處的值。將dα/dt與α的關系曲線代入(3)式,得到樣品的溫度歷程dT/dt. 在對反應的熱危險性進行評估時,通常將絕熱誘導期為8 h和24 h對應的溫度T8和T24作為重要指標。本文中用Friedman法得到動力學參數,算出NTO的絕熱溫度歷程,進而得到相應的T8和T24.
本文中計算NTO絕熱溫升時其比熱容cp取1.45 J/(g·K). 圖6為NTO在不同溫度下的絕熱誘導期。
由于計算所用的數據來自不同升溫速率下的DSC曲線,故其比放熱量為一個范圍。圖6中的虛線表示在同一起始溫度下,由比放熱量不同所導致的計算誤差。由圖6可以看出,當絕熱誘導期為8 h時,起始溫度為166.1 ℃,即T8為166.1 ℃. 同理T24為152.1 ℃. 當起始溫度較高如高于T8時,曲線斜率較大,絕熱誘導期在高溫時受溫度的影響較小。當起始溫度較低如低于T24時,曲線斜率較小,絕熱誘導期在低溫時受溫度的影響較大。
NTO的T24值為152.1 ℃,遠遠低于2.1節NTO動態DSC曲線中的起始分解溫度。在溫升速率為2 ℃/min條件下,其起始分解溫度為249.4 ℃. 上述結果說明在NTO的熱安全性評價中,T24是比起始分解溫度更具有參考意義的指標。因為在NTO的貯存過程中,在溫度低于起始分解溫度條件下,如溫度為T24時,其緩慢熱分解釋放的熱量如不能及時傳導到周圍環境中,則在幾小時至幾天之內,其溫度就會失控,發生熱分解或熱爆炸。
綜上所述,在NTO的貯存及應用過程中,要盡量避免NTO處于絕熱環境中,如避免NTO大量堆積式存放。NTO的貯存庫房也應保持通風。在制定NTO的熱防護措施時,其絕熱誘導期(如T24值)是值得重點關注的衡量指標。
3 結論
1)在動態DSC實驗中,NTO的起始分解溫度分別為249.4 ℃、260.3 ℃、267.2 ℃、271.2 ℃,峰值溫度分別為251.9、262.7 ℃、270.8 ℃、276.3 ℃,比放熱量的平均值為2 189.2 J/g.
2)中斷回歸法、瑞士方法以及等溫方法的實驗結果表明NTO的分解反應為自催化反應。
3)在熱分解反應的不同階段,NTO的活化能不同,其絕熱誘導期為8 h和24 h時對應的溫度T8和T24分別為166.1 ℃和152.1 ℃.

