pink1-prkn PARK2通路與線粒體自噬和肝臟急性缺血再灌注損傷的關聯研究
劉樹雄,何 建
(上海東方肝膽外科醫院 急診科,上海200438)
急性肝臟損傷的發病機制有很多種[1],包括多種細胞類型,細胞過程,分子介質和調節因子[2-5]。線粒體損傷和功能障礙在急性肝臟損傷的發病機制中起決定性因素,尤其是肝臟小管上皮細胞的損傷和死亡[6,7]。線粒體自噬是線粒體質量控制的重要機制,通過自噬選擇性去除過量和有缺陷的線粒體。線粒體自噬除去受精卵中精子衍生的線粒體以確保母體線粒體DNA的遺傳,并調整發育紅細胞中線粒體的清除[8-10]。線粒體自噬通過自噬途徑鑒定并標記受損或功能失調的線粒體。在哺乳動物細胞中,線粒體自噬包括調節自噬誘導和受損線粒體激發,從而選擇性自噬識別[11,12]。本研究即探究pink1-prkn PARK2通路與線粒體自噬和肝臟急性缺血再灌注損傷的關聯。
1 材料和方法
1.1動物模型的制作
C57BL/6小鼠(8至10周,雄性)購自中科院上海實驗動物中心(上海,中國)。pink1-KO和park2-KO小鼠按照先前描述得到。將Pink1-KO小鼠與Park2-KO小鼠雜交以產生Pink1Park2 double-KO小鼠。戊巴比妥(50 mg/kg)麻醉后對小鼠進行監測和維持體溫至約36.5℃。通過側面切口暴露肝臟蒂進行雙側夾閉以誘導30分鐘的缺血,釋放夾子進行再灌注。
1.2方法
1.2.1組織病理學 使用DICT-500試劑盒(南京碧云公司)測量血清肌酸酐以檢測肝臟功能。將肝臟組織用4%多聚甲醛固定,包埋在石蠟中,并切成4 μm厚。
1.2.2SP3的免疫組織化學染色 將石蠟包埋的肝臟切片脫石蠟并在65℃和pH6.0條件下用0.1M檸檬酸鈉溫育用于抗原修復,用VECTASTAIN○RABC標準試劑盒(Vector Laboratories,PK-4000)和DAB過氧化物酶底物試劑盒(Vector Laboratories,SK-4100)顯示抗原-抗體復合物的信號。載玻片用DAPI(Sigma-Aldrich,D9542)復染。通過相差顯微鏡檢測陽性細胞染色。
1.2.3干擾RNA轉染 siRNA寡核苷酸的序列如下:PINK1 sI-RNA,5′-ccaggctgggccgcaggaccg;PRKN sI-RNA,5′-ggatcagcagagcattgttca;對照sI-RNA,5′-uucuccgaacgugucacgu。使用Lipofectamine 2000試劑(Thermo Fisher Scientific,11668019),用質粒DNA或RNAi瞬時轉染HK-2細胞。
1.2.4ATP耗竭 HK-2細胞用磷酸鹽緩沖鹽水(137 mM NaCl,2.7 mM KCl,10 mM NaHPO4,and 1.8 mM KH2PO4,pH 7.4)清洗,然后在含20 mM CCCP的無糖RKRB緩沖液(115 mM NaCl,1 mM KH2PO4,4 mM KCl,1 mM MgSO4,1.25 mM CaCl2,25 mM NaHCO3,pH 7.4)中2-6 h誘導ATP耗竭,在正常培養基中恢復2 h模擬再灌注。
1.2.5細胞凋亡分析 根據制造商的說明使用原位細胞死亡檢測試劑盒應用于TUNEL分析。用熒光顯微鏡檢測核DNA碎片的陽性染色。為了定量,從每個組織切片中選擇10個代表性的區域并評估每平方毫米 TUNEL陽性細胞的量。
1.2.6線粒體分離和量化 從肝臟缺血再灌注和假手術對照小鼠收獲肝臟皮質和外髓質,測量線粒體DNA含量。
1.2.7測量HK-2細胞中的線粒體ROS 37℃下HK-2細胞與10 μM DHE在潮濕且黑暗的室中溫育30分鐘,然后用DAPI(Sigma-Aldrich ,D9542)復染。利用共焦顯微鏡獲得熒光圖像。為了量化,使用ImageJ software測定10個隨機光學切片內近端肝臟細胞核中的熒光密度。
1.2.8免疫印跡分析 在SDS-聚丙烯酰胺凝膠上分離,在被轉移到聚偏二氟乙烯膜上后,用5%脫脂牛奶封鎖并用探針探測一抗和辣根過氧化物酶綴合的二抗(Thermo Fisher Scientific,31430和31460)。用增強型化學發光試劑盒(Thermo Fisher Scientific,32106)顯示抗原。ACTB或PPIB用于監測蛋白質加載和轉移。為了定量,利用ImageJ軟件(NIH)分析蛋白質帶。
1.3統計分析
采用SPSS20.0統計軟件;計量資料采用“均數±標準差”表示,組間比較用單因素方差分析,兩兩比較采用LSD-t檢驗;計數資料采用百分率(%)表示,比較采用χ2分析;P<0.05代表差異有統計意義。
2 結果
2.1線粒體吞噬是由HK-2細胞中的ATP耗竭
在免疫印跡分析中,ATP D-R誘導LC3B-Ⅱ的快速增加和SQSTM1(圖1的A-1C)的顯著下降,自體吞噬激活的2個生化標志。ATP D-R期間LC3B-Ⅱ和SQSTM1的變化與線粒體內膜蛋白TIMM23的顯著減少和 TOMM20相關聯(圖1)。
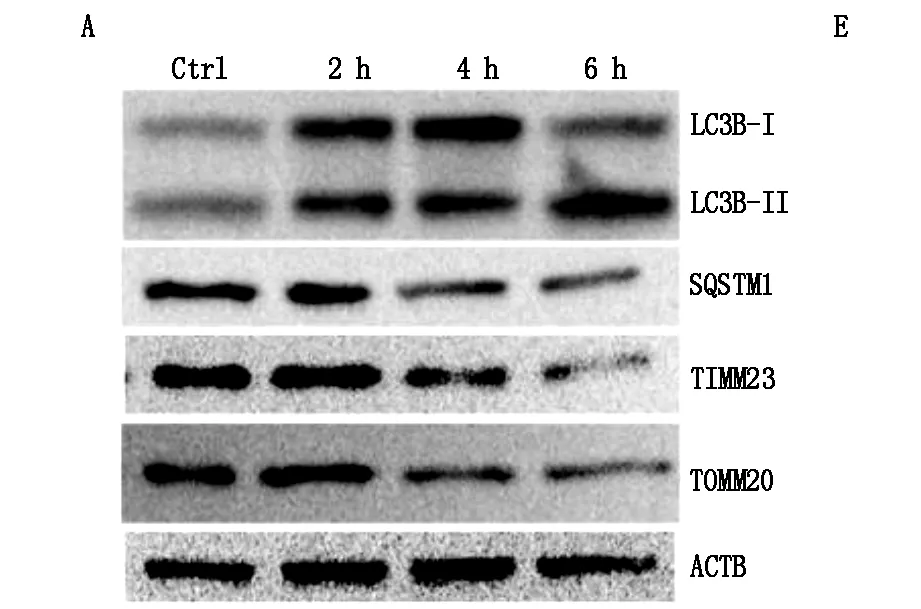
圖1 在HK-2中誘導線粒體自噬以應對ATP耗竭-補充
2.2HK-2細胞中,PINK1和PRKN/PARK2參與ATP耗盡-補充誘導的自噬
針對ATP D-R,HK-2細胞顯示PINK1和PARK2的表達顯著增加(圖2A和2C),這表明PINK1-PRKN/PARK2途徑對ATP D-R反應的肝臟細胞線粒體自噬起關鍵作用(圖2)。

圖2PINK1和PRKN/PARK2參與ATP耗盡-補充誘導的HK-2細胞自噬
2.3PINK1或PRKN的沉默使HK-2細胞對ATP耗竭-補充誘導的細胞凋亡敏感
HK-2細胞中,無論PINK1和PRKN的狀態怎樣,對照條件下的凋亡都是最小(圖3)。
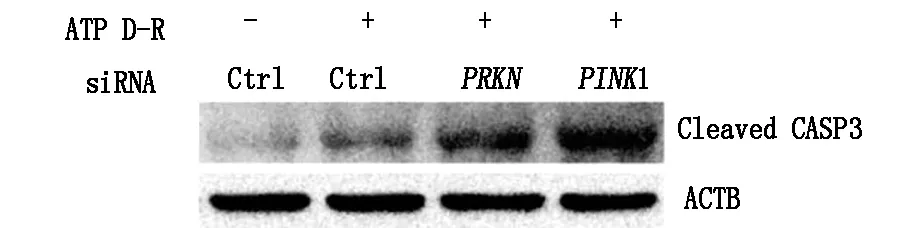
圖3 PNK1和PRKN的沉默使細胞對ATP耗竭誘導的細胞凋亡敏感
2.4肝臟缺血再灌注誘導小鼠近端肝臟細胞的線粒體自噬
收集肝臟皮質組織進行免疫印跡分析,肝臟I-R誘導LC3B-Ⅱ、PINK1和PARK2的顯著增加,伴隨TIMM23和TOMM20的顯著降低(圖4)。
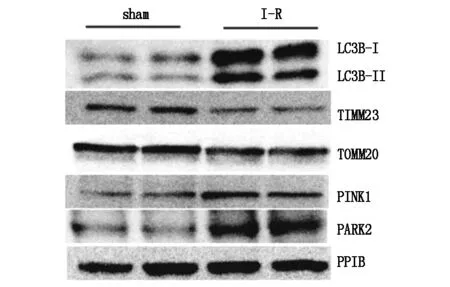
圖4 小鼠腎缺血再灌注后近端腎小管上皮細胞發生線粒體吞噬
2.5肝臟缺血再灌注誘發更嚴重的Pink1和(或)肝臟損傷Park2-缺陷小鼠
活化CASP3的免疫組織化學染色也顯示突變肝臟中活化的CASP3陽性肝臟細胞多于WT肝臟。TUNEL測定和激活的CASP3染色均證明肝臟I-R后pink1和park2單敲除或雙敲除小鼠具有高水平的肝臟細胞凋亡(圖5、圖6)。
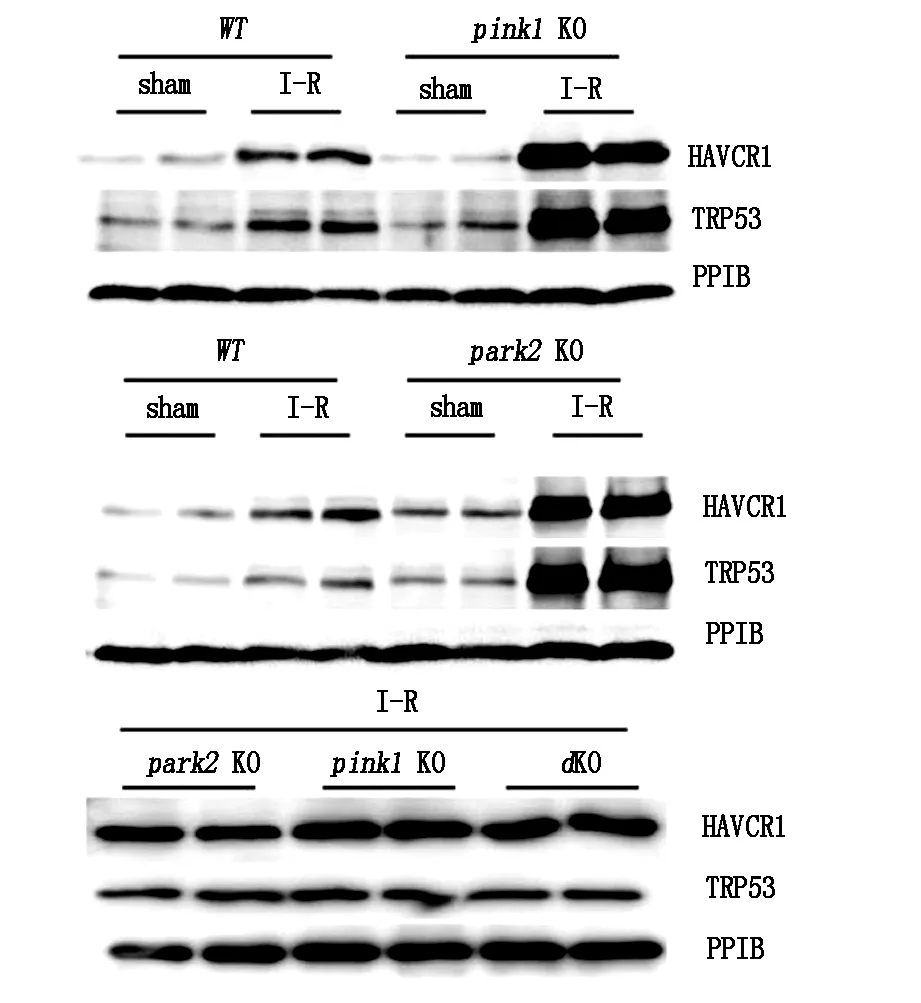
圖5 Pink1和/或Park2缺陷惡化肝臟缺血再灌注引起的肝臟損傷
3 討論
自噬誘導已經在多個急性肝臟損傷實驗模型中得以證實。自噬抑制劑增強急性肝臟損傷而自噬活化劑顯示出保護作用,這表明自噬在該疾病狀態的肝臟保護作用。自噬的保護作用,尤其是對肝臟細胞的保護作用,通過自噬缺陷小鼠模型的測試進一步確定。盡管有這些研究,但細胞自噬是如何保護急性肝臟損傷肝臟細胞仍未可知。目前,該領域至少有兩種思想來解釋自噬的細胞保護作用。第一,自噬和細胞死亡共享信號通路,自噬的激活可能影響細胞死亡。這方面一個很好的例子是BECN1,其通常結合BCL2,但細胞應激時它與BCL2分離開始形成用于自噬的Ⅲ類磷脂酰肌醇3激酶復合物。本研究表明,通過線粒體自噬去除受損的線粒體是自噬提供肝臟保護的重要機制。
PINK1和PRKN/PARK2在介導缺血性急性肝臟損傷肝臟細胞線粒體自噬中的作用。HK-2細胞中PINK1和PRKN的沉默抑制ATP D-R期間的線粒體自噬,但對一般或非選擇性自噬沒有顯著影響,表明RNAi介導的PINK1和PRKN敲除不足以抑制一般自噬。這一結果并不令人意外,因為線粒體自噬是自噬的選擇性形式,需要一種獨特的啟動過程,即ATP D-R期間在肝臟細胞中由PINK1-PRKN/PARK2介導。在PINK1-PRKN/PARK2途徑中,普遍認為PRKN/PARK2介導的MOM上線粒體蛋白質的泛素化對于自噬誘導至關重要。Lazarou等最近的報道認為PINK1可獨立于PARK2直接聚集自噬受體誘導線粒體自噬。相反,Kubli等表示在心肌細胞中,PARK2聚集到線粒體中用于線粒體蛋白泛素化和線粒體自噬,而與PINK1無關。在急性肝臟損傷期間,由于線粒體動力學從融合變為裂變,線粒體在相當數量的肝臟細胞中變成碎片且線粒體碎裂導致肝臟細胞死亡。急性肝臟損傷進展為慢性病理過程中,一些肝臟細胞中持續存在于破碎的線粒體。
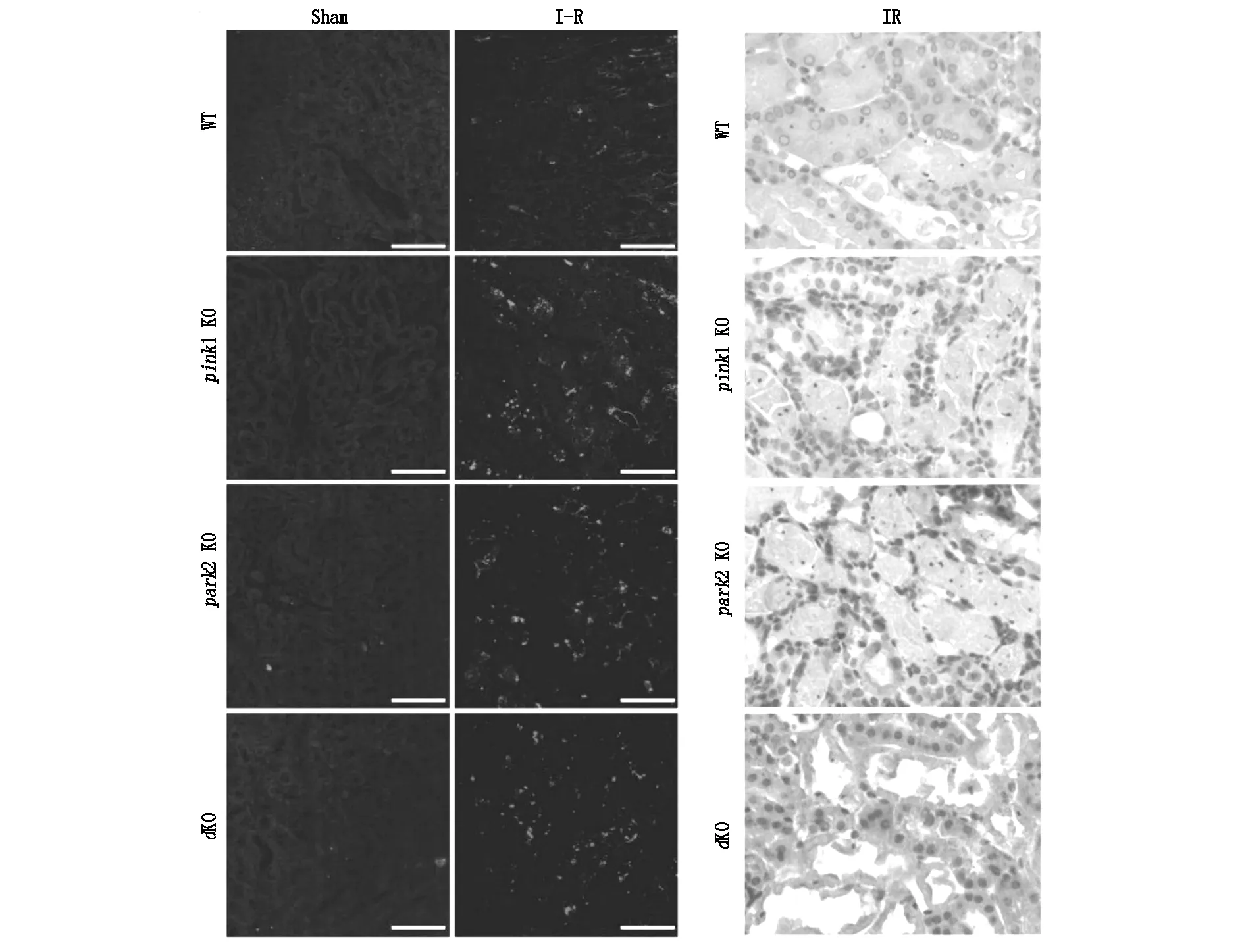
圖6 在肝臟I-R損傷期間, Pink1 和/或 Park2 敲除增加肝臟細胞凋亡。
除了損害細胞能量學之外,受損線粒體可通過產生過量ROS來誘導細胞毒性。盡管pink1和park2單敲除或雙敲除小鼠在肝臟I-R后具有可比較的ROS水平,但park2-KO和pink1 park2-dKO小鼠肝臟組織比pink1- KO小鼠顯示明顯更多的巨噬細胞和嗜中性粒細胞,表明PARK2可能對炎癥有某些額外作用。在這方面,脫離自噬降解的線粒體DNA也可以激活炎癥。因此研究PARK2是否參與線粒體DNA清除和釋放的調節會很有意思。
PINK1和PRKN/PARK2可能具有除線粒體自噬外的其他功能。例如,PINK1和PRKN/PARK2調節線粒體中的囊泡運輸。PINK1還可調節復合物I活性從而參與調節線粒體生物能量學。在先天免疫方面,PRKN/PARK2可促進細胞內細菌病原體的自噬降解。最近發現PINK1和PRKN/PARK2在內毒素和熱應激條件下通過負調節線粒體衍生的囊泡通路來抑制線粒體抗原呈遞。因此,調查PINK1和PRKN/PARK2在肝臟疾病如急性肝臟損傷中與線粒體自噬無關的功能很有意義。
綜上所述,本研究證實了缺血性急性肝臟損傷體外和體內模型中線粒體自噬激活的實質性證據。此情況下的線粒體自噬主要由PINK1-PRKN/PARK2途徑介導。通過清除受損的線粒體,PINK1-PRKN/PARK2介導的線粒體自噬在維持線粒體質量中起重要作用,幫助肝臟細胞存活并從缺血性應激中恢復。此外,及時清除受損線粒體也能減少ROS的產生和炎癥。

