microRNA-200b下調DNMT3A的表達對SD大鼠心肌纖維化抑制作用的機制研究
秦潤禾,陶 輝,倪世豪,代 晨,丁季飛,施 鵬,石開虎
(1. 安徽醫科大學第二附屬醫院心胸外科,安徽 合肥 230601;2. 安徽醫科大學心血管病研究中心,安徽 合肥 230601)
心肌纖維化是多種因素引起的心肌細胞間質出現異常膠原纖維的沉積,是多種心臟疾病發生、發展的重要危險因素及病理基礎[1]。心肌成纖維細胞(cardiomyocyte fibroblasts,CFs) 是纖維化時細胞外基質重要的來源細胞,當CFs被激活增殖,細胞外基質合成分泌增加,進一步促進了纖維化。因此,抑制CFs活化增殖成為抑制心肌纖維化的關鍵點[2]。近年來的大量研究證實,miRNA廣泛參與各類心血管疾病的發生、發展,如心室肥大、心肌纖維化、心肌梗死、心律不齊等[3]。miRNA是一類長為22~23個核苷酸的內源性非編碼小RNA,通過與靶蛋白mRNA 3′端非編碼區的不完全互補結合,抑制mRNA轉錄后靶蛋白的表達[4]。DNA甲基化是指生物體在DNA甲基轉移酶的催化作用下,將甲基轉移到特定堿基上的過程,由此可造成生物體發生胚胎分化、基因失活、器官衰老等現象。DNA甲基化會導致某些區域DNA構象變化,從而影響了蛋白質與DNA的相互作用。其中,DNA甲基化轉移酶3A(DNA methyltransferase 3A,DNMT3A)作為DNA甲基化酶之一,在本課題組前期研究中已顯示其參與心肌纖維化的發生、發展[5-6]。有研究指出,DNA甲基化與miRNA之間存在重要的調控聯系。另有研究顯示,miR-200b可靶向調控DNMT3A,影響非小細胞肺癌的發生、發展[7]。本研究擬通過體內及體外實驗:一方面,構建SD大鼠心肌纖維化模型,檢測miR-200b、DNMT3A,以及反映心肌纖維化的標志性蛋白I型膠原前膠原(collagen type I alpha 1,Col1A1)和α-平滑肌肌動蛋白( α-smooth muscle actin,α-SMA);另一方面,體外培養CFs,通過干擾miR-200b的表達,檢測CFs中DNMT3A的表達及反映心肌纖維化的標志性蛋白Col1A1 和α-SMA的改變情況,旨在探討DNMT3A影響心肌纖維化的過程是否亦受到miR-200b的靶向調控,為探尋新型治療和干預心肌纖維化的有效途徑提供理論依據。
1 材料與方法
1.1材料
1.1.1實驗動物 SD大鼠60只,♂,體質量(140~160) g;SD♂乳鼠80只,出生6~7 d,體質量(20~22) g,均購自安徽醫科大學實驗動物中心,動物合格證號:SCXK(皖)2017-001。
1.1.2試劑 鹽酸異丙腎上腺素(isoproterenol,ISO)注射液(中國西南藥業股份有限公司);DMEM培養基(美國賽默飛公司);胎牛血清(英國Gibco公司);胰蛋白酶(美國WISENT公司);LipofectamineTM2000、TRIzol(美國Invitrogen公司);miR-200b促進劑、抑制劑轉染試劑(上海吉瑪公司);抗Col1A1、α-SMA、DNMT3A、β-actin抗體(北京博奧森生物技術有限公司);MTT相關試劑(上海劍鈍生物科技有限公司)。
1.1.3儀器 Multiskan FC酶標儀、細胞培養箱、PCR儀(美國Thermo Fisher Scientific公司);高速冷凍離心機(德國Eppendorf公司);Western blot顯影及相關設備(美國Bio-Rad公司);超凈工作臺(蘇州泰安空氣技術公司);HAD-K5600超微量分光光度計(北京恒奧德科技有限公司)。
1.2方法
1.2.1SD大鼠心肌纖維化模型的建立 60只SD♂大鼠適應性喂養1周后,開始實驗。大鼠隨機分為2組:ISO組30只,取0.5% ISO,按每天6 mg·kg-1的劑量腹腔注射1周,構建大鼠心肌纖維化模型;正常組(30只)腹腔注射同等劑量0.9%生理鹽水1周作為對照。于實驗末2 d開始禁食、禁水12 h后,大鼠稱重,處死大鼠,并取5 mm3心臟標本進行石蠟包埋,再將蠟塊連續切片10張,HE和Masson染色法檢測其病理學改變;qRT-PCR檢測各組miR-200b表達;Western blot法測定α-SMA、Col1A1、DNMT3A的表達量。
1.2.2SD乳鼠原代CFs的分離與培養 取出生6~7 d的新生乳鼠,燒杯裝載入超凈臺,另備75%乙醇。先用高壓蒸汽滅菌的鑷子以頸部脫臼法處死乳鼠,后在乙醇中浸泡1 min左右。用碘伏消毒胸腹部,無菌眼科剪先橫后縱呈倒T字型剪開胸腔,取心尖部位,并快速置于含雙抗預冷的PBS溶液潤洗3~5次。剔除周圍多余結締及脂肪組織,將心臟放置于無菌平皿上,剪成約1 mm3大小,向皿中加入少許胰酶,在37℃培養箱中消化,共消化6~8次,每次約5 min。每次消化后取上清液,并加入等量的含10%胎牛血清的DMEM培養基,緩緩混勻,以終止胰酶消化。用200目細胞篩過濾含細胞的混合液,最后將過濾后的細胞懸液150×g離心5 min。離心后收集沉淀,加入適量PBS再次重復離心3次。用上述CFs培養基將細胞沉淀重懸,接種于細胞培養瓶中培養。培養約90 min后,將未貼壁的細胞懸液吸棄,此時已經貼壁的是CFs,通過倒置顯微鏡觀察加以確認。加5 mL培養基,放入培養箱,繼續培養至細胞融合至80%~85%時傳代,連續傳至4代后的細胞用于后續實驗。
1.2.3瞬時轉染miR-200b促進劑、抑制劑 培養原代CFs至對數生長期,加入胰酶消化并吹勻細胞懸液。然后,按每孔2 mL把細胞接種至6孔板內并分組。放入37.5℃、5% CO2細胞培養箱中,繼續培養至細胞融合度達到70%~80%用于轉染。吸取10 μL的miR-200b促進劑及抑制劑分別緩緩注入已加有10 μL LipofectamineTM2000的Opti-MEM(1 mL)中,用移液槍上下吹勻多次,室溫下靜置30 min,形成microRNA和Lipofectamine復合物。將6孔板取出,吸棄原培養基,用PBS清洗細胞2次,再將復合物混合液注入事先已分組的6孔板中。然后把6孔板放進細胞培養箱中,2 h后倒掉混合液,加入含雙抗的DMEM培養基,繼續培養24~96 h后,用于進一步實驗。
1.2.4轉染細胞RNA的提取和qRT-PCR檢測CFs中miR-200b的表達 取出轉染48 h后含CFs的6孔板,按TRIzol法提取細胞RNA,紫外分光光度法檢測細胞RNA的濃度和純度,選用反映RNA純度的A260/A280數值為1.8~2.0的樣品用于實驗。采用GenePharma HairpinitTMmicroRNA RT-PCR Quantitation Kit v1406試劑盒,并參考使用說明書檢測miR-200b。先將樣品RNA逆轉錄成cDNA。反應條件如下:25℃、30 min,42℃、30 min,85℃、5 min。然后按試劑盒說明書加樣,通過qRT-PCR檢測不同轉染組中miR-200b表達。反應條件:95℃、10 min為預變性階段;95℃、12 s,62℃、40 s,并循環40次為擴增階段;95℃、15 s,60℃、1 min,95℃、15 s為熔解曲線階段。以U6作為內參,2-ΔΔCT法計算miR-200b的相對表達量以驗證轉染是否成功。
1.2.5qRT-PCR檢測Col1A1、α-SMA、DNMT3A 取出轉染48 h后含CFs的6孔板,按TRIzol法提取細胞RNA,方法同“1.2.4”。按TaKaRa試劑盒說明書,將樣品RNA逆轉錄成cDNA,再通過qRT-PCR檢測3種目的基因。反應條件:50℃、2 min,95℃、10 min為預變性階段;95℃、20 s,60℃、30 s,72℃、30 s,共40個循環為擴增階段;95℃、15 s,60℃、1 min,95℃、15 s為熔解曲線階段。以β-actin作為內參,2-ΔΔCT法計算mRNA的相對表達量。引物序列見Tab 1。

Tab 1 Primer sequence
1.2.6Western blot法檢測轉染細胞中目的蛋白表達 取出轉染48 h后含CFs的6孔板,用蛋白裂解液提取轉染后CFs的總蛋白,檢測蛋白濃度,分組標記,加入樣品緩沖液99℃加熱2 min。凝膠上樣,每孔加入20~40 μg蛋白。電泳,轉膜,用5%牛奶封閉膜2 h,TBST洗滌6 min×4次,加入稀釋的Col1A1、α-SMA和 DNMT3A 一抗,4℃孵育過夜,TBST漂洗4次,加入相應二抗37℃搖床孵育1~3 h,再用TBST漂洗4次,而后采用ECL法,以β-actin為內參檢測目的蛋白的相對表達量。
1.2.7MTT比色法檢測CFs的增殖 取不同轉染的細胞,計數調整細胞濃度至1×108·L-1,分別接種在96孔板中,每孔100 μL,設5個復孔。96孔板放入細胞培養箱中分別培養24、48、72、96 h,不同時間點的96孔板分別取出,每孔加入10 μL 5 g·L-1的MTT溶液,繼續培養4~6 h后終止。小心吸棄孔中培養液,加入150 μL DMSO,搖床上低速振蕩10 min,使結晶產物溶解充分后,使用酶聯免疫檢測儀檢測490 nm處各孔的吸光度值。

2 結果
2.1ISO皮下注射導致SD大鼠心肌纖維化心臟樣本的病理學改變Fig 1心臟組織的HE和Masson染色結果顯示,與正常組比較,ISO組SD大鼠HE染色片中心肌細胞間質增加,且排列紊亂,心肌細胞呈現肥大狀態,并能發現成纖維細胞有所增生,Masson染色可見心肌組織間膠原纖維增多。
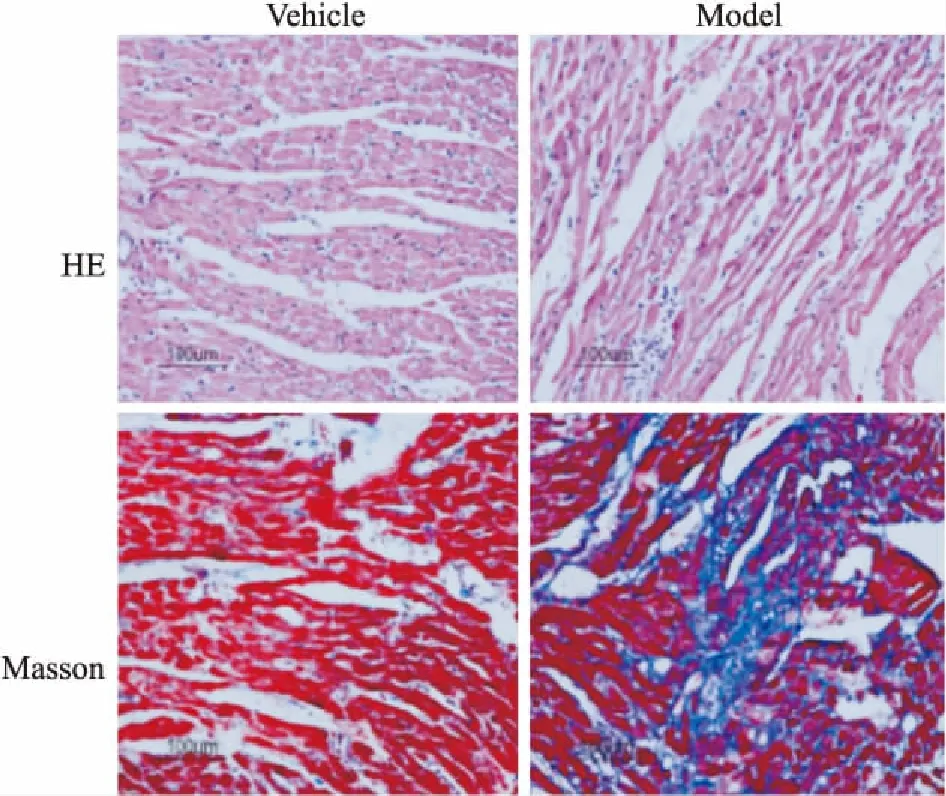
Fig 1 HE and Masson staining
2.2SD大鼠心臟樣本中miR-200b表達的變化Fig 2的qRT-PCR結果顯示,相較于正常組,ISO組心臟標本提取的總RNA中miRNA-200b表達水平明顯下降,差異有統計學意義(P<0.05)。
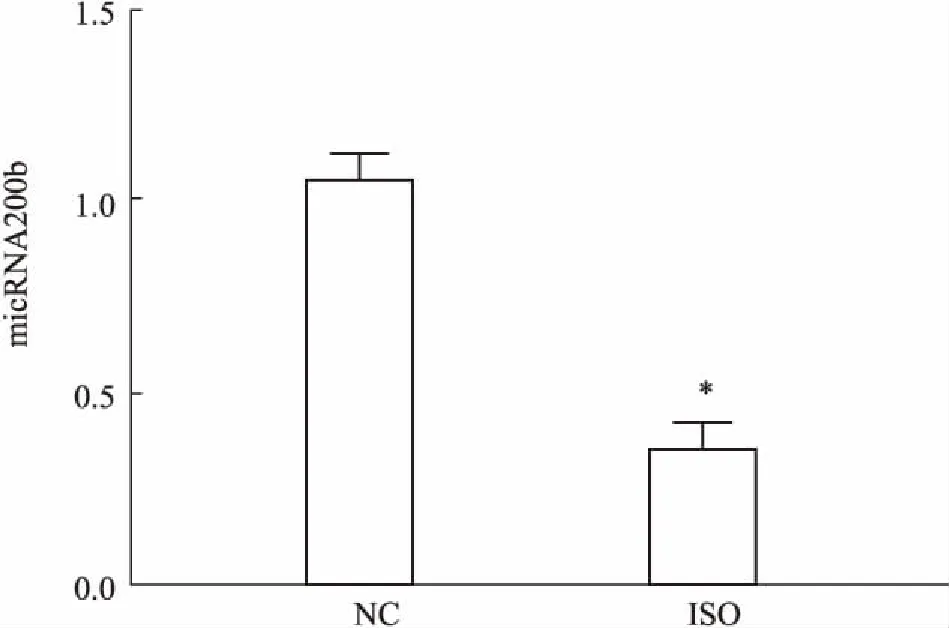
Fig 2 Level of miR-200b in SD rat myocardium by
*P<0.05vsNC group
2.3ISO組和對照組SD大鼠心臟樣本中α-SMA、Col1A1、DNMT3A表達變化Fig 3的Western blot結果顯示,ISO組中α-SMA、Col1A1、DNMT3A蛋白表達水平相較于正常組明顯升高(P<0.05)。

Fig 3 Expression of α-SMA, Col1A1 and DNMT3A in SD rat myocardium by Western blot n=6)
*P<0.05vsNC group
2.4瞬時轉染miR-200b抑制劑和促進劑對miR-200b表達的影響瞬時轉染CFs miR-200b抑制劑、促進劑及其空白對照組48 h后,Fig 4的qRT-PCR結果顯示,轉染miR-200b促進劑組中,CFs中miR-200b表達量明顯升高(P<0.01),miR-200b抑制劑組中miR-200b表達量減少(P<0.01),表明轉染成功。
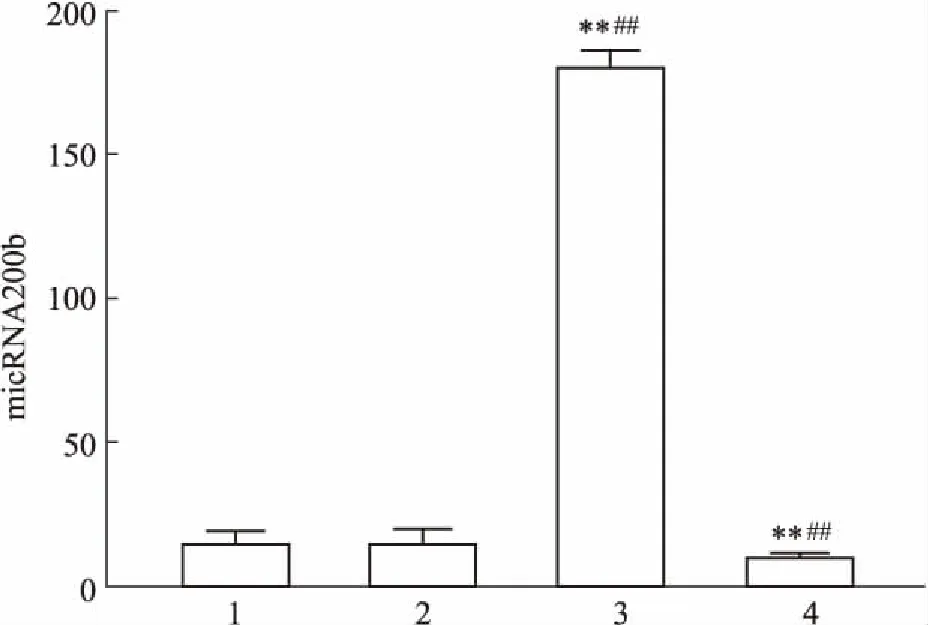
Fig 4 Change of miR-200b in CFs 48 h
1: Negative group; 2: Blank group; 3: miR-200b mimics group; 4: miR-200b inhibitors group.**P<0.01vsblank group;##P<0.01vsnegative group.
2.5miR-200b對CFs中Col1A1、α-SMA、DNMT3AmRNA表達的影響瞬時轉染48 h后,Fig 5的qRT-PCR結果顯示,miR-200b促進劑實驗組中Col1A1、α-SMA和 DNMT3A的表達下降(P<0.01);而miR-200b抑制劑組中Col1A1、α-SMA和 DNMT3A的表達上升(P<0.01)。
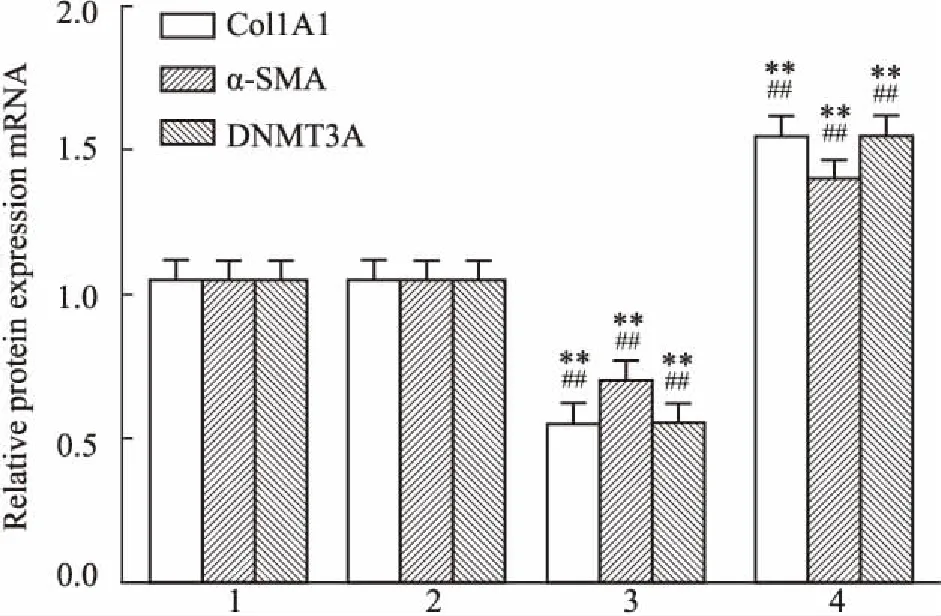
Fig 5 Alteration of gene expression in CFs 48 h
1: Negative group; 2: Blank group; 3: miR-200b mimics group; 4: miR-200b inhibitors group.**P<0.01vsblank group;##P<0.01vsnegative group.
2.6miR-200b對CFs中Col1A1、α-SMA和DNMT3A蛋白表達的影響Fig 6結果顯示,miR-200b抑制劑轉染之后,DNMT3A、α-SMA和Col1A1蛋白表達均較陰性對照組和空白對照組明顯升高(P<0.01)。而促進劑組中DNMT3A、α-SMA和Col1A1蛋白表達量均較陰性對照組和空白對照組明顯降低(P<0.05)。

Fig 6 Levels of Col1A1, α-SMA and DNMT3A in transfected CFs by Western blot n=6)
**P<0.01vsblank group;##P<0.01vsnegative group
2.7miR-200b對CFs增殖的影響如Fig 7所示,在轉染CFs 24、48、72、96 h后,與陰性對照組和空白對照組比較,miR-200b促進劑組的CFs增殖水平明顯降低(P<0.01),而miR-200b抑制劑組中CFs增殖水平明顯上升(P<0.01)。
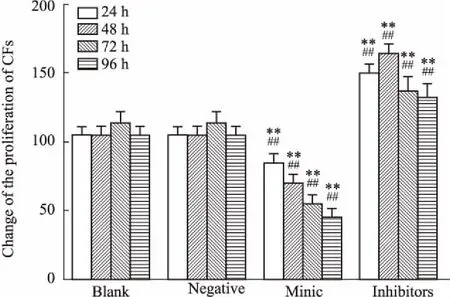
Fig 7 Change of proliferation of CFs 24, 48, 72, 96 h after transfection in all groups n=6)
1: Negative group; 2: Blank group; 3: miR-200b mimics group; 4: miR-200b inhibitors group.**P<0.01vsblank group;##P<0.01vsnegative group.
3 討論
心肌纖維化是指正常的心臟心肌組織結構中出現了以CFs增殖、細胞外基質沉積過量為主要病理表現的疾病。目前研究表明,心肌纖維化與心律失常(如房顫)、心功能不全、心肌肥厚等疾病有關[8-9]。近年有研究顯示,DNA片段的甲基化是可以促進纖維細胞分化為成纖維細胞和膠原沉積[10-11]。而之前另有研究顯示,DNMT3A作為DNA片段的甲基化催化酶家族中的重要一員,其表達程度的激活與抑制,對心肌纖維化發揮著關鍵作用[5-6]。
近年來,大量研究報道miR-200b參與多種疾病發生、發展過程[12-13],但關于miR-200b在心肌纖維化中的研究卻并不多見。有研究表明,同樣作為miR-200家族中的一員miR-141可參與影響心肌纖維化的發生、發展[14]。因此,本課題進一步研究 DNMT3A與miR-200b在心肌纖維化發生發展中的分子機制。
本實驗分別通過建立心肌纖維化動物模型,以及向CFS轉染miR-200b的促進劑和抑制劑來證實之前提出的假設。在體實驗結果表明,與對照組比較,模型組HE和Masson染色心肌組織呈現明顯的膠原沉積; qRT-PCR顯示;模型組相對于對照組miR-200b表達水平降低,Western blot檢測表明,模型組α-SMA、Col1A1、DNMT3A的水平明顯高于對照組。體外實驗結果表明,與正常對照組和陰性對照組比較,促進劑組DNMT3A、Col1A1、α-SMA mRNA表達下降,而在抑制劑組上升;Western blot結果顯示,促進劑組中DNMT3A、Col1A1、α-SMA蛋白表達降低,而在抑制劑組表達上升;MTT結果表明,miR-200b可抑制CFs生長。故本課題組推測心肌纖維化的產生可能與miR-200b對 DNMT3A調控有關。
綜上所述,miR-200b可能是通過抑制DNMT3A,對CFs甲基化產生影響,控制CFS的活化,降低心肌纖維化水平。而DNMT3A可能是心肌纖維化的表觀遺傳學治療靶點之一,同時也為預防和研究心肌纖維化產生提供新的思路。