慢性低氧狀態對腎小球足細胞高通量鈣激活鉀通道表達和功能的影響*
張蕊,張威,劉國建,鮑運霞
(哈爾濱醫科大學附屬第二醫院 腎內科,黑龍江 哈爾濱 150086)
慢性低氧是各種腎臟疾病進展至終末期腎臟病(end stage renal disease, ESRD)的共同途徑[1-2]。以往的研究大多關注低氧引起的腎小管間質損害,卻較少提及腎小球的低氧性損傷。最近的研究表明腎小球足細胞的低氧性調節可能引起足細胞裂孔蛋白CD2AP等水平下降,足細胞骨架蛋白F-actin重組,并參與腎小球硬化的發展[3-4]。足細胞是腎小球濾過屏障的關鍵組成部分,能通過改變足突間裂隙膜的孔徑調節腎小球濾過率,足細胞損傷可引起腎小球濾過率下降和蛋白尿產生[5-6]。已有研究證實,低氧條件下足細胞內低氧誘導因子(hypoxia induced transcription factor,HIFs)水平升高,通過調控足細胞重要功能基因的轉錄改變細胞的結構和功能[4-7]。此結果提示慢性低氧可能通過足細胞調節機制參與腎小球損傷和硬化的發展[7],但是其具體機制尚不清楚。
高通量鈣激活鉀通道(簡稱BK通道)是最早發現的氧敏感性離子通道之一[8-9],在可興奮性細胞中,BK通道低氧性抑制引起細胞膜去極化,激活電壓依賴式鈣通道,導致大量Ca2+內流,引發細胞的低氧適應性改變,從而參與多種組織細胞的低氧性調節[10-12]。本研究組設想BK通道參與足細胞低氧的適應性調節。為證明這項假設,筆者觀察了低氧對人類足細胞BK通道表達和功能的影響,同時對低氧狀態下BK通道調節的可能機制進行探討。
1 材料與方法
1.1 研究對象
由于腎小球足細胞為終末分化細胞,只有分化完全后才能行使正常生理功能,因此研究組選擇條件永生性人類足細胞系作為研究對象。此類細胞系特殊轉入了溫度敏感性基因,在33℃培養時處于增殖狀態,轉入37℃培養后無需改變培養基成分即停止增殖并開始分化。繼續培養11~14 d足細胞可達完全分化,具有類似人類足細胞的生理結構和功能。
1.2 實驗材料
RPMI 1640(美國HyClone公司),胰島素、轉鐵蛋白及亞硒酸鈉混合液(insulin, transferrin and sodium selenite, ITS)(美國 Sigma公司),10% FBS(美國HyClone公司)。cDNA轉錄試劑盒(美國ABI公司),SYBR Green PCR Master Mix體系(美國ABI公司),ABI PRISM 7500系統(美國ABI公司)。BCA蛋白測定試劑盒(美國Pierce公司),BK通道α、β3和β4亞基抗體(英國Abcam公司)或actin抗體(美國Santa Cruz公司),羊抗兔IgG或羊抗鼠IgG的熒光二抗(美國Invitrogen公司),Odyssey infrared成像系統(美國Li-COR公司)。電生理實驗的所有試劑(美國Sigma公司),倒置顯微鏡(日本Nikon公司),電極拉制儀P-97(美國Sutter公司),Axo-patch 200B系統(美國Axon公司),Digidata 1440A interface系統(美國Axon公司),pClamp 10.2軟件(美國Axon公司),Graphpad prism 5軟件(美國GraphPad公司)。
1.3 方法
1.3.1 細胞培養、低氧處理及實驗分組 條件永生性人類足細胞系增殖及分化所需培養基成分包括RPMI 1640,ITS和10% FBS,其中ITS能夠促進足細胞的增殖及分化,為培養所必需。可根據實驗設計將分化完全的足細胞分為3組,分別置于正常氧氣濃度(21% O2)和低氧條件(10%或2% O2)的孵箱中進行培養[8,13-15]。正常氧濃度孵箱內氣體成分為21% O2,5% CO2,其余由N2補充。低氧孵箱內氣體成分為10%或2% O2,5%CO2,其余由N2補充。在培養的第6、12、24和48 h逐步取出各組細胞,分別進行PCR檢測,Western blot檢測和膜片鉗實驗,測定各組細胞BK通道α、β3及β4亞基基因和蛋白的表達水平,同時記錄BK通道開放電流,比較各組細胞在常氧和低氧條件培養不同時間點BK通道表達和功能狀態,觀察低氧條件對足細胞BK通道表達和功能的影響,從而為慢性腎臟病引起的腎小球缺氧狀態和足細胞缺氧性BK通道功能調節提供理論依據。另取兩組常氧濃度培養并分化完全的足細胞,分別加入二甲基烯丙基氧甘氨酸(DMOG,1 mmol/L)或氯化鈷(CoCl2,100μmol/L),制作化學缺氧模型,測定BK通道亞基和蛋白表達水平,記錄通道電流,比較其與常氧對照組細胞BK通道功能和表達的不同。另取兩組常氧培養的足細胞,在放入低氧孵箱前分別向培養液中加入還原劑谷胱甘肽乙酯(GSH,1 mmol/L)或過氧化氫酶(Catalase,200 u/ml),比較其與低氧培養組細胞BK通道亞基表達和功能的不同,分析其是否參與氧化應激機制。
1.3.2 Real-time PCR 將10μl的反應混合物放入逆轉錄系統中。這個過程所使用的RNA總量為0.5 mg,并應用高效能cDNA逆轉錄試劑盒進行cDNA的初始合成。所有的real-time PCR實驗都應用SYBR Green PCR Master Mix體系,并在ABI PRISM 7500系統中完成。BK通道蛋白基因的引物序列如下,KCNMA1正向引物:5'-AACCCGCCCTATGAGTTTG-3',反向引物:5'-GGATGGGATGGAGTGAACAG-3';KCNMB3正 向引物:5'-GAGAGGACCGAGCCGTGAT-3',反向引物:5'-CACCACCTAGCAGAGTCAGTGAAG-3';KCNMB4正向引物:5'-GCGTTCTCATTGTGGTCC-3',反向引物:5'-TTCCAGTTGTGCCTGTTTC-3'。擴增后的成分由ABI Prism genetic analyzer進行分析。
1.3.3 Western blot 分化完全的足細胞用冰PBS液沖洗后,經3000 r/min離心10 min,放入含有1%蛋白酶抑制劑的溶液中用于蛋白提取。細胞裂解產物需在冰上培養15 min,之后以13500 r/min離心15 min。用BCA蛋白測定試劑盒對總蛋白含量進行定量分析。隨后蛋白樣本需進行10% SDS PAGE凝膠電泳,分離后的蛋白質轉至硝酸纖維素膜上。轉膜后將硝酸纖維素膜在室溫下用5%脫脂奶封閉2 h,隨后選擇合適的一抗進行孵育:BK通道α、β3和β4亞基抗體(1︰200)或actin抗體(1︰500)。沖洗后將硝酸纖維素膜與羊抗兔IgG或羊抗鼠IgG的熒光二抗(1︰10000)進行培養。最后使用Odyssey infrared成像系統對條帶吸光度進行分析。
1.3.4 電生理記錄 BK通道電流以全細胞模式進行膜片鉗記錄,微電極使用毛細硅硼玻璃管在電極拉制儀P-97上拉制完成,所有實驗均在室溫(20~22℃)下進行。在全細胞記錄模式下,細胞內液成分為15 mmol/L KCl,130 mmol/L K aspartate,1 mmol/L MgCl2,10 mmol/L EGTA,10 mmol/L Hepes及5.76 mmol/L CaCl2(游離Ca2+濃度200 nmol/L);用KOH調節pH值至7.2。標準浴液成分包括145 mmol/L NaCl,4.5 mmol/L KCl,1 mmol/L MgCl2,2 mmol/L CaCl2及 10 mmol/L Hepes;用NaOH調節pH值至7.4。傳代在5~15代之間的完全分化足細胞用于檢測。細胞的鉗制電壓設定為-60 mV,記錄電壓在-80~+80 mV之間波動時通道電流的變化。每20 mV記錄1次,每次記錄時間為700 ms。電流由Axo-patch 200B系統放大并經1 kHz頻率濾波后,通過Digidata 1440A interface系統進行在線記錄。最后應用pClamp 10.2軟件獲取數據并進行分析。電導率數據以G/Gmax表示且符合Boltzmann方程。
1.4 統計學方法
數據分析采用SPSS 16.0、Photoshop及Graphpad prism 5統計軟件,計量資料以均數±標準差(±s)表示,多組間的比較采用單因素方差分析,兩組比較采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 BK通道電流的確定
通道的反轉電位約為-60 mV,接近K+平衡電位(細胞內外的K+濃度分別為145.0和4.5 mmol/L)。將細胞內Ca2+濃度由200 nmol/L提高至5μmol/L時,通道的外向電流水平明顯增加(見圖1A)。在細胞外液中加入非選擇性K+通道阻斷劑TEA(5 mmol/L)后,+80 mV電壓下的電流水平下降至41%;加入選擇性BK通道阻斷劑Penitrem A(100 nmol/L)[16]后,通道電流下降至29%(見圖1B)。由此證實誘發的通道電流完全由BK通道開放所引起。見表1~3。
2.2 慢性低氧對足細胞BK通道電流的抑制
低氧條件(2%O224 h)下,足細胞BK通道在+80 mV電壓刺激下的電流水平由(14.45±2.06)pS下降至(4.78±1.12)pS,差異有統計學意義(P<0.05),且足細胞的活性無明顯變化。見圖2A、2B及表4。
2.3 慢性低氧上調足細胞BK通道β4亞基mRNA及蛋白表達對α和β3亞基表達的影響
低氧條件(2% O224 h)下足細胞BK通道β4亞基mRNA(B4)水平升高,而α和β3亞基mRNA(A1和B3)表達無明顯變化(見圖3A)。β4亞基mRNA自低氧6 h起開始升高,低氧12~24 h達峰值,在低氧48 h時有所下降。與基因表達情況類似,低氧條件下(2% O224 h)BK通道β4亞基表達增加(見圖3B和表 5)。
2.4 氧化應激反應參與低氧誘導的BK通道β4亞基表達上調
細胞培養液中加入DMOG(1 mmol/L)或CoCl2(100 μmol/L)孵育24 h并未明顯改變BK通道β4亞基mRNA的表達(見圖4A)。低氧條件下細胞外液中加入還原劑谷胱甘肽乙酯(GSH,1 mmol/L)或過氧化氫酶(Catalase,200 u/ml)明顯降低低氧引起的β4亞基mRNA水平升高。見圖4B和表6、7。
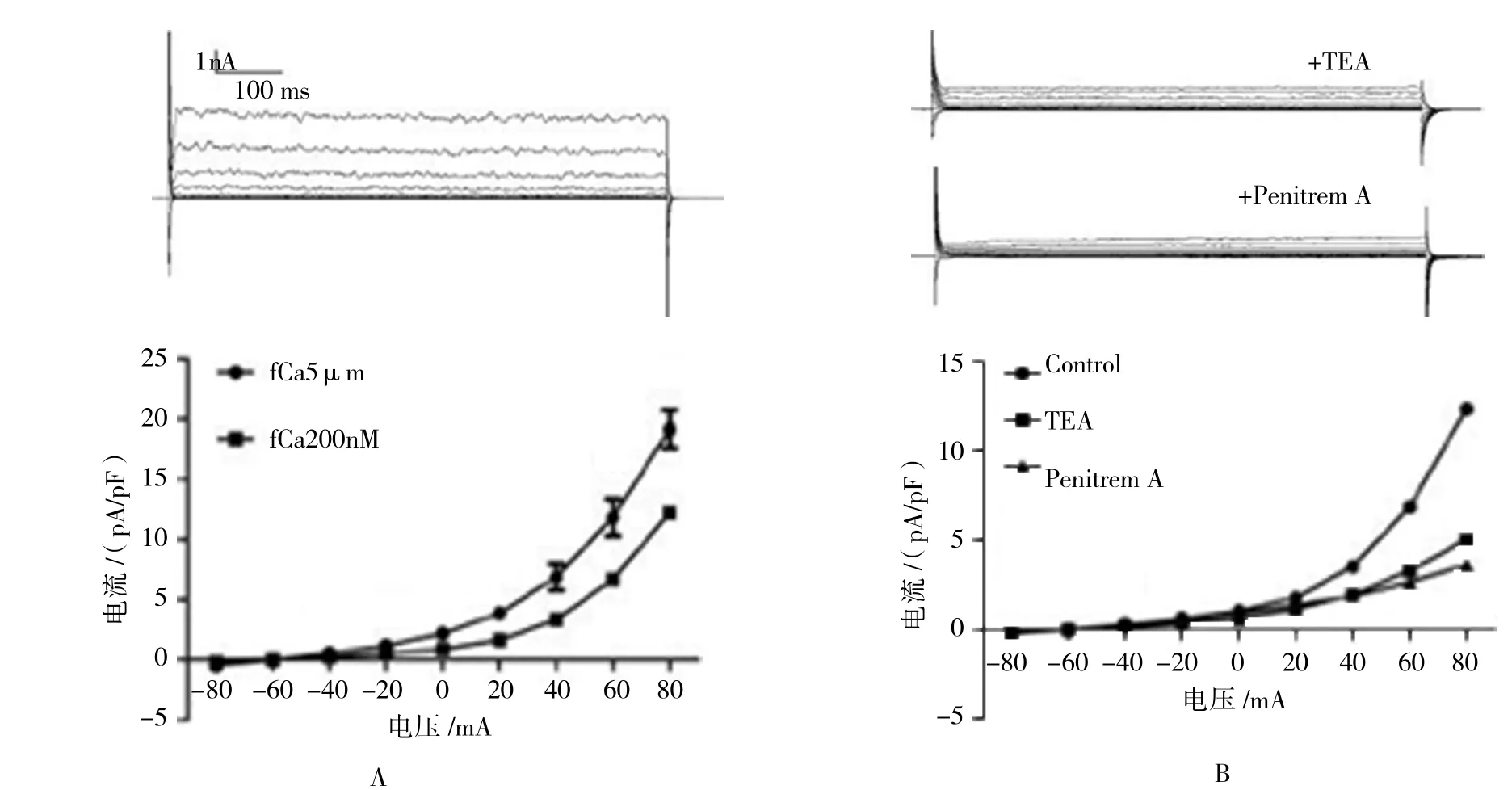
圖1 人類腎小球足細胞BK通道電流的記錄
表1 不同游離鈣濃度對BK通道電流的影響 (±s)
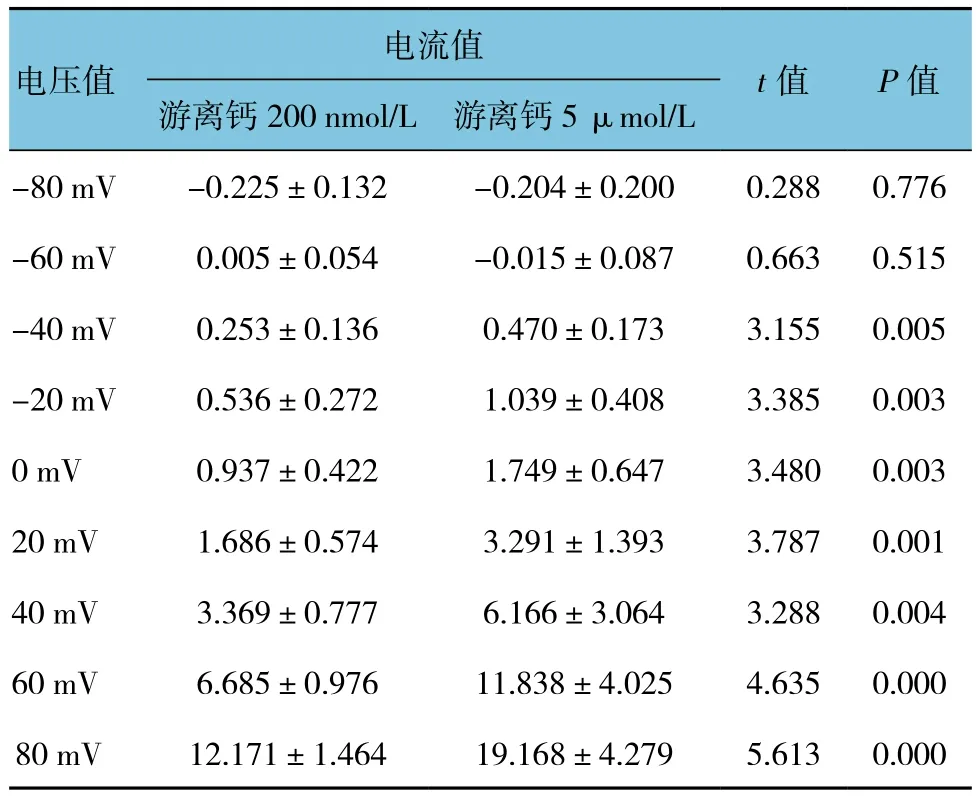
表1 不同游離鈣濃度對BK通道電流的影響 (±s)
電流值電壓值t值 P值游離鈣200 nmol/L 游離鈣5 μmol/L-80 mV -0.225±0.132 -0.204±0.200 0.288 0.776-60 mV 0.005±0.054 -0.015±0.087 0.663 0.515-40 mV 0.253±0.136 0.470±0.173 3.155 0.005-20 mV 0.536±0.272 1.039±0.408 3.385 0.0030 mV 0.937±0.422 1.749±0.647 3.480 0.00320 mV 1.686±0.574 3.291±1.393 3.787 0.00140 mV 3.369±0.777 6.166±3.064 3.288 0.00460 mV 6.685±0.976 11.838±4.025 4.635 0.00080 mV 12.171±1.464 19.168±4.279 5.613 0.000
表2 TEA對BK通道電流的影響 (±s)
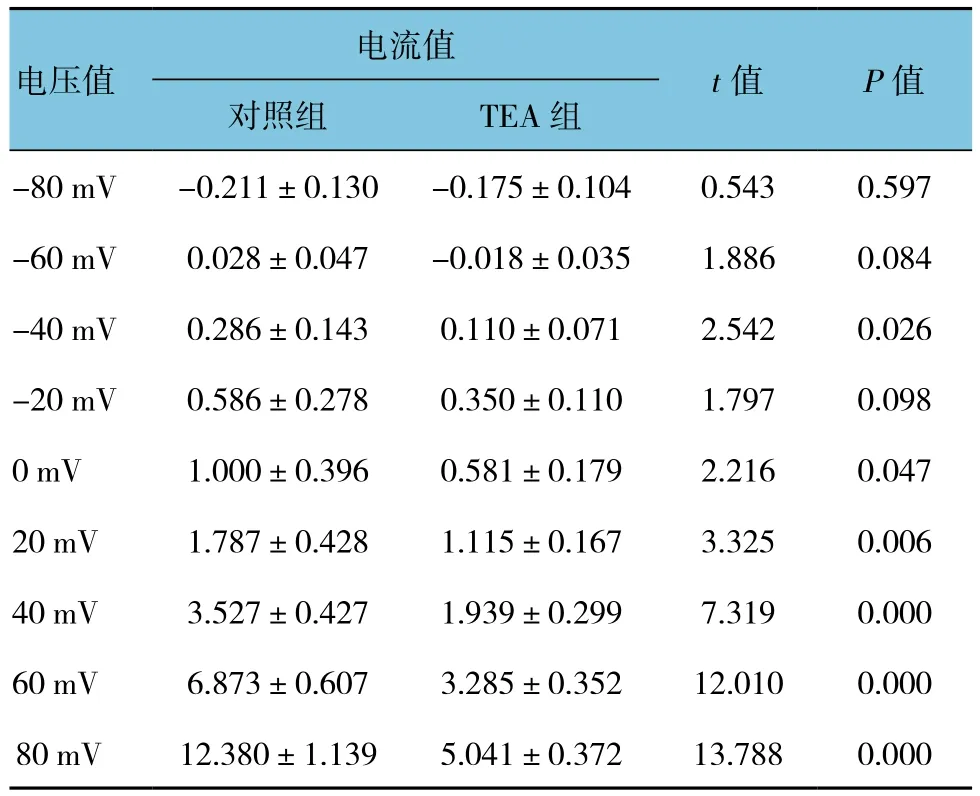
表2 TEA對BK通道電流的影響 (±s)
電流值電壓值t值 P值對照組 TEA組-80 mV -0.211±0.130 -0.175±0.104 0.543 0.597-60 mV 0.028±0.047 -0.018±0.035 1.886 0.084-40 mV 0.286±0.143 0.110±0.071 2.542 0.026-20 mV 0.586±0.278 0.350±0.110 1.797 0.0980 mV 1.000±0.396 0.581±0.179 2.216 0.04720 mV 1.787±0.428 1.115±0.167 3.325 0.00640 mV 3.527±0.427 1.939±0.299 7.319 0.00060 mV 6.873±0.607 3.285±0.352 12.010 0.00080 mV 12.380±1.139 5.041±0.372 13.788 0.000
表3 Penitrem A對BK通道電流的影響 (±s)
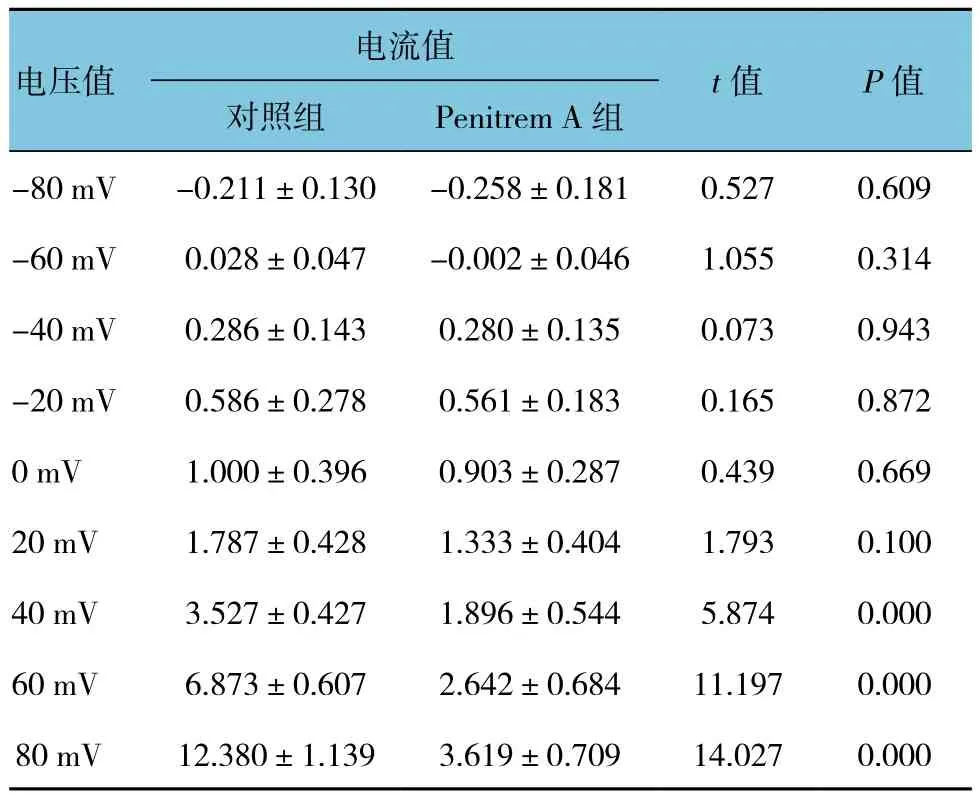
表3 Penitrem A對BK通道電流的影響 (±s)
電流值電壓值t值 P值對照組 Penitrem A組-80 mV -0.211±0.130 -0.258±0.181 0.527 0.609-60 mV 0.028±0.047 -0.002±0.046 1.055 0.314-40 mV 0.286±0.143 0.280±0.135 0.073 0.943-20 mV 0.586±0.278 0.561±0.183 0.165 0.8720 mV 1.000±0.396 0.903±0.287 0.439 0.66920 mV 1.787±0.428 1.333±0.404 1.793 0.10040 mV 3.527±0.427 1.896±0.544 5.874 0.00060 mV 6.873±0.607 2.642±0.684 11.197 0.00080 mV 12.380±1.139 3.619±0.709 14.027 0.000
表4 低氧對足細胞BK通道電流的影響 (±s)
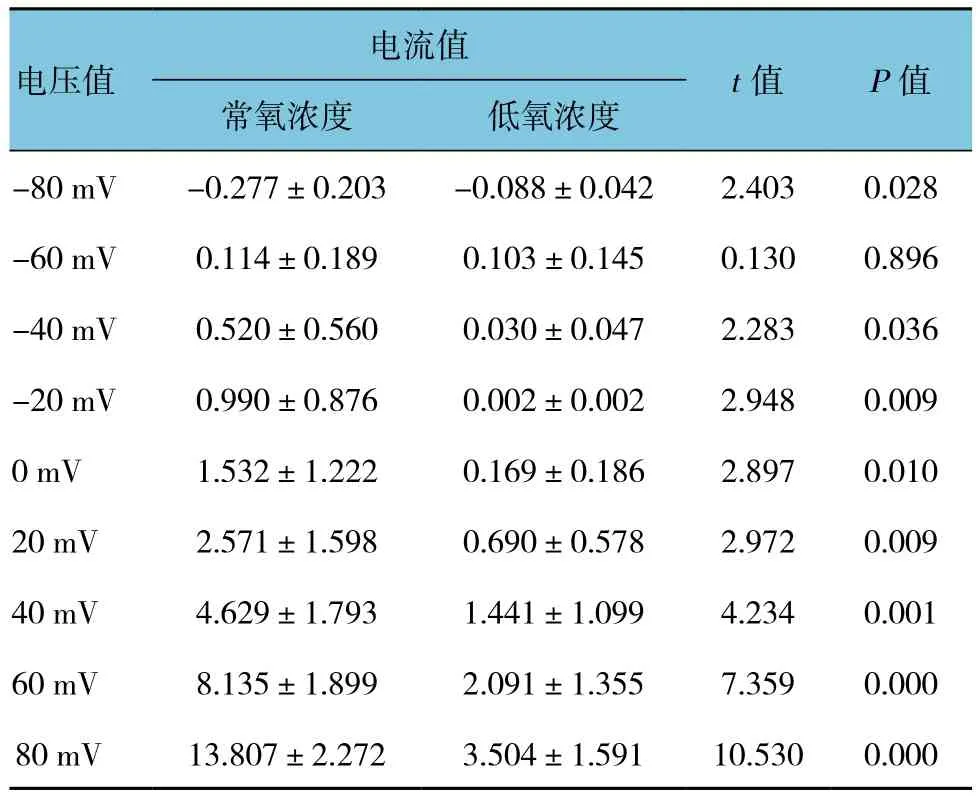
表4 低氧對足細胞BK通道電流的影響 (±s)
電流值電壓值t值 P值常氧濃度 低氧濃度-80 mV -0.277±0.203 -0.088±0.042 2.403 0.028-60 mV 0.114±0.189 0.103±0.145 0.130 0.896-40 mV 0.520±0.560 0.030±0.047 2.283 0.036-20 mV 0.990±0.876 0.002±0.002 2.948 0.0090 mV 1.532±1.222 0.169±0.186 2.897 0.01020 mV 2.571±1.598 0.690±0.578 2.972 0.00940 mV 4.629±1.793 1.441±1.099 4.234 0.00160 mV 8.135±1.899 2.091±1.355 7.359 0.00080 mV 13.807±2.272 3.504±1.591 10.530 0.000
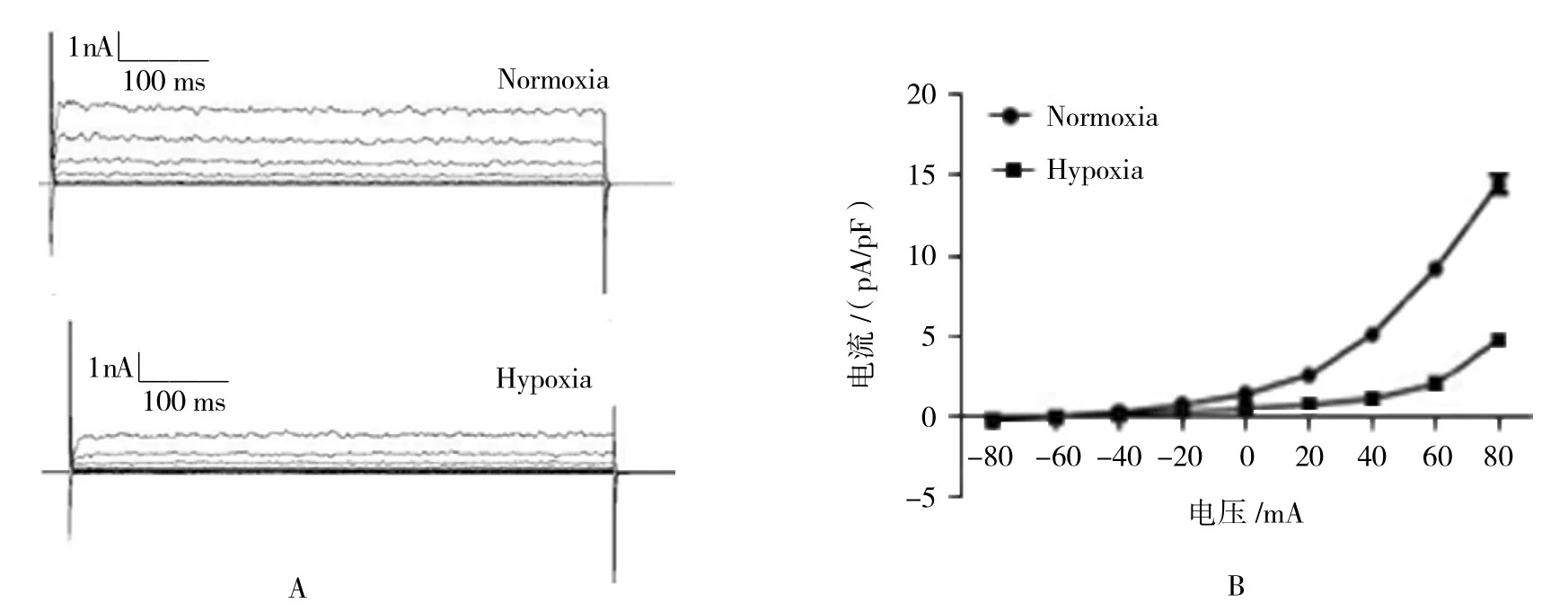
圖2 慢性缺氧抑制人類腎小球足細胞BK通道電流
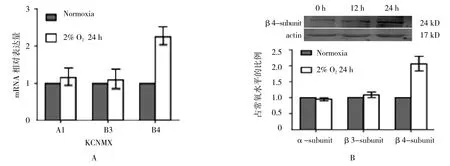
圖3 慢性缺氧對BK通道亞基mRNA和蛋白表達的影響
表5 慢性缺氧對BK通道亞基mRNA和蛋白表達的影響(±s)
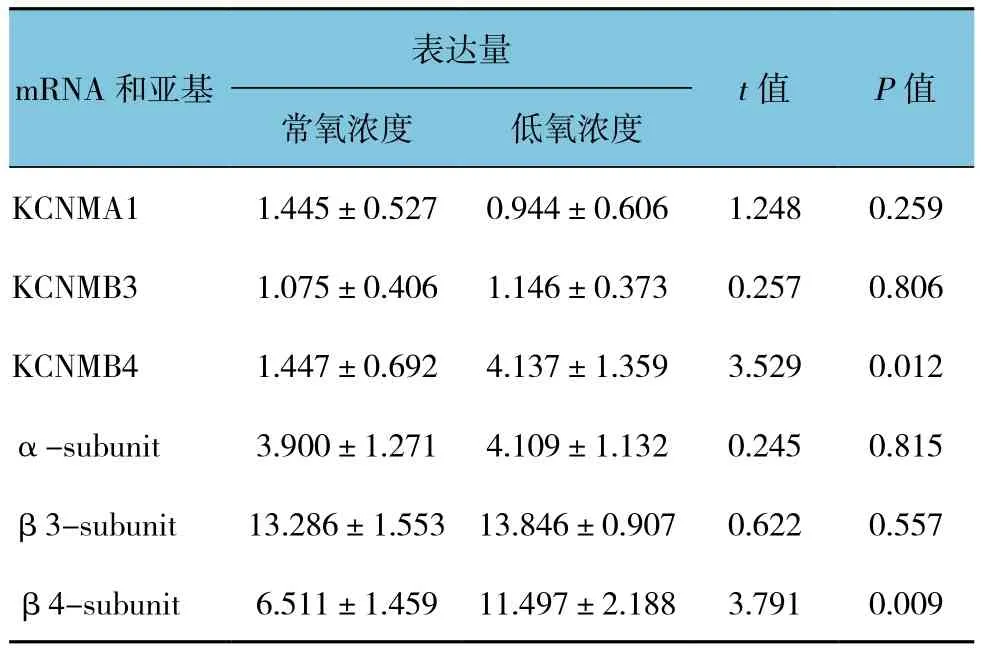
表5 慢性缺氧對BK通道亞基mRNA和蛋白表達的影響(±s)
表達量mRNA和亞基t值 P值常氧濃度 低氧濃度KCNMA1 1.445±0.527 0.944±0.606 1.248 0.259 KCNMB3 1.075±0.406 1.146±0.373 0.257 0.806 KCNMB4 1.447±0.692 4.137±1.359 3.529 0.012 α-subunit 3.900±1.271 4.109±1.132 0.245 0.815 β3-subunit 13.286±1.553 13.846±0.907 0.622 0.557 β4-subunit 6.511±1.459 11.497±2.188 3.791 0.009
表6 DMOG和CoCl2對β4亞基mRNA表達的影響(±s)
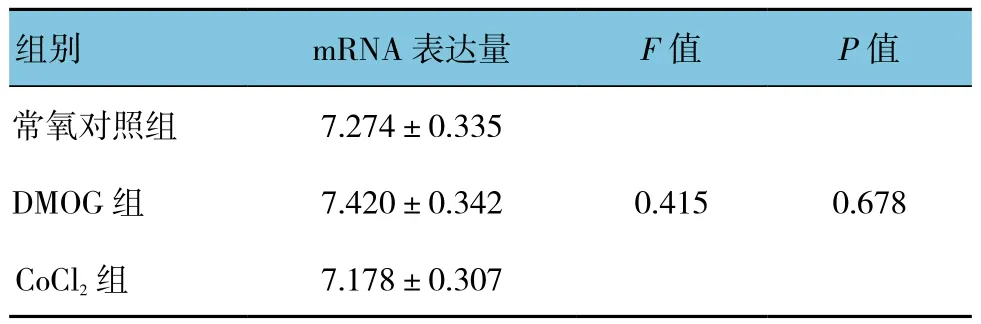
表6 DMOG和CoCl2對β4亞基mRNA表達的影響(±s)
組別 mRNA表達量 F值 P值常氧對照組 7.274±0.3350.415 0.678 DMOG組 7.420±0.342 CoCl2組 7.178±0.307
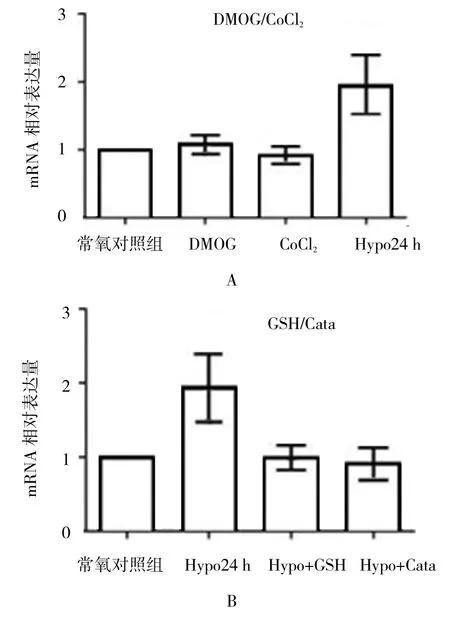
圖4 氧化應激反應參與缺氧誘導的β4亞基mRNA表達上調
表7 GSH和Cata對β4亞基mRNA低氧性上調的影響(±s)
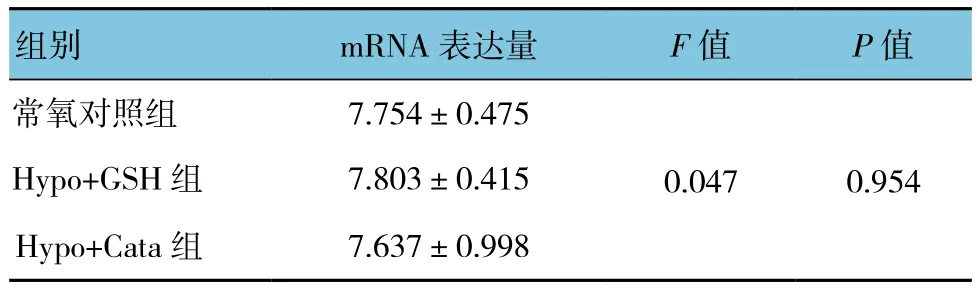
表7 GSH和Cata對β4亞基mRNA低氧性上調的影響(±s)
組別 mRNA表達量 F值 P值常氧對照組 7.754±0.4750.047 0.954 Hypo+GSH組 7.803±0.415 Hypo+Cata組 7.637±0.998
3 討論
足細胞低氧性損傷在腎小球疾病的進展中具有重要作用[6]。BK通道被認為是參與低氧反應的關鍵角色。大多數組織中BK通道表現為低氧性功能抑制,如頸動脈體、動脈平滑肌細胞、中樞神經元和心肌細胞等。在這些組織細胞中,缺氧性BK通道抑制引起細胞膜去極化,從而激活電壓依賴式鈣通道,繼而導致大量Ca2+內流,引發細胞的缺氧適應性改變。本研究表明在腎小球足細胞中,低氧可引起BK通道功能抑制,電流水平明顯降低。
BK通道主要由成孔α亞基和調節性β亞基構成。目前為止已經克隆出哺乳動物BK通道的4種β亞基,β1~β4亞基分別由相應的KCNMB 1~4所編碼。人類足細胞BK通道由α、β3及β4亞基組成。本研究分子生物學結果表明慢性缺氧環境可以引起足細胞BK通道β4亞基mRNA和蛋白表達水平上調,而對BK通道的成孔α亞基和調節性β3亞基的表達無明顯影響,提示低氧可能通過上調β4亞基表達抑制足細胞BK通道功能。此結果與腦組織中的BK通道低氧性調節類似[17]。神經元的β4亞基被認為是BK通道的“下調因子”,可以使通道激活電壓向去極化方向移動,減慢BK通道的激活動力學過程。同樣在心肌細胞和動脈平滑肌細胞中β亞基也參與了低氧誘導的BK通道活性抑制[17-19]。因此,研究結果提示低氧通過上調β4亞基表達抑制足細胞BK通道功能。同時本研究組還發現用還原劑GSH和Catalase預處理的足細胞顯著降低低氧誘導的BK通道β4亞基表達上調,提示ROS激活參與了足細胞BK通道β亞基表達的低氧性調節。以上數據提示慢性缺氧對β4亞基表達的影響至少發生在轉錄水平[20]。幾乎所有的細胞類型對于慢性缺氧(數小時至數天)的適應性反應都依賴于影響多種基因表達水平的轉錄機制。然而對于影響BK通道重塑過程(包括亞基的翻譯、裝配、轉運,以及以上過程的組合形式)的多種機制還不清楚。
雖然本研究組的結果表明低氧對α亞基表達無明顯影響,但是許多其他研究提示α亞基參與BK通道的低氧性調節。BK通道α亞基的羧基端上具有血紅素結合保守序列,可以與血紅素直接結合[21-22]。另外,BK通道α亞基與血紅素加氧酶2(HO-2)相關聯,HO-2使血紅素在有氧條件下與NADPH細胞色素P450還原酶結合產生一氧化碳NO。NO可以直接提高原位和重組BK通道的活性。而低氧條件降低了NO的有效性,從而導致通道關閉。因此HO-2被認為是BK通道的酶聯氧感受器[20,23]。與酶聯機制不同,BK通道也可以被細胞內Ca2+濃度的瞬間變化(Ca2+火花)激活。Ca2+火花可以使肌槳網內的Ca2+濃度以微摩爾的級別增加,從而迅速達到激活BK通道的水平[24]。對腦動脈平滑肌細胞[25]和穩定表達BK通道α亞基和β亞基的HEK293細胞[26]進行內面向外式膜片鉗記錄發現,在不添加任何酶類底物的情況下,缺氧以細胞內Ca2+依賴的模式抑制BK通道活性。這些數據提示缺氧通過非膜限制機制減少Ca2+火花和BK通道的有效耦聯,進而引起BK通道活性抑制。但是也有人提出BK通道對氧濃度敏感性的保持是由于在通道蛋白羧基端的壓力調節性外顯子中有一段高度保守的富含半胱氨酸的序列[10]。本研究中低氧對足細胞BK通道α亞基表達無明顯影響,可能與筆者檢測的通道蛋白為細胞總蛋白有關。因此本研究組將進一步測定細胞膜BK通道α亞基的表達,從而明確其在足細胞缺氧性調節中的作用。

