苯酚加氫反應器模擬和工藝條件優化
鄒芳蓉 ,李 濤 ,蔣立立 ,張海濤 ,房鼎業
(1.華東理工大學 大型工業反應器工程教育部工程研究中心,上海 200237;2.華東理工大學 煤氣化及能源化工教育部重點實驗室,上海 200237)
環己酮是重要的有機化工原料[1],是制備己內酰胺和己二酸的主要中間體[2],也可作為優良的工業有機溶劑[3-7]。目前世界上現有的環己酮生產工藝主要有三種:環己烷液相氧化法[8]、環己烯水合法[9]和苯酚加氫法[10]。其中,苯酚氣相加氫制環己酮不僅工藝操作簡單、轉化率和收率高,而且能耗低、三廢少。隨著國內苯酚裝置的建設,苯酚法制環己酮的優勢逐步顯現,研究價值和研究意義也逐漸體現。
苯酚氣相加氫反應是放熱反應,國外已有較成熟的反應器工藝[11-14]。常規的苯酚氣相加氫反應裝置多選用固定床絕熱反應器多級串聯的方式[15-16]。等溫管式反應器也是很好的選擇,可以通過外載熱體隨時移除反應熱,并可持續維持較高的選擇性和產率。現階段我國關于苯酚加氫催化劑的研究很多[17-22],但是與其對應的反應器開發及模擬計算的研究很少,還需通過計算反應器內苯酚加氫的反應規律來對反應器的設計進行指導。
本工作主要對管式反應器內苯酚氣相加氫的反應情況進行了模擬計算。采用換熱管式反應器一維擬均相數學模型,通過Runge-Kutta法求解數學模型,在模擬工況條件下用Matlab軟件對反應器內的溫度和濃度分布規律進行了模擬計算,考察了苯酚加氫工藝條件變化的影響,為反應器設計和生產過程分析等提供依據。
1 數學模型
1.1 反應系統分析和物料衡算
苯酚氣相加氫反應系統主要發生以下反應:
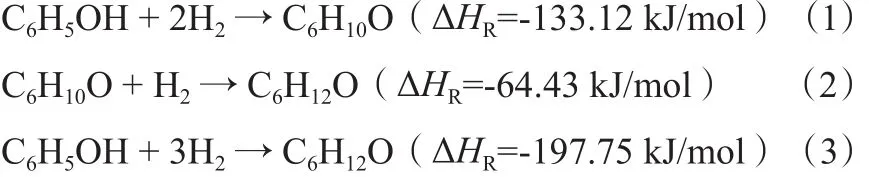
反應體系中獨立反應數為2,在物料衡算和熱量衡算中選取反應(1)和(2)為獨立反應,產物環己酮和環己醇為關鍵組分。物料衡算見表1。

表1 物料衡算Table 1 Material balance
由物料衡算得出的一維擬均相微分方程組見式(4)~(7)。
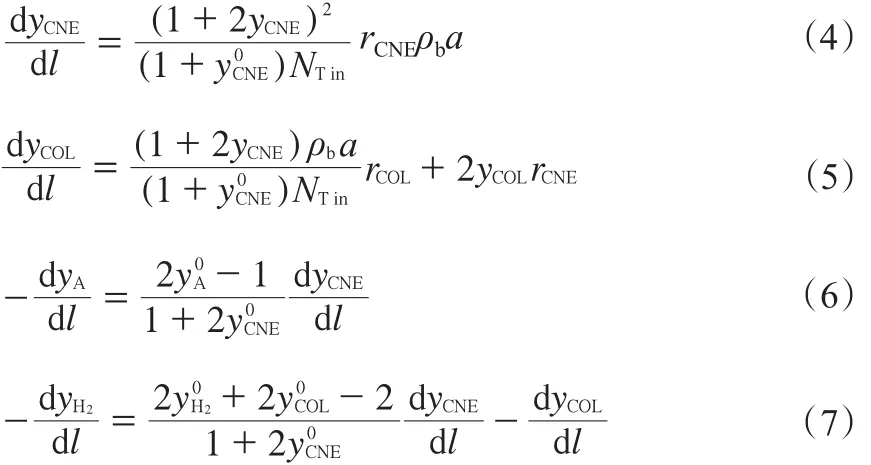
1.2 熱量衡算
通過對床層高度為dl的微圓柱體進行熱量衡算,可得到反應溫度隨床層高度變化的微分方程,見式(8)。
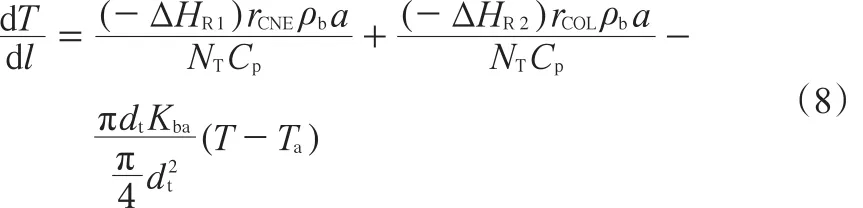
1.3 壓降計算
目前,在工業中廣泛應用的固定床反應器催化劑填充方法多以亂堆床為主,一般孔隙率為0.47~0.70[23]。相應的催化劑床層壓降可由式(9)計算[24]。
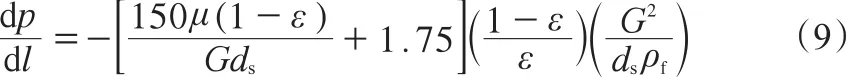
1.4 反應動力學
對在催化劑上進行的苯酚氣相加氫反應,許多學者根據反應機理和實驗結果總結出了多種苯酚加氫動力學模型[25-29],主要有雙曲動力學模型和冪指數模型。本工作選用文獻[25]總結的動力學方程(見式(10)~(13))作為動力學模型。
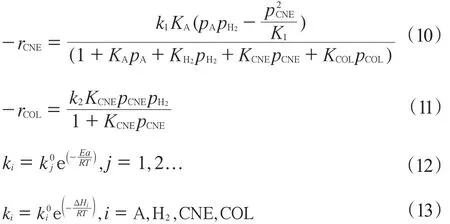
其中,引入了反應平衡常數K1。
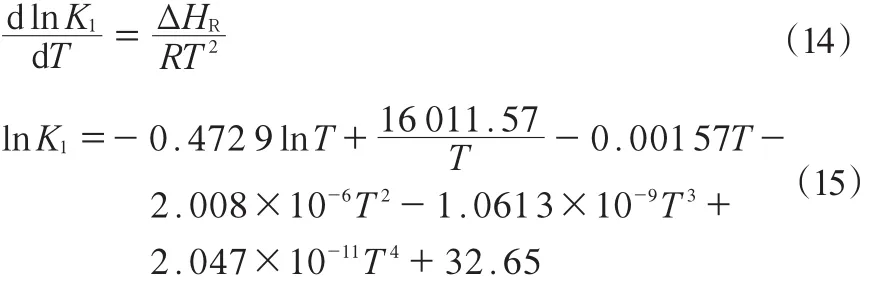
方程中的相關參數均由文獻[30]中的實驗數據擬合得到,該實驗采用Pd/Al2O3催化劑,動力學數據的測定條件為:溫度120~170 ℃,壓力0.1~0.3 MPa。經過擬合計算后得到的參數模型適應性良好,對擬合計算值與實驗值進行了F檢驗,結果見表2。其中,ρ2越接近1,表明所得模型的適應性越好。F是回歸均方與模型殘差均方和的比,對于非線性回歸,一般要求F > 10F0.05(MP,M-MP-1),模型計算中動力學參數取值見表3。
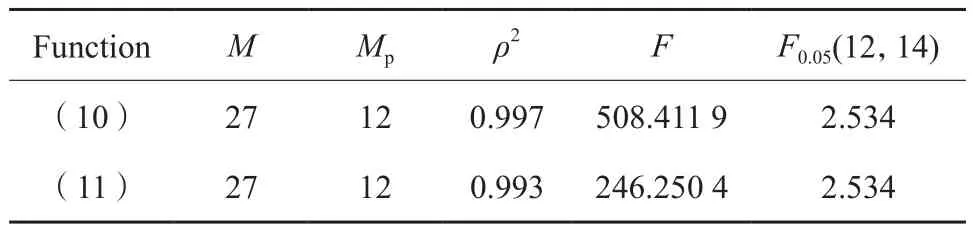
表2 F檢驗結果Table 2 Results of joint hypotheses test
1.5 模型求解及可行性驗證
1.5.1 模型求解
依據文獻[30]中使用的苯酚氣相加氫等溫列管式反應器建立數學模型并進行模擬,管內裝填催化劑,管外的載熱體采用飽和水蒸氣。對管式反應器采用一維擬均相平推流模型進行模擬,不考慮徑向的濃度差和溫度差。
邊界條件:l = 0時,yCNE=,yCOL=,T = T0。
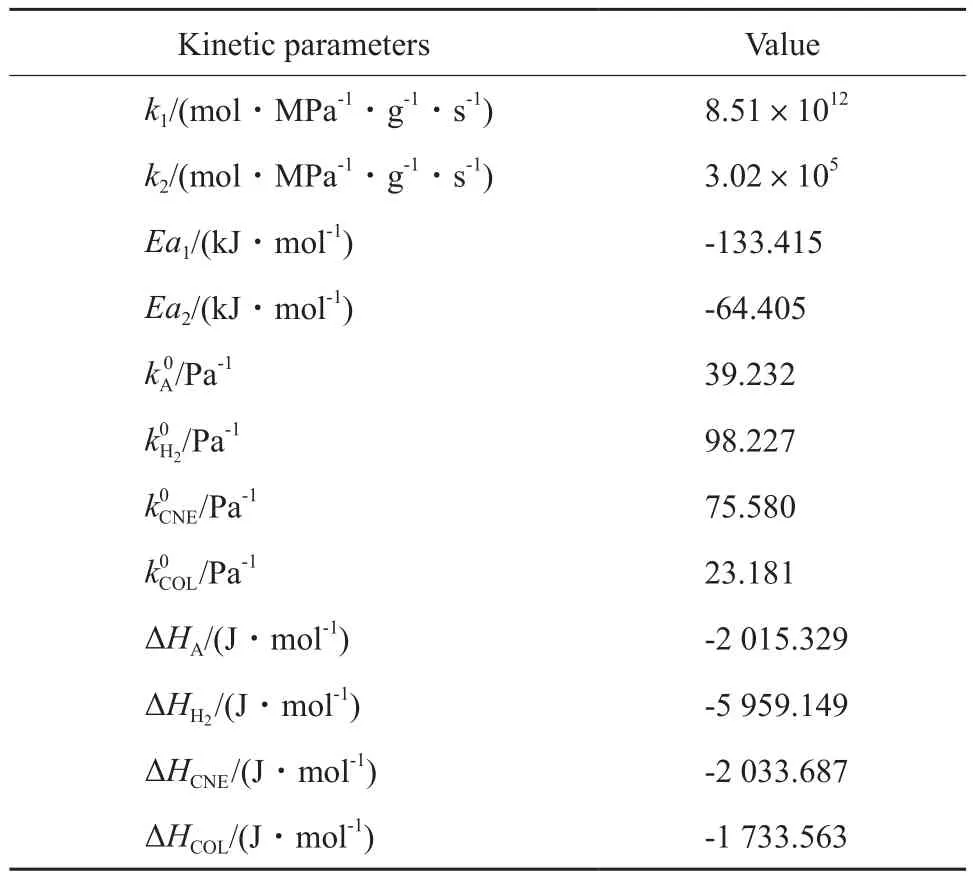
表3 動力學參數Table 3 Kinetic parameters
1.5.2 模型可行性驗證
將文獻[30]中苯酚加氫合成環己酮的實際操作條件輸入到模型中進行計算,并且將模擬計算數據與實際操作數據進行對比,考察該動力學模型以及針對反應器建立的一維擬均相平推流模型是否能夠真實反映反應器內的反應規律。文獻[30]所選用的反應器參數和操作條件見表4。
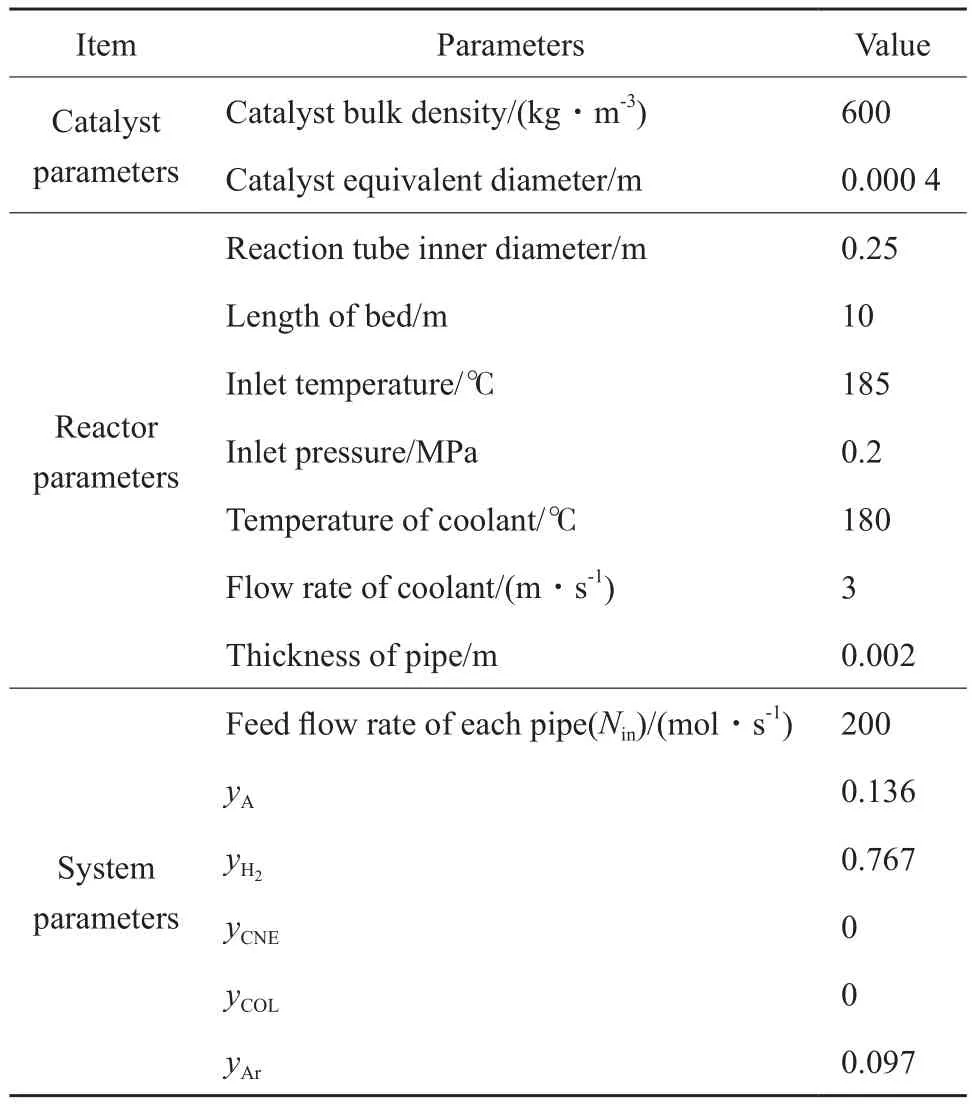
表4 反應器操作參數和條件Table 4 Operating parameters and conditions of reactor
由工業生產實際操作數據得到的苯酚轉化率以及各組分的出口濃度與模擬結果的對比見表5。由表5可見,兩組結果基本接近,表明所建立的反應器模型能夠準確描述反應器的實際操作情況。

表5 模擬結果與工業數據的比較Table 5 Comparison of industrial data and simulation result
2 結果與討論
為深入了解苯酚加氫反應系統的性能、實現反應器設計的優化,需要對反應器內各操作參數對苯酚加氫反應的影響進行深入研究。
若單管反應原料氣進料量為300 mol/s(1 080 kmol/h),根據工業生產要求,反應管內徑設定為0.25 m,床層高度為10 m。選擇氣體入口溫度(T0)185 ℃;對于反應壓力,工業上一般選擇0.1~0.5 MPa,本工作選擇0.2 MPa為計算值。討論了進料量、原料氣的氫氣與苯酚的摩爾比(氫酚比)、管外載熱體溫度對反應器內反應規律的影響。
2.1 原料氣進料量的影響
固定T0= 185 ℃,氫酚比為7∶1,反應管外用飽和水蒸氣移熱,飽和水蒸氣的溫度(Ta)可以認為恒定,且始終比T0低5 ℃,即T0= Ta+ 5。此時,反應器單管進料量在200~1 000 mol/s之間變化時,氣體出口溫度、濃度、苯酚轉化率和環己酮選擇性見表6。
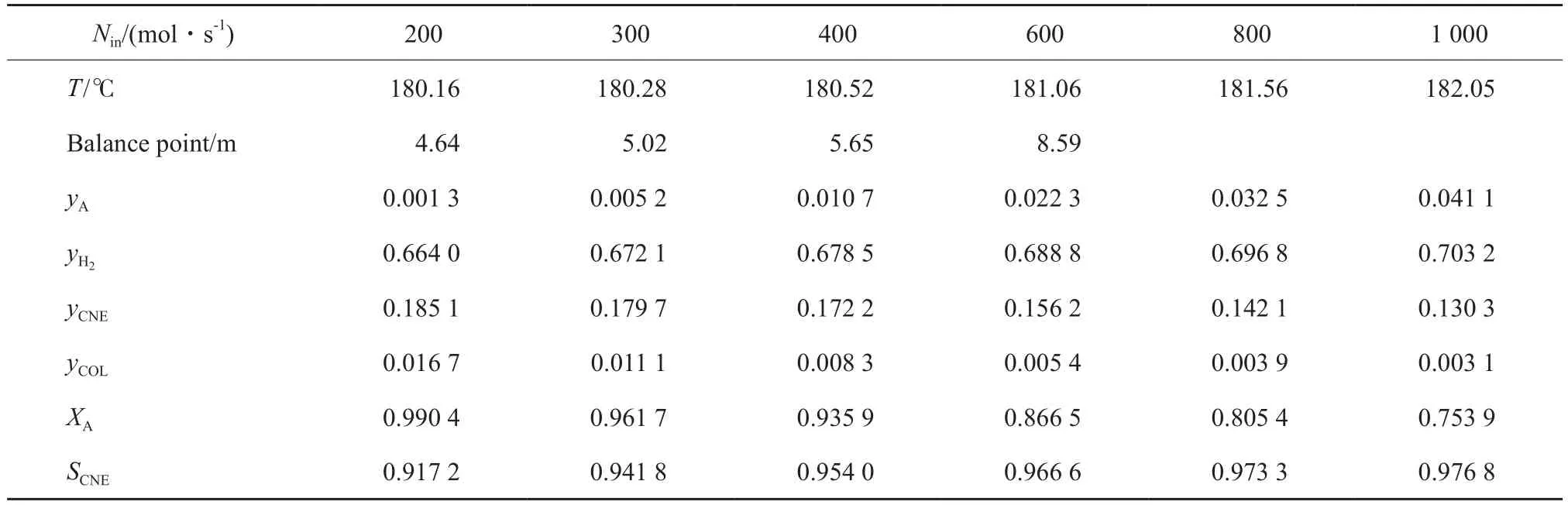
表6 原料氣進料量對苯酚加氫反應的影響Table 6 Effect of Nin on phenol hydrogenation
反應器內溫度和環己酮濃度的分布如圖1和圖2所示,轉化率和選擇性的變化如圖3所示。
綜合分析表6和圖1~3可得,隨進料量的不斷增大,反應器內熱點溫度不斷降低,原料氣出口溫度升高,反應器內平衡點的位置也不斷后移,苯酚加氫反應的轉化率不斷下降,而選擇性卻緩慢增大。這是因為隨著空速的增大,反應物來不及反應便被帶出反應器,而這對連串反應的中間產物環己酮反而有利。綜合考慮適當的反應器條件下進料量對大量苯酚加氫反應產生的影響,選擇單管進料量為300 mol/s。
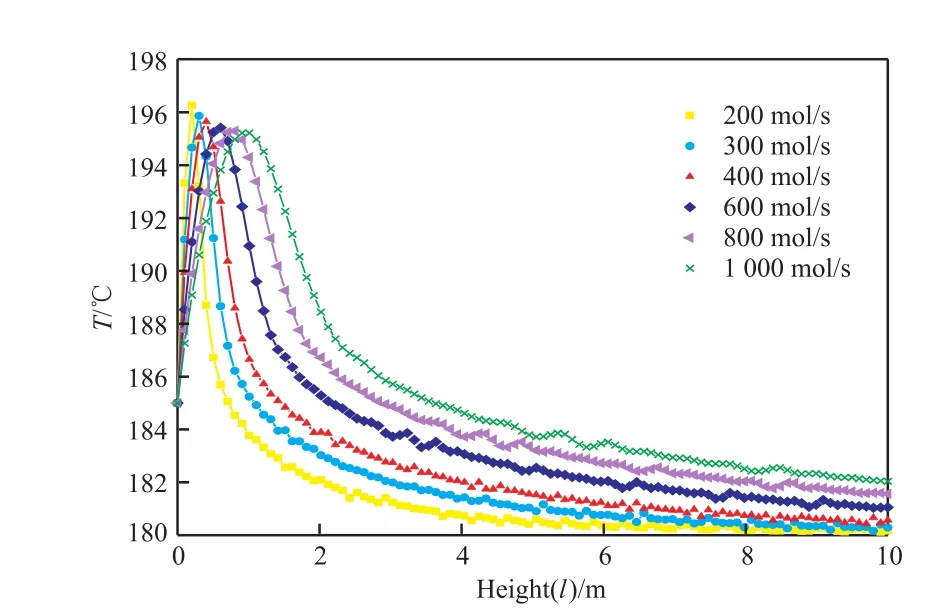
圖1 原料氣進料量變化時反應器內的溫度分布Fig.1 Distribution of temperature with the change of Nin.
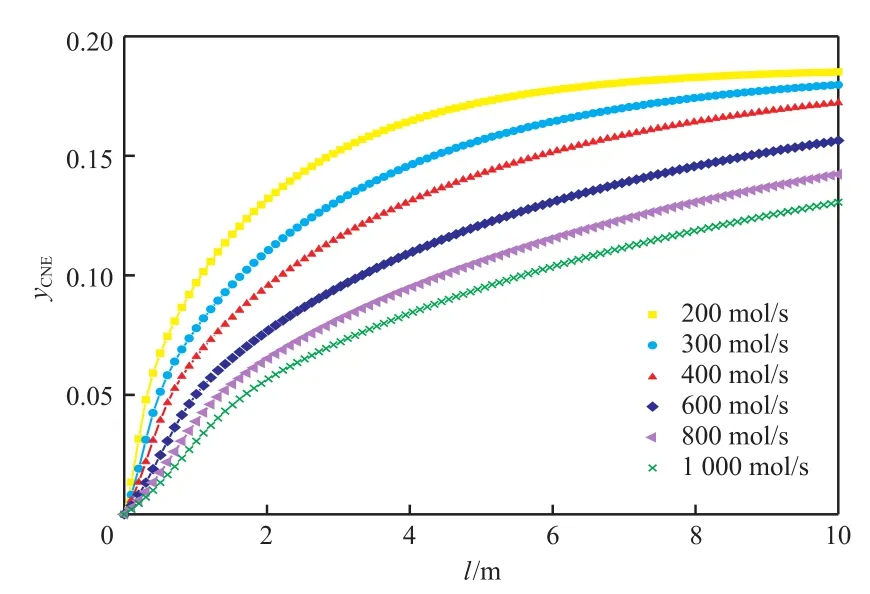
圖2 原料氣進料量變化時反應器內環己酮的濃度分布Fig.2 Distribution of cyclohexanone content with the change of Nin.
2.2 原料氫酚比的影響
在其他條件不變、單管進料量為300 mol/s的條件下,氫酚比對苯酚加氫反應的影響見表7,反應器內溫度分布和環己酮濃度分布如圖4和圖5所示,苯酚轉化率和環己酮的選擇性如圖6所示。
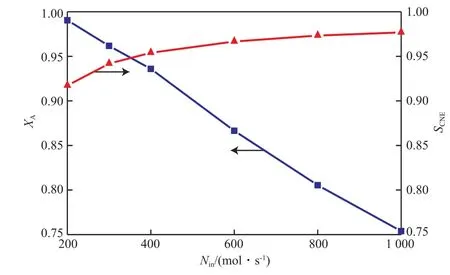
圖3 原料氣進料量對苯酚轉化率和環己酮選擇性的影響Fig.3 Effect of Nin on XA and SCNE.
結合表7和圖4~6可看出,隨氫酚比的增大,反應器的出口溫度基本不變,苯酚的轉化率不斷增大,苯酚加氫反應的平衡點不斷上移,環己酮的選擇性也呈緩慢上升的趨勢。氫酚比為(6∶1)~(8∶1)時都能滿足生產需求,雖然產物中過量的氫氣較易分離且可循環利用,但為避免原料的浪費,選擇最佳的氫酚比為6∶1。
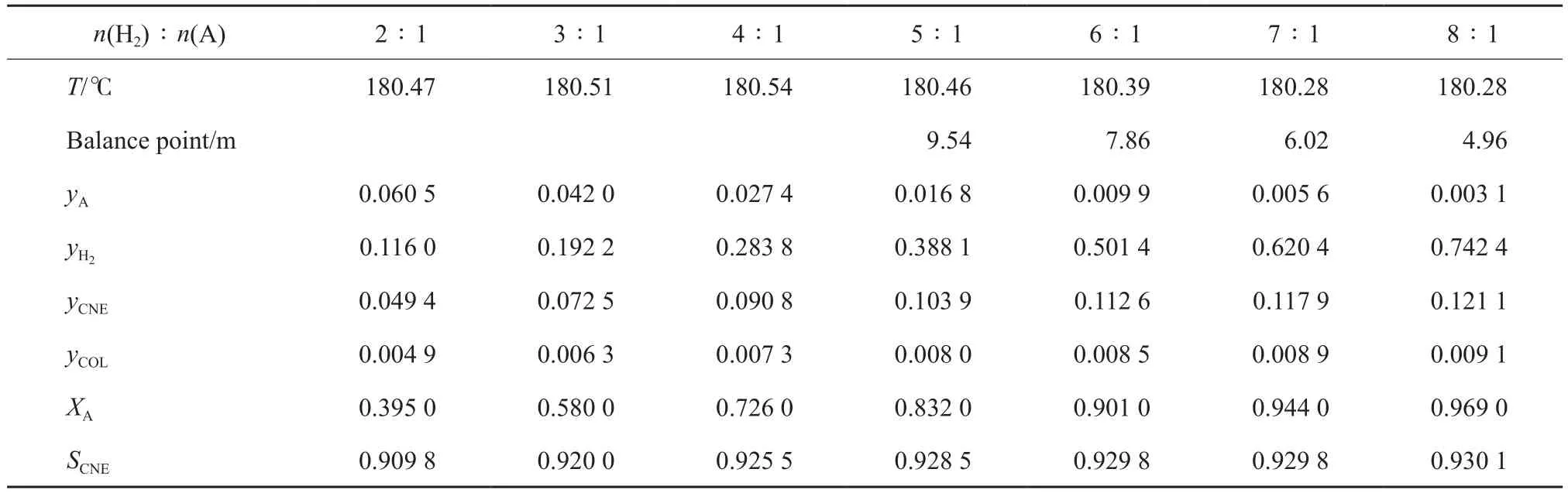
表7 原料氣氫酚比的影響Table 7 Effect of n(H2)∶n(A) on phenol hydrogenation
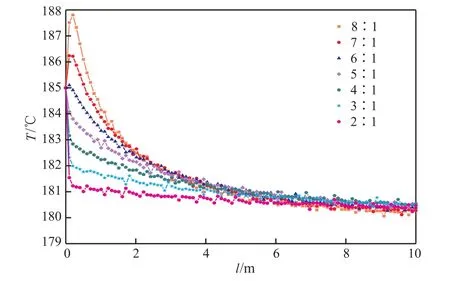
圖4 反應器內溫度隨原料氣氫酚比的變化規律Fig.4 Distribution of temperature with the change of n(H2)∶n(A).
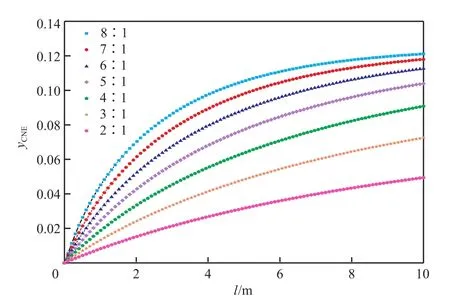
圖5 原料氣氫酚比對反應器內環己酮濃度分布的影響Fig.5 Distribution of cyclohexanone content with the change of n(H2)∶n(A).
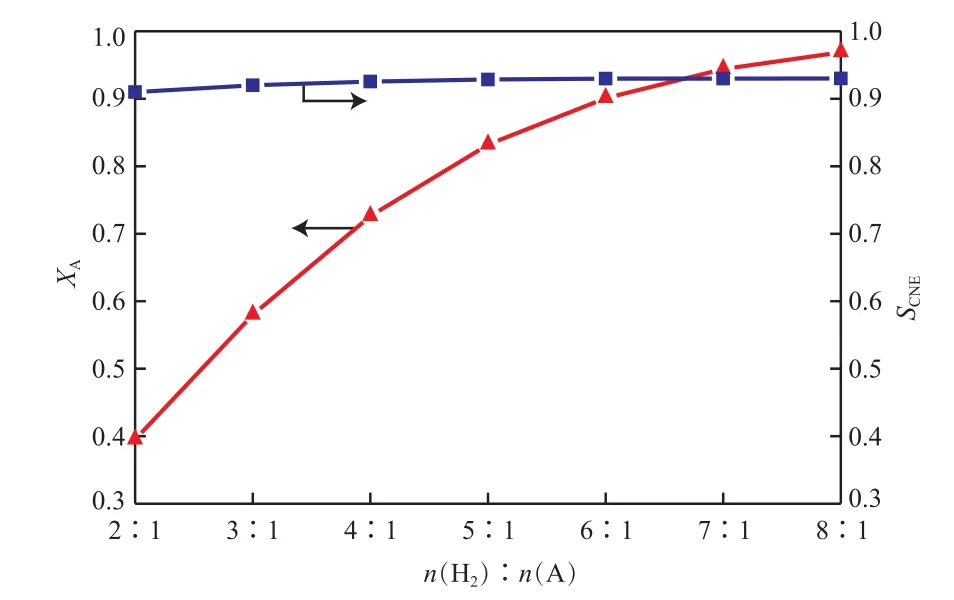
圖6 原料氣氫酚比對苯酚轉化率和環己酮選擇性的影響Fig.6 Effect of n(H2)∶n(A) on XA and SCNE.
2.3 管外載熱體溫度的影響
對于等溫管式反應器,管外載熱體溫度的選擇要做到適宜、節能,溫度過低容易造成移熱過度,使得管內原料氣溫度整體下降,影響整體反應速率;溫度過高又可能造成移熱不足,導致飛溫,造成催化劑失活。在其他條件不變的情況下,選擇單管進料量為300 mol/s、氫酚比為6∶1,計算了外載熱體溫度對反應的影響,結果見表8,δ為管內外溫度差。反應溫度和環己酮濃度的分布如圖7和圖8所示,苯酚轉化率和環己酮的選擇性如圖9所示。
結合表8和圖7~9可看出,反應器內的溫度隨外載熱體溫度的變化而變化,隨著外載熱體溫度的降低,苯酚轉化率直線下降。當外載熱體溫度約為180 ℃時,苯轉化率及目標產物環己酮的選擇性均滿足生產需要。考慮到節能降耗以及催化劑活性等因素,選擇外載熱體的溫度為180 ℃。
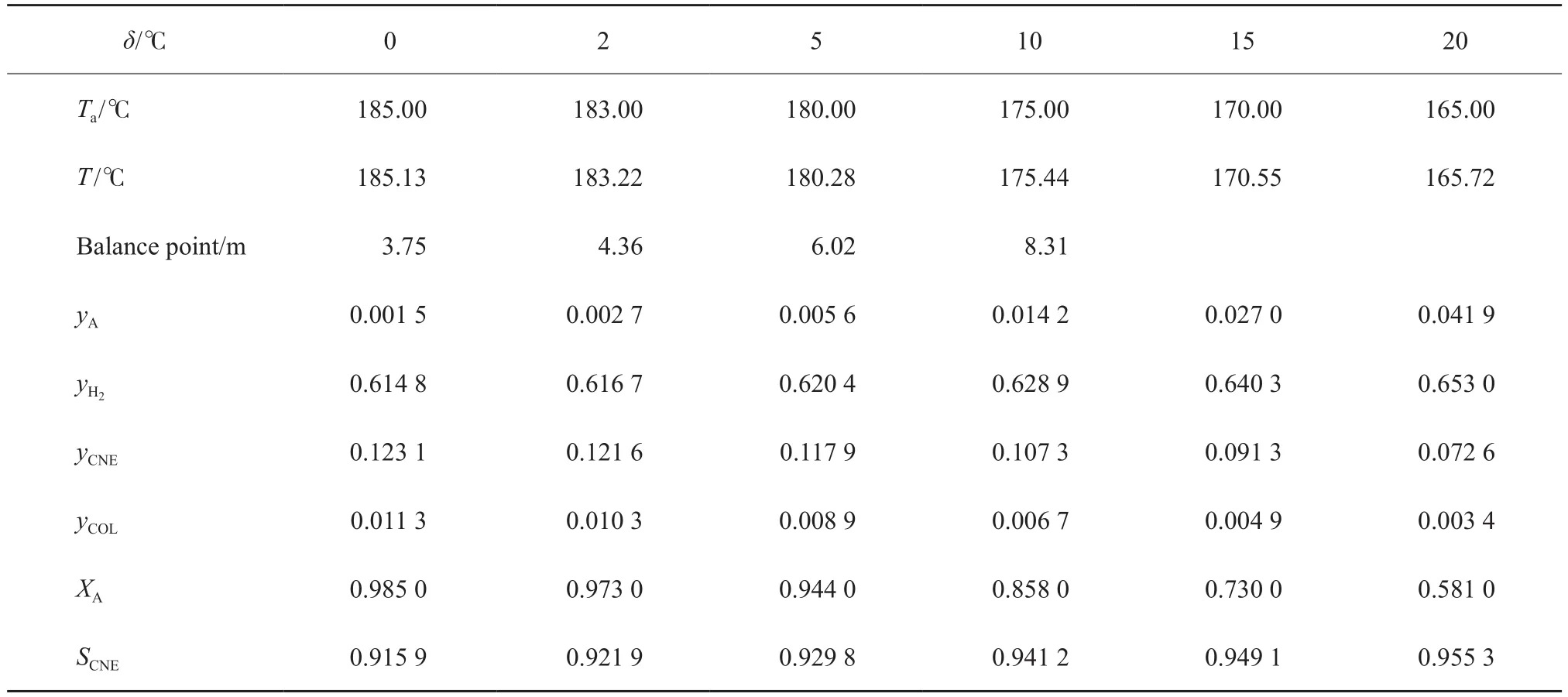
表8 外載熱體溫度的影響Table 8 Effect of temperature of coolant(T a) on phenol hydrogenation
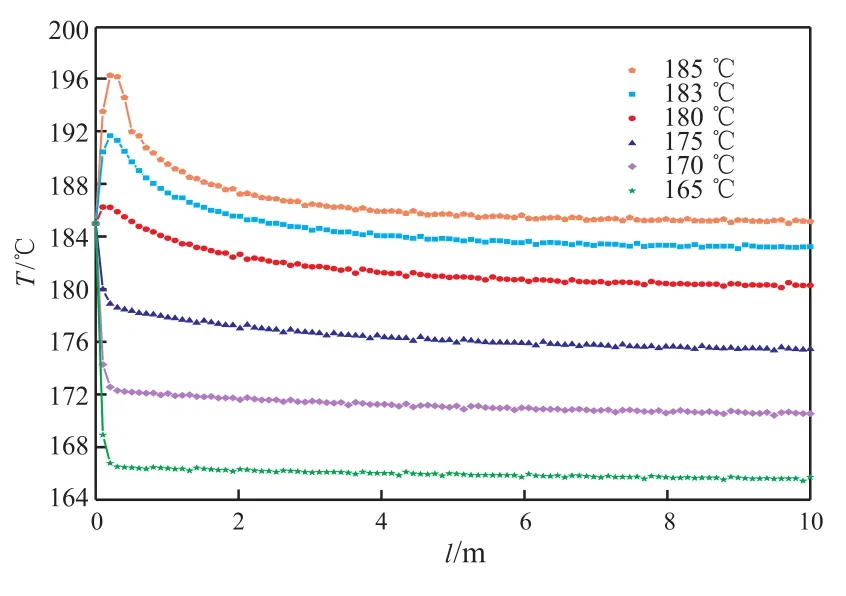
圖7 反應器內溫度隨外載熱體溫度變化的規律Fig.7 Distribution of temperature with the change of Ta.
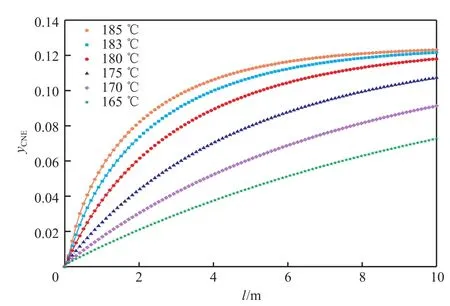
圖8 外載熱體溫度對反應器內環己酮濃度分布的影響Fig.8 Distribution of cyclohexanone content with the change of T a.
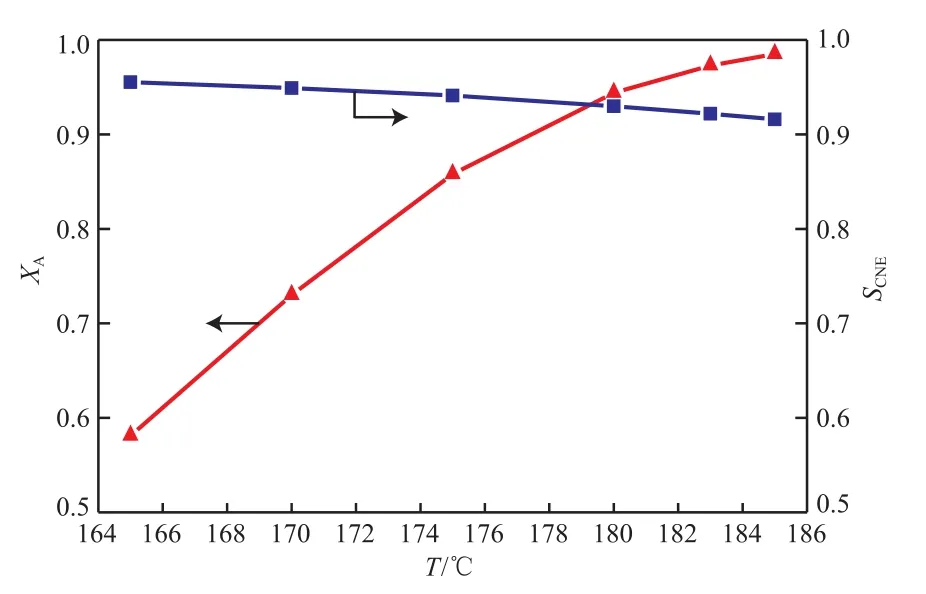
圖9 外載熱體溫度對苯酚轉化率和環己酮選擇性的影響Fig.9 Effect of Ta on XA and SCNE.
根據上述結果,當單管直徑為0.25 m、高度為10 m時,通過反應器的模擬計算得到較優的操作條件如下:氣體入口溫度185 ℃、原料氣進料量300 mol/s、操作壓力0.2 MPa、原料氣氫酚比6∶1、管外載熱體溫度180 ℃。反應器內溫度及各組分濃度的分布如圖10和圖11所示。
綜上所述,紫云英苷是一種具有潛在抗人卵巢癌作用的活性成分,可通過抑制HIF-1α誘導的糖酵解等通路來抑制卵巢癌細胞的增殖、促進卵巢癌細胞的凋亡,為抗卵巢癌新藥的研發提供重要依據和參考。
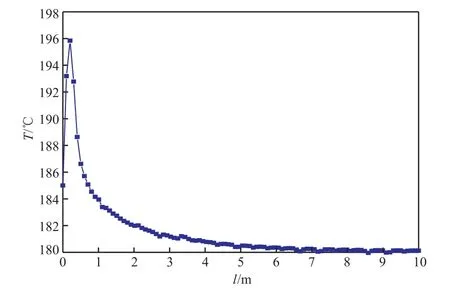
圖10 反應器內溫度的軸向分布Fig.10 Axial distribution of reaction temperature.
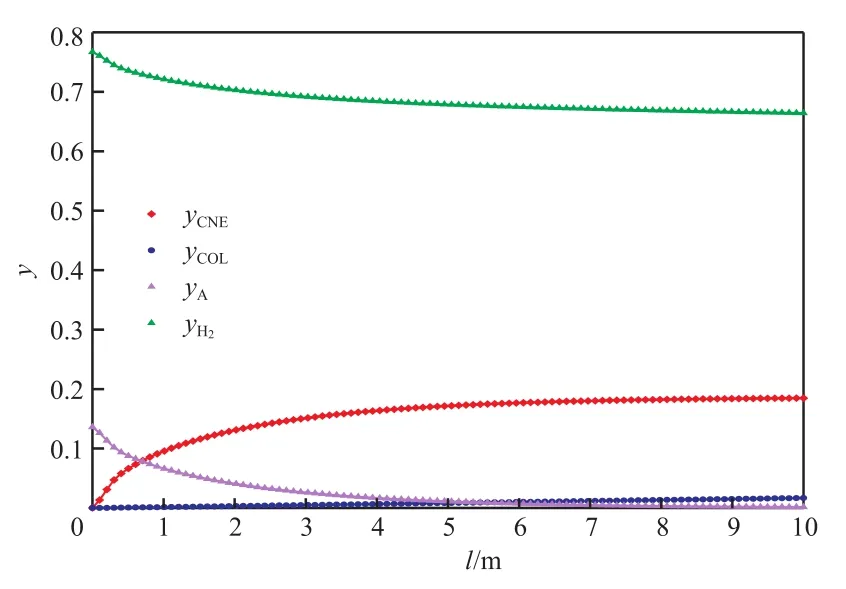
圖11 反應器內各組分濃度的軸向分布Fig.11 Axial distribution of components content.
原料氣與催化劑一接觸便迅速發生反應,反應器內溫度急速上升并達到熱點,隨后緩慢達到平衡,溫度由熱點不斷下降至外載熱體溫度;苯酚和氫氣作為反應物,濃度沿軸向不斷減小,而環己酮和環己醇的濃度不斷增加,所有組分的濃度在反應達到平衡后保持不變。苯酚的轉化率為98.8%,目標產物環己酮的選擇性達到91.7%,滿足工業生產要求。
3 結論
1)根據苯酚加氫反應機理和實際生產情況,選擇文獻[25]總結歸納的動力學模型,綜合文獻[30]測得的實驗數據,擬合了動力學方程以及方程的各參數,建立了一維擬均相數學模型。該模型能夠真實描述反應規律,滿足模擬和指導工業生產的要求。
2)選擇管徑為0.25 m、高為10 m的苯酚加氫等溫管式反應器,通過反應器模擬計算得到較優的操作條件:氣體入口溫度185 ℃、原料氣進料流量300 mol/s、操作壓力0.2 MPa、原料氣的氫酚比6∶1、管外載熱體溫度180 ℃。在此條件下,該管式反應器的出口溫度約為180 ℃、苯酚的轉化率為98.8%、目標產物環己酮的選擇性達到91.7%,滿足工業生產要求。
符 號 說 明
a 反應床層截面積,m2
Cp定壓比熱容,J/(mol·K)
dt反應管內徑,m
ds催化劑顆粒當量直徑,m
Ea 反應的活化能,kJ/mol
F F檢驗中回歸均方與模型殘差均方的比
ΔHR反應熱,J/mol
ΔHR1苯酚加氫生成環己酮反應熱,J/mol
ΔHR2環己酮加氫生成環己醇反應熱,J/mol
ΔHii組分的吸附能,J/mol
Kba總傳熱系數,W/(m·K)
K1苯酚加氫生成環己酮反應平衡常數
Ki吸附速率常數,Pa-1
ki反應速率常數,mol/(MPa·g·s)
k0
j各組分吸附速率常數指數前因子,Pa-1
l 床層高度,m
M F檢驗中樣本數目
MPF檢驗中自變量數目
Ni各組分的物質的量,mol
Niin原料氣各組分的物質的量,mol
Nin原料氣進料量,mol/s
NT各組分的總物質的量,mol
NTin原料氣各組分的總物質的量,mol
p 催化劑床層壓降,MPa
pii組分的分壓,MPa
R 理想氣體常數,8.314 J/(mol·K)
rCNE苯酚加氫生成環己酮反應速率,mol/(s·kg)
rCOL環己酮加氫生成環己醇反應速率,mol/(s·kg)
SCNE環己酮的選擇性,%
T 物料出口溫度,℃
T0原料氣入口溫度,℃
Ta管外載熱體溫度,℃
XA苯酚的轉化率,%
yi各組分的摩爾分數,%
δ 管內外溫度差,℃
ε 床層孔隙率,%
μ 混合氣體黏度,MPa·s
ρ2F檢驗中的回歸均方
ρb床層密度,kg/m3
ρf流體的混合密度,kg/m3
下角標
A 苯酚
CNE 環己酮
COL 環己醇

