過表達NGF的間充質干細胞對神經元損傷的修復作用研究
李慧勇 彭余江 何璽君 邵波 段虹宇 陳慧慧 楊帆 楊鵬翔 曾煜
間充質干細胞(mesenchymal stem cells,MSC)是一種最早在骨髓中被發現的非造血干細胞[1]。國際細胞治療協會(ISCT)在2006年發布了定義MSC的特性指南[2],MSC具有多向分化能力,在適宜的條件下可以分化為神經元。MSC因其自身特征成為目前基因工程的理想細胞。中樞神經系統(central nerve system,CNS)損傷修復是目前臨床函待解決的問題,傳統藥物包括氧自由基清除劑、能量代謝支持劑、神經遞質受體拮抗劑等神經保護劑對神經元再生療效并不確切。科學家在上世紀50年代首次發現神經生長因子(nerve growth factor,NGF)可直接促進神經元損傷修復和再生[3]。NGF可經細胞上受體信號通路介導,與效應細胞上跨膜糖蛋白結合,激活細胞內信號通路級聯反應,從而發揮促進神經元發育、刺激神經干細胞生長、調控細胞周期開關、影響海馬區神經元增殖的生物學作用;其還可通過清除氧自由基及拮抗興奮性氨基酸神經毒性修復損傷神經元、阻斷神經元凋亡[4-5]。本研究旨在探討NGF對MSC分化的影響,同時通過制備大鼠神經細胞缺糖缺氧(oxygen-glucose deprivation,OGD)模型,觀察轉染NGF腺病毒的MSC移植對神經元損傷的修復作用,以期為臨床上神經元損傷的治療和并發癥的預防提供新思路,現報道如下。
1 材料和方法
1.1 材料 實驗用SD大鼠購自上海斯萊克實驗動物有限責任公司(合格證號:2007000571194),雌雄不限,體重250~300g,飼養于中科院上海生命科學院實驗動物中心SPF級動物實驗室,予標準飼料飼養并自由飲水。對照腺病毒AdGFP及目的腺病毒AdNGF購自于上海漢恒生物科技有限公司;1×PBS(中國 Sangon上海生工公司);10cm細胞培養皿、10cm細胞培養瓶、Transwell細胞培養板(美國 Corning公司);a-MEM(美國 HyClone公司);IMDM(美國 HyClone公司);0.25%Tripsin-EDTA (美國 HyClone公司);FBS(美國 Hy-Clone公司);青霉素/鏈霉素(美國 HyClone公司);RIPA裂解液(中):(中國碧云天公司,貨號:P0013C);Bradford蛋白濃度測定試劑盒(中國碧云天公司,貨號:P0006);BlkTMNoise Cancelling Reagents(德國 Millipore公司);PVDF膜(德國Millipore公司),TUNEL試劑盒(中國南京路飛生物公司)。
1.2 方法
1.2.1 大鼠MSC的分離和培養 頸椎脫臼處死SD大鼠,75%乙醇浸泡后,取出股骨和脛骨,PBS洗凈,用大號注射器吸取MSC培養液(a-MEM+10%FBS,100mg/L青霉素,100mg/L鏈霉素)沖出骨髓,適度吹散,加入MSC培養液10ml,吹打均勻,加入10cm的培養瓶中,37℃、5%二氧化碳孵育箱培養,24h后進行第 1次換液,將未貼壁的細胞全部棄掉,以后隔日換液,在倒置顯微鏡下逐日觀察細胞形態及生長情況。待細胞密度達到70%~80%時進行傳代培養:(1)棄去培養液,加入0.25%的胰酶液 5ml,37℃消化 5min;(2)加入含 5%FBS 的IMDM細胞培養液 5ml終止消化;(3)將其移至15ml離心管中,2 000r/min,離心 3min;(4)棄去上清液,沉淀中加入含15%FBS的IMDM細胞培養液10ml,吹打均勻,按1∶3傳代進行培養。傳代培養過程中隔日換液,直至貼壁細胞彼此融合,鋪滿整個培養瓶的底面,再重復以上操作。細胞長密后進行傳代,凍存早代數細胞,盡量用6代以內的細胞進行實驗。
1.2.2 大鼠MSC轉染AdNGF腺病毒 將MSC細胞以3×105細胞/孔的密度鋪種至6孔板,分別加入對照腺病毒AdGFP、目的腺病毒AdNGF轉染。腺病毒感染2h后換正常細胞培養液,36h后進行后續實驗。提取MSC細胞總蛋白,Western blot法檢測NGF蛋白的表達。
1.2.3 大鼠原代神經元分離培養 3d內出生的新生鼠數只,剪斷頭,剪開頭皮與顱骨,暴露大腦兩半球,剝離軟腦膜及表面血管,夾取大腦皮層組織,放入冰上裝有解剖液的小燒杯,剪碎腦組織至1mm3大小,棄去原解剖液,加入新解剖液,移入15 ml離心管中,靜置;去上清液(解剖液,含血清,影響胰酶消化),加入4倍體積的0.25%胰酶,輕柔吹打數下,37℃消化5min;吸出上清液至裝有少量小牛血清的15ml離心管中,終止消化,共反復數次(不超過6次)至消化完全;匯集數次消化后上清液,過180目篩移入離心管,800r/min,7min后吸去上清液,用含3ml 10%FBS與5%馬血清的DMEM培養液重懸細胞;細胞計數,調整細胞密度為5×105種入鋪好多聚賴氨酸的培養皿或96孔板中,37℃、5%二氧化碳培養箱中培養24h后,用含2%B27的神經元培養基換液,培養48h,加入阿糖胞苷抑制膠質細胞,24h后換去含阿糖胞苷的培養基,每3d半換液1次。
1.2.4 大鼠神經元OGD模型的制備與MSC培養上清液對神經元損傷的影響 去除AdGFP、AdNGF轉染的MSC細胞培養液,PBS洗滌后加入無糖基本培養基培養6h,分別收集兩者的培養上清液;將大鼠原代神經元移至預鋪多聚賴氨酸的玻片上或培養皿中培養,去除細胞培液,PBS洗1遍,加入OGD培養液[154 mmol/L NaCl、5.6mmol/L KCl、5.0 mmol/L HEPES、3.6mmol/L NaHCO3、2.3mmol/L CaCl2(pH 7.4)],分為3組,按5%的比例分別加入AdGFP轉染的MSC細胞培養上清液(AdGFP-MSC組)、AdNGF轉染的MSC細胞培養上清液(AdNGF-MSC組)及無糖培養基(Control組)。將上述細胞培養皿密封放入無氧培養箱中,4h后取出細胞玻片,PFA固定,作TUNEL染色檢測神經元凋亡情況,confocol拍照。并收集上述細胞,采用Western blot法檢測保護性信號通路磷酸化Akt(p-Akt)表達水平。
1.3 觀察指標 (1)觀察大鼠MSC感染AdNGF腺病毒后NGF的過表達情況;(2)觀察大鼠原代神經元分離培養結果;(3)比較 AdNGF-MSC組、AdGFP-MSC組、Control組大鼠原代神經元凋亡情況及p-Akt表達水平。
1.4 統計學處理 應用SPSS20.0統計軟件;計量資料以表示,組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗;P<0.05為差異有統計學意義。
2 結果
2.1 大鼠MSC感染AdNGF腺病毒后NGF的過表達情況 大鼠MSC分別感染對照腺病毒AdGFP與目的腺病毒AdNGF 36h后,兩者的腺病毒綠色熒光蛋白表達情況均良好,腺病毒感染效率較高(圖1)。Western blot實驗結果表明大鼠MSC感染AdNGF腺病毒后NGF的過表達效果好(圖2)。
2.2大鼠原代神經元分離培養結果 大鼠原代分離的神經元呈長梭形,生長狀態良好(圖3)。
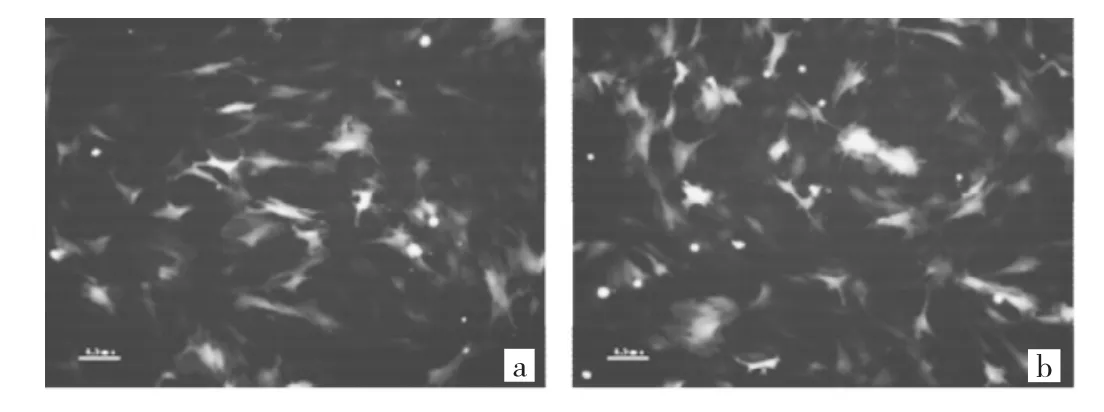
圖1 大鼠MSC感染腺病毒36h后綠色熒光蛋白的表達情況(a:腺病毒 AdGFP;b:腺病毒 AdNGF;×200)

圖2 大鼠MSC感染腺病毒AdGFP與腺病毒AdNGF后NGF的表達電泳圖
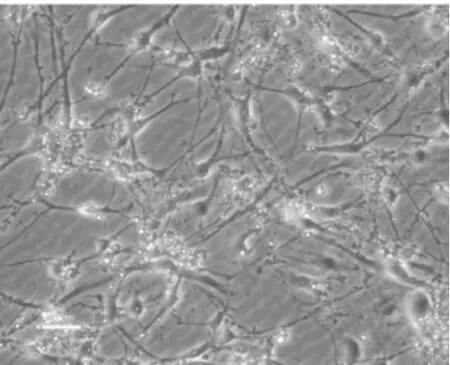
圖3 原代分離的大鼠神經元形態學表現(×200)
2.3 AdNGF-MSC 組、AdGFP-MSC 組、Control組大鼠原代神經元凋亡情況比較 經OGD處理的原代神經元中,與Control組比較,AdGFP-MSC組凋亡細胞比例降低,而AdNGF-MSC組凋亡細胞比例大幅度降低,表現為綠色熒光點的數量及比例均有相應減少(圖4)。

圖4 大鼠原代神經元凋亡情況(TUNEL染色,×200)
2.4 AdNGF-MSC 組、AdGFP-MSC 組、Control組大鼠原代神經元p-Akt表達水平比較 經OGD處理的原代神經元中,與Control組比較,AdGFP-MSC組p-Akt的表達上調,而AdNGF-MSC組p-Akt的表達更進一步上調(圖 5)。
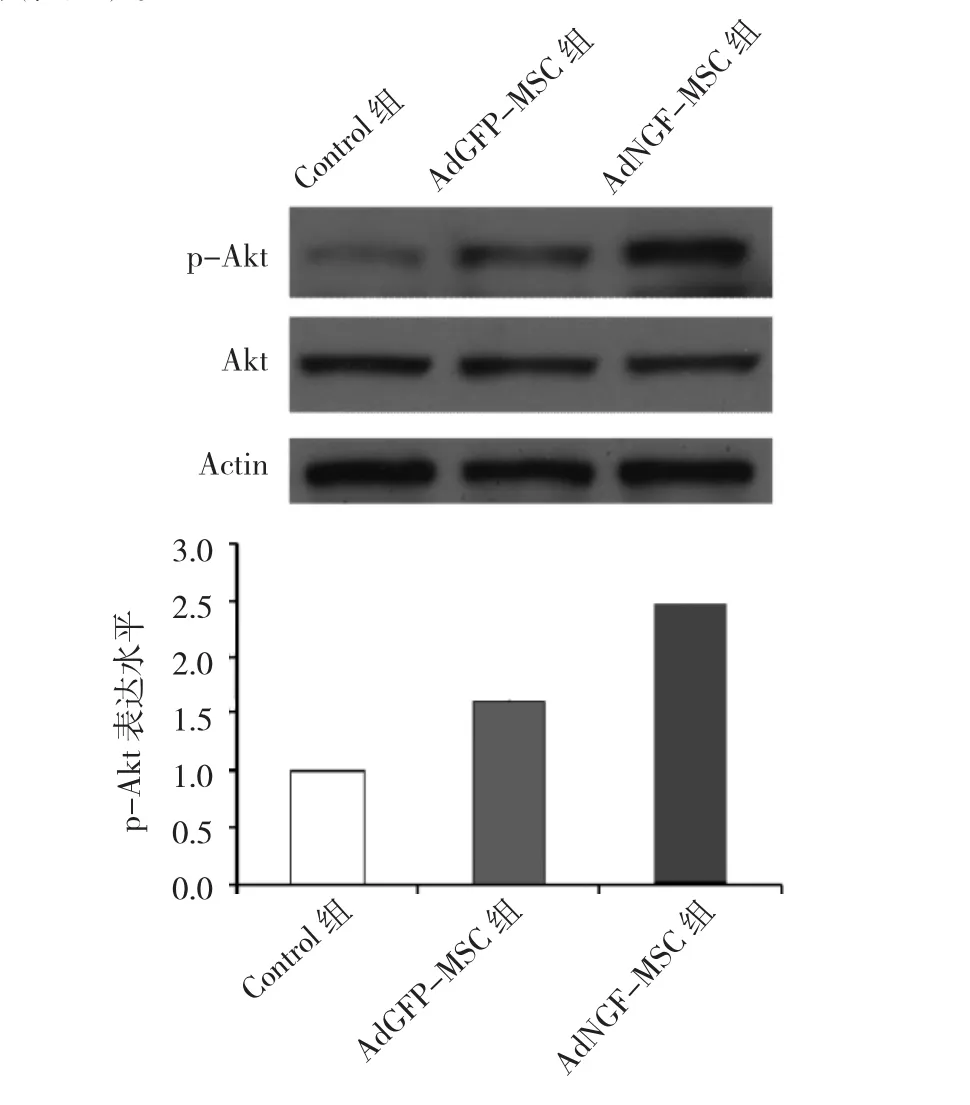
圖5 AdNGF-MSC組、AdGFP-MSC組、Control組大鼠原代神經元p-Akt表達水平比較
3 討論
神經系統損傷的修復一直是研究熱點,尤其是針對CNS的損傷。CNS內神經元、膠質細胞之間通過軸突和樹突形成復雜的調控網絡,精確掌控感覺、運動以及高級認知功能。神經元缺少分裂、增殖的自我修復能力,損傷后由增生的膠質細胞來代替,所以CNS常遺留嚴重的神經功能缺失。藥物治療CNS損傷的生物活性物質NGF能夠促進神經元的存活和軸突的生長,并在體內被證實能夠促進CNS和周圍神經系統的再生[6]。NGF要局部、持續地安全高效遞送到神經系統的損傷部位,就需要借助藥物遞送系統,如采用乳化溶劑蒸發技術等方法制備出的包封神經營養因子微球體作為藥物遞送系統,能在較長時間持續緩慢地釋放神經營養因子,改善損傷的神經組織微環境,促進神經組織的修復[7]。有學者設計了包封NGF的膠原蛋白微球體使NGF得以長期緩慢釋放[8]。這些藥物遞送系統都因NGF具有高度的親水性,從而導致最初顯著的爆發式釋放[9],不能滿足在體內長期釋放的需求。將包封NGF的微球體固定到神經支架中,可能會顯著地減少最初爆發式釋放的特征,NGF、微球體、神經支架與靶細胞組合起來的復合材料將是應用到神經系統損傷修復的研究方向和趨勢[10-11]。
MSC因其自身特征成為目前基因工程的理想靶細胞。MSC可在神經元和神經膠質修復過程中減少軸突的神經病理改變[12]。Lai等[13]分離了間充質干細胞外泌體(MSC-exosomes),MSC-exosomes能夠增加神經突分支數量和神經突的總長度。此保護和促生長機制源于MSC-exosomes中的miR-133b[14]。MSC與缺血組織共培養后,MSC和MSC-exosomes中的miR-133b含量都明顯增多,其后MSC-exosomes將其中的miR-133b轉運至神經組織以產生保護作用[15]。MSC-exosomes能夠模擬MSC的生物學功能,靶細胞可以膜融合或者內吞作用獲取MSC-exosomes中的生物活性物質。MSC-exosomes更穩定,更好保存,易于管理和控制,可以人為的改變其內容物的種類和數量[16-17]。
NGF可參與神經細胞的生長、增殖、分化、存活及凋亡過程,在腦微環境中具有保護MSC不被破壞,促進其增殖分化、發揮其相應功能的作用[18],但NGF促進MSC的分化的機制有待研究。NGF直接腦內注射和微囊化后植入腦內,可能損傷腦組織和引起機體的免疫排斥反應,采用NGF修飾的MSC作為載體,可解決藥物遞送系統中NGF遞送給藥釋放問題,使其在腦內的生物活性持續時間較長,且可利用NGF能促進MSC向神經元分化的功能,使MSC移植腦內后最大限度地補償損傷和死亡的神經細胞、重建神經環路,從而達到恢復神經功能的目的。
本研究結果表明,AdNFP腺病毒感染的MSC培養上清液可以大幅度降低原代神經元凋亡細胞比例。用AdGFP腺病毒感染的MSC培養上清液可以上調原代神經元保護性信號通路p-Akt的表達水平,而用AdNGF腺病毒感染的MSC培養上清液可以更進一步上調原代神經元p-Akt的表達水平。這說明MSC的培養上清液可以一定程度上保護原代神經元抵抗OGD損傷,而過表達NGF之后的MSC培養上清液可以進一步保護原代神經元。NGF聯合MSC移植治療中樞神經損傷或為臨床一種新思路。

