骨質(zhì)疏松性椎體壓縮骨折椎體強化術(shù)后不同椎體高度對相鄰椎體應(yīng)力影響的有限元分析
趙文韜 秦大平 張曉剛* 王志鵬 仝尊
1. 甘肅中醫(yī)藥大學,甘肅 蘭州 730000 2. 甘肅中醫(yī)藥大學附屬醫(yī)院,甘肅 蘭州 730020 3. 云南中醫(yī)學院,云南 昆明 650500
骨質(zhì)疏松性椎體壓縮骨折(osteoporotic vertebral compression fracture, OVCF)是老年人常見的伴隨骨密度降低而導(dǎo)致的疾病[1],可以引起急性或慢性腰背疼痛、脊柱功能受限、胸腰椎椎體畸形、椎體高度丟失和生活質(zhì)量下降[2-3],其發(fā)生率高于其他骨質(zhì)疏松性骨折(比如髖部骨折和橈骨遠端骨折)[4],已經(jīng)成為越來越嚴重的疾病和全球重大的健康問題之一,將來會顯著增加社會和家庭的經(jīng)濟負擔[5]。
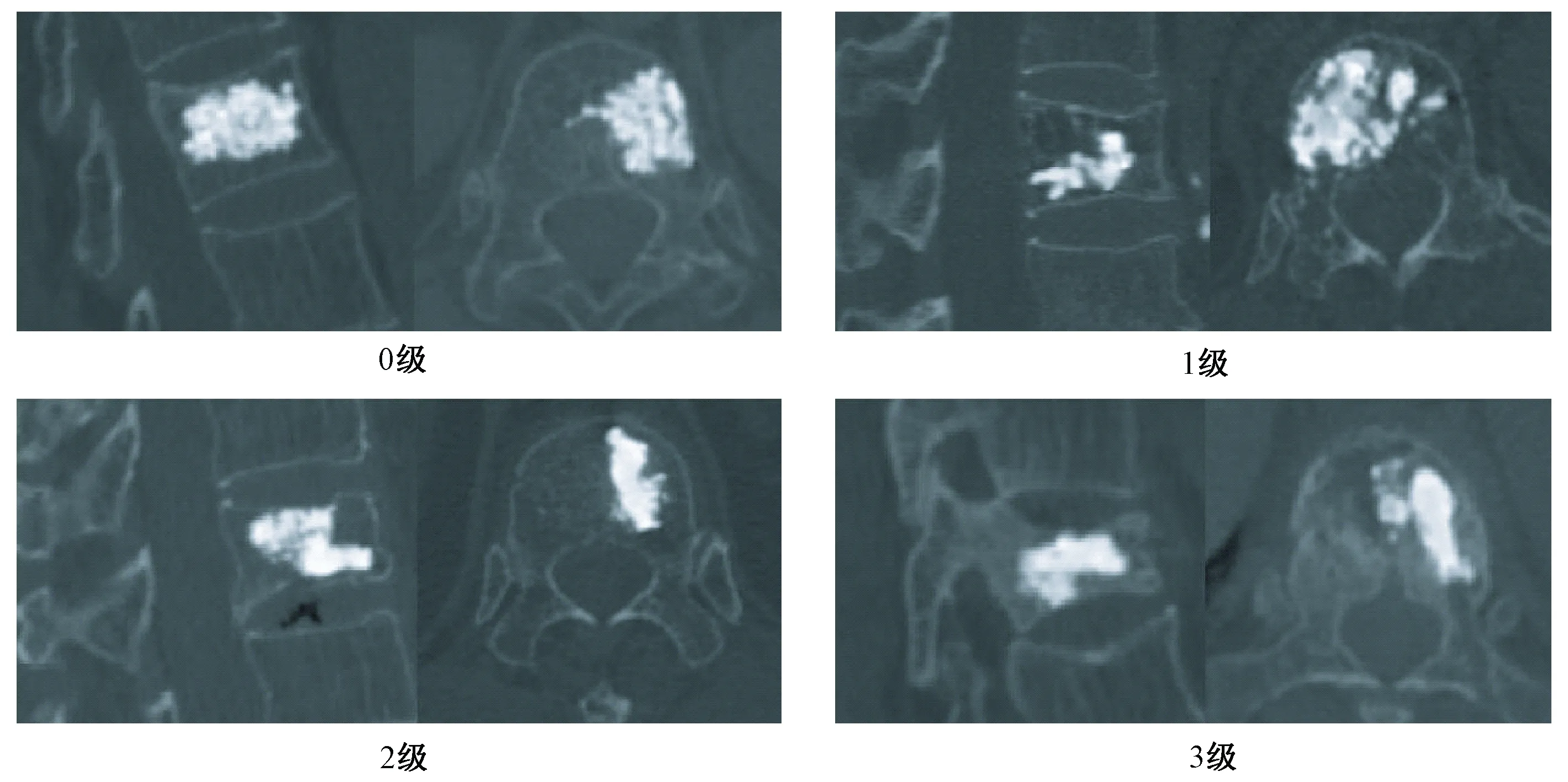
圖1 四例T12骨質(zhì)疏松性椎體壓縮性骨折椎體強化術(shù)后CT圖像Fig.1 Computed tomography images of four patients with T12 osteoporotic vertebral compression fracture after vertebral augmentation
針對OVCF的治療,經(jīng)皮椎體成形術(shù)(percutaneous vertebroplasty, PVP)和經(jīng)皮椎體后凸成形術(shù)(percutaneous kyphoplasty, PKP)兩種椎體強化技術(shù)通過將骨水泥經(jīng)皮注射到骨折椎體中可以達到快速穩(wěn)定骨折、緩解疼痛的治療目的[6-7]。在臨床運用中發(fā)現(xiàn),盡管臨床治療效果明確,但是PVP和PKP并不能將OVCF中丟失的椎體高度全部恢復(fù)。而這種現(xiàn)象對骨折椎體相鄰椎體應(yīng)力的影響也尚未明確,為了分析OVCF椎體強化手術(shù)后不同椎體高度對相鄰椎體應(yīng)力的影響,我們運用有限元分析 (finite element analysis, FEA)的方法進行了研究。
1 方法
1.1 納入患者
本研究納入四名女性T12OVCF志愿者。OVCF的納入標準為:①急性、輕度或中度暴力造成的骨折;②腰背部疼痛視覺模量(VAS)評分≥5分;③受傷椎體MRI檢查T1加權(quán)像呈高信號,T2加權(quán)像呈低信號;④通過雙能X射線(dual-energy X-ray, DXA)測定骨密度T≤-1.5。排除標準:其他病理性骨折。四名患者的年齡分別為63、71、77和84歲,均進行單側(cè)PKP手術(shù)。四例患者手術(shù)后第2天VAS評分降至2、2、2和1分。
患者椎體強化后進行CT掃描,掃描節(jié)段從T11水平到L1水平,掃描層厚為0.625 mm。患者椎體強化后CT影像通過Genant半定量方法進行分級,分別被分為0~3級:椎體高度正常(0級);輕度畸形(1級,前/后對比減少約20%~25%);中度畸形(2級,任意高度減少約25%~40%,面積減少20%~40%;嚴重畸形(3級,任何高度或面積減少約40%)(圖1)[8]。所有CT影像都通過醫(yī)學數(shù)字成像與通訊(digital imaging and communications in medicine, DICOM)格式保存,用于三維FEA模型的生成。
1.2 T11~L1和T12骨折三維模型的構(gòu)建
利用CT影像生成包含T11~L1節(jié)段的三維模型。首先將四名患者DICOM格式的CT影像導(dǎo)入Mimics軟件(版本:10.01, Materialize, Inc., Leuven, Belgium)。使用閾值分割命令分離骨骼和軟組織;使用編輯蒙版工具編輯圖像形狀,選擇所需區(qū)域,填充出現(xiàn)在間隙中的圖像區(qū)域,并逐層分割出所需的輪廓;最后,通過編輯蒙板重建T11、T12、L1三個椎體,生成T11、T12、L1椎體(包括1 mm皮質(zhì)骨和松質(zhì)骨)的三維模型。重建的三維模型以STL格式保存。
將STL格式的模型導(dǎo)入到自動逆向工程軟件Geomagic (版本:2012,Geomagic,Raindrop Geomagic,Research Triangle Park, NC, USA),通過軟件對骨骼模型進行優(yōu)化,分別使用平滑降噪、特征去除、編輯輪廓線、構(gòu)造曲面片和擬合曲面等命令達到目的,生成的模型以STP格式分別保存。將STP格式的模型導(dǎo)入到Solidworks軟件(版本2012,Dassault Systems,SolidWorks Corp.,Santa Monica,CA),利用裝配體命令將T11、T12、L1椎體三維模型裝配后轉(zhuǎn)為零件,使用曲面和特征命令等距曲面、分割、組合等來生成終板、關(guān)節(jié)突關(guān)節(jié)軟骨和椎間盤(包括髓核和纖維環(huán))。再通過裝配命令將這些結(jié)構(gòu)裝配獲得所需的三維模型。最后參考先前文獻報道[9]的模擬方法,使用曲面命令切割椎體產(chǎn)生0.5 mm骨折線(圖2a),生成T12椎體OVCF骨折的模型。
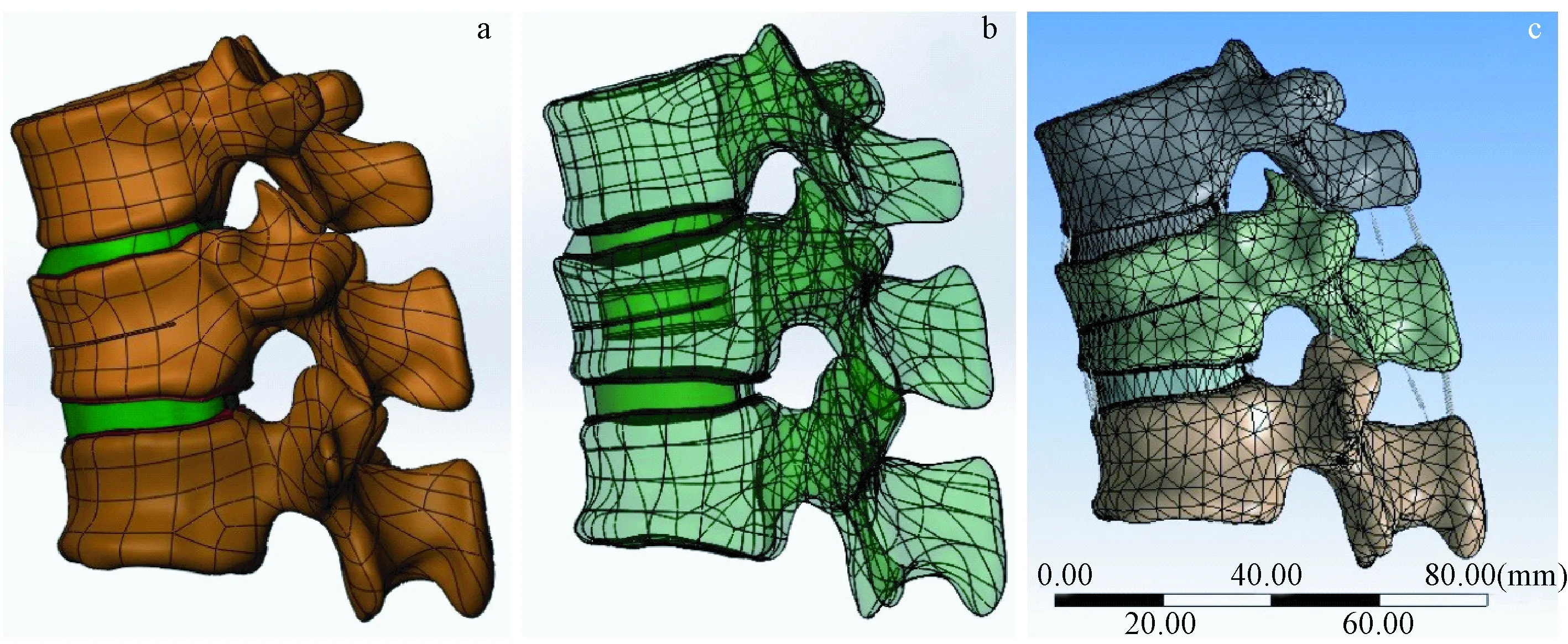
圖2 三維有限元模型的構(gòu)建:a. T11~L1三維模型和T12椎體OVCF模型;b. T11~L1三維模型和T12椎體增強術(shù)后模型;c. T11~L1有限元分析模型.Fig.2 Three-dimensional finite element model: a.T11~L1 three-dimensional model and T12 fracture model; b.T11~L1 three-dimensional model and T12 vertebral body after augmentation; c.T11~L1 finite element analysis model.
1.3 T12椎體強化術(shù)后模型的構(gòu)建
通過Solidworks軟件生成一個體積為4 mL的圓柱體,用于模擬注入后的骨水泥。將之前生成的T12模型導(dǎo)入Solidworks軟件,將骨水泥模型組裝在椎體中央位置,然后通過布爾運算去除多余的骨骼后再將骨水泥模型組裝至椎體空腔處,由此獲得單側(cè)骨水泥注射椎體強化術(shù)后的T12椎體三維模型。之后將T12~L1椎體、骨水泥、椎間盤、終板和軟骨等各種模型進行裝配,生成整體的三維模型(圖2b),最終得到四個強化術(shù)后不同T12椎體高度的三維模型。
1.4 有限元分析前處理
使用ANSYS軟件(版本17.0,ANSYS,Canonsburg,PA,USA)進行FEA分析,首先對三維模型進行FEA前處理。將包括T12~L1椎體、骨水泥、椎間盤、終板和關(guān)節(jié)突關(guān)節(jié)軟骨等部分的三維模型導(dǎo)入ANSYS軟件,補充相關(guān)結(jié)構(gòu),包括前縱韌帶、后縱韌帶、棘間韌帶、棘上韌帶、黃韌帶和關(guān)節(jié)囊。參考近期關(guān)于OVCF研究中所使用的材料屬性對之前構(gòu)建的三維模型各個部分進行材料屬性賦值(表1)[10-13]。所有模型均定義為線彈性、各向同性材料,其中皮質(zhì)骨、松質(zhì)骨、終板、關(guān)節(jié)軟骨和髓核定義為線性各向同性彈性材料的固體單元,前縱韌帶、后縱韌帶、棘間韌帶、棘上韌帶、黃韌帶和關(guān)節(jié)囊的單元類型定義為張力變形無壓縮。網(wǎng)格、節(jié)點和單元由軟件生成,終板、關(guān)節(jié)軟骨、骨折線和椎間盤劃分為2 mm的網(wǎng)格,皮質(zhì)骨、松質(zhì)骨和骨水泥劃分為5 mm的網(wǎng)格。終板與椎體、終板與椎間盤、關(guān)節(jié)軟骨與骨骼之間的連接定義為綁定,關(guān)節(jié)軟骨與關(guān)節(jié)軟骨之間的連接定義為無摩擦(圖2c)。
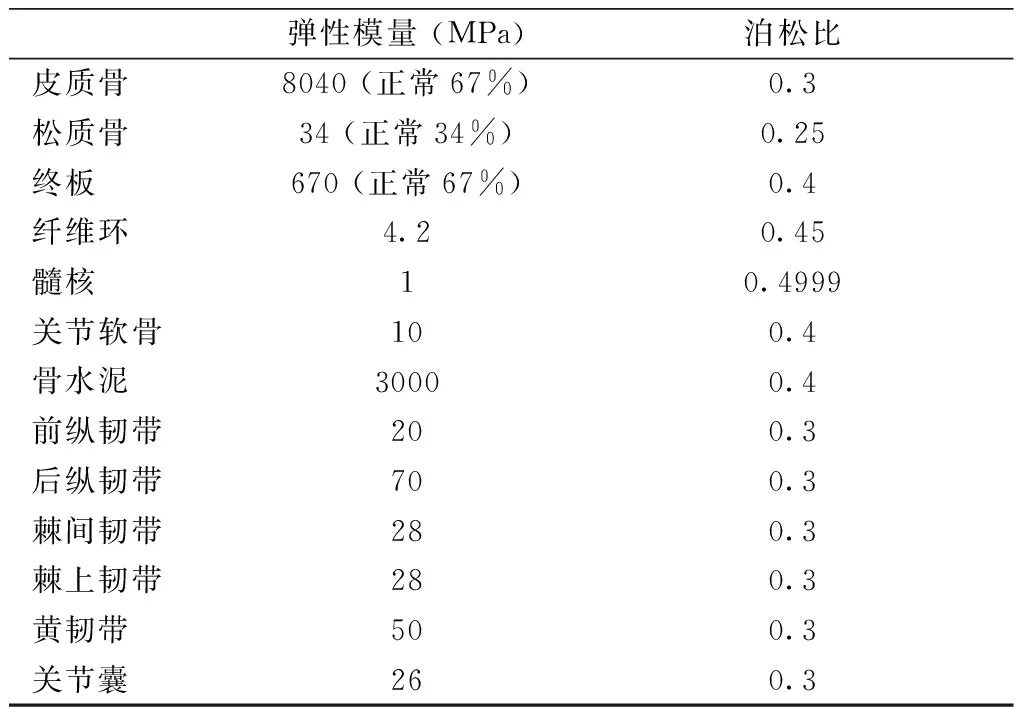
表1 有限元分析模型材料屬性Table 1 Material properties of finite element analysis models
1.5 有限元分析
通過固定L1椎體下終板,自T11椎體上緣分別施加垂直壓縮、屈曲、右側(cè)曲、左側(cè)曲四種不同的載荷,使用四個不同椎體高度T12椎體強化術(shù)后模型進行靜態(tài)有限元分析。所有模型施加500 N的垂直壓縮載荷,7.5 N.m的屈曲、左側(cè)曲、右側(cè)曲扭矩。在T11椎體上終板根據(jù)脊柱三柱理論分配載荷,其中前中柱分配85%,后柱分配15%載荷[9,14-16]。模型的有效性根據(jù)之前發(fā)表的FEA模型驗證,本研究的模型在不同載荷下與文獻[13,17-19]中發(fā)表結(jié)論的相一致。分析結(jié)束時T11和L1椎體應(yīng)力和應(yīng)力云圖結(jié)果通過計算機導(dǎo)出。
1.6 統(tǒng)計分析
提取T12椎體強化術(shù)后位于T11和L1椎體內(nèi)部在不同狀態(tài)下椎體的von Mises應(yīng)力,采用配對t檢驗進行統(tǒng)計學處理,統(tǒng)計分析使用 SPSS軟件(版本14.0,BM Corp.,Armonk,NY,USA),以P< 0. 05 為差異具有統(tǒng)計學意義。
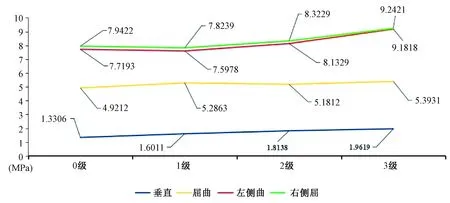
圖3 T12椎體強化術(shù)后T11椎體的von Mises應(yīng)力(MPa)Fig.3 The von Mises stresses on T11 after fresh T12 osteoporotic vertebral compression fracture augmentation (MPa)
2 結(jié)果
2.1 不同T12椎體高度下的T11應(yīng)力
椎體強化術(shù)后T11椎體壓力呈現(xiàn)T12椎體高度丟失越嚴重,椎體承受載荷越大的趨勢(圖3),各種狀態(tài)最大載荷均出現(xiàn)在T12椎體高度為3級時。其中0級的載荷分別是:垂直1.330 6 MPa、屈曲4.921 2 MPa、左側(cè)屈7.719 3 MPa、右側(cè)屈7.942 2 MPa;1級的載荷分別是:垂直1.601 1 MPa、屈曲5.286 3 MPa、左側(cè)屈7.597 8 MPa、右側(cè)屈7.823 9 MPa;2級的載荷分別是:垂直1.813 8 MPa、屈曲5.181 2 MPa、左側(cè)屈8.132 9 MPa、右側(cè)屈8.322 9 MPa;3級的載荷分別是:垂直1.961 9 MPa、屈曲5.393 1 MPa、左側(cè)屈9.181 8 MPa、右側(cè)屈9.242 1 MPa(圖4)。T12不同椎體高度之間T11椎體應(yīng)力差異P>0.05,沒有統(tǒng)計學意義。
2.2 不同T12椎體高度下的L1應(yīng)力
椎體強化術(shù)后L1椎體垂直和右側(cè)屈狀態(tài)壓力呈現(xiàn)T12椎體高度丟失越嚴重,椎體承受載荷越大的趨勢(圖5),T12椎體高度為3級時,垂直和右側(cè)屈均承受最大載荷。其中0級的載荷分別是:垂直1.032 3 MPa、屈曲3.145 7 MPa、左側(cè)屈3.167 7 MPa、右側(cè)屈2.557 8 MPa;1級的載荷分別是:垂直1.154 5 MPa、屈曲3.366 2 MPa、左側(cè)屈2.446 6 MPa、右側(cè)屈2.500 7 MPa;2級的載荷分別是:垂直1.131 2 MPa、屈曲3.051 7 MPa、左側(cè)屈2.113 1 MPa、右側(cè)屈2.644 7 MPa;3級的載荷分別是:垂直2.076 2 MPa、屈曲2.517 8 MPa、左側(cè)屈2.660 7 MPa、右側(cè)屈2.817 1 MPa(圖6)。T12不同椎體高度之間L1椎體應(yīng)力差異P>0.05,沒有統(tǒng)計學意義。
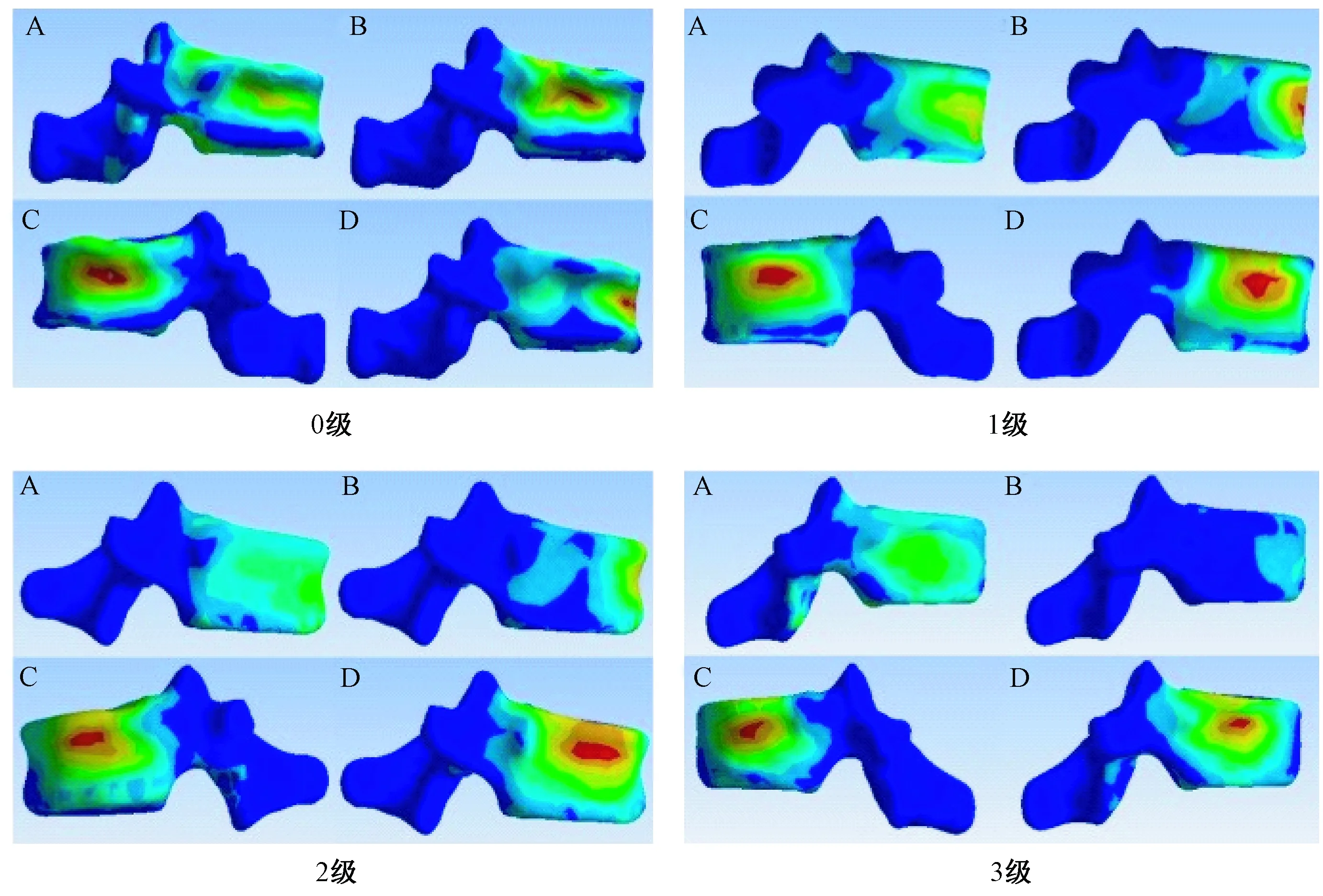
圖4 T12椎體強化術(shù)后T11椎體的von Mises應(yīng)力云圖Fig.4 Images of von Mises stresses on T11 after T12 osteoporotic vertebral compression fracture augmentation
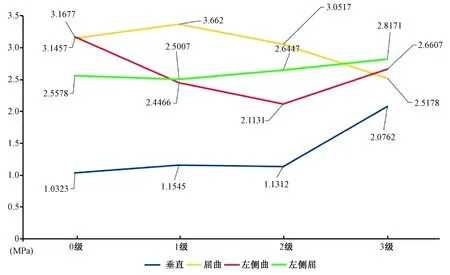
圖5 T12椎體強化術(shù)后L1椎體的von Mises應(yīng)力(MPa)Fig.5 The von Mises stresses on L1 after T12 osteoporotic vertebral compression fracture augmentation (MPa)
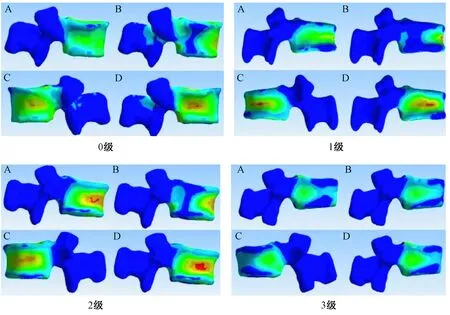
圖6 T12椎體強化術(shù)后L1椎體的von Mises應(yīng)力云圖Fig.6 Images of von Mises stresses on L1 after T12 osteoporotic vertebral compression fractures augmentation
3 討論
OVCF是伴隨著人口老齡化出現(xiàn)的一個重要健康問題[20],由于骨質(zhì)疏松癥患病率和人類預(yù)期壽命的增加,OVCF的發(fā)生率也在上升[21]。雖然OVCF可以常規(guī)進行保守治療,但患者難以耐受長期臥床休息,還可能會導(dǎo)致肺炎,尿路感染,褥瘡和深靜脈血栓形成等各種并發(fā)癥,而傳統(tǒng)的手術(shù)治療也有類似的并發(fā)癥發(fā)生[22]。OVCF的治療需要恢復(fù)椎體高度,然而由于骨質(zhì)疏松癥的影響,一些患者在臨床治療后無法完全恢復(fù)椎體高度。對于OVCF的治療,盡管椎體高度在術(shù)后恢復(fù)的程度不確定,椎體強化技術(shù)仍然是一種微創(chuàng)和有效的手術(shù)方法,PKP和PVP可以通過椎體強化緩解OVCF患者的臨床癥狀,但這些患者的椎體高度并不能完全恢復(fù)[6-7]。
由于患者骨密度的下降,通過手術(shù)方法治療OVCF可能會導(dǎo)致內(nèi)固定松動、骨折復(fù)發(fā)等。而PVP和PKP進行椎體強化后則可以有效的避免這些問題[23]。PKP和PVP可以選擇使用兩種骨水泥注射方法:單側(cè)或雙側(cè)注射,都可以取得良好的臨床效果[4]。PVP和PKP的區(qū)別在于PVP主要通過皮膚小切口穿刺注射骨水泥來穩(wěn)定骨折,而PKP則使用相同的切口后用球囊擴張來更好地恢復(fù)椎體高度[8]。PVP和PKP可以顯著的緩解疼痛,增加預(yù)期壽命,改善脊柱功能[24]。椎體強化術(shù)后,骨水泥可以通過穩(wěn)定骨折裂隙,減少由體重和活動產(chǎn)生的機械應(yīng)力,并且可能通過細胞毒性和骨水泥聚合放熱作用破壞骨骼神經(jīng)末梢而達到鎮(zhèn)痛作用[9]。在我們的研究中,椎體高度的Genant半定量分級在術(shù)前和術(shù)后沒有顯著差異,盡管手術(shù)無法完全恢復(fù)椎體高度,但是臨床癥狀明顯緩解。
PKP的生物力學試驗已經(jīng)證實,骨水泥可以增加椎體骨折的穩(wěn)定性[10-11],PVP或PKP增加了骨折椎體剛度和強度[25-26]。但是,椎體強度增加會導(dǎo)致相鄰椎體的負荷增加,骨水泥量及分布是相鄰椎體發(fā)生骨折的一個重要因素[27],雖然恢復(fù)了椎體高度,但是也會增加再次骨折的風險[28]。用于手術(shù)的生物材料(如骨水泥)的體積和分布也會對模型的機械負荷產(chǎn)生重要的影響[29-30]。FEA能檢測人體標本每個部分內(nèi)在相互作用機制[31],可以有效分析骨質(zhì)疏松椎體骨折的生物力學變化[32]。目前已經(jīng)通過FEA證實椎體強化術(shù)可以恢復(fù)骨折椎體的機械穩(wěn)定性,并預(yù)測到骨水泥增強后骨骼具有長期的穩(wěn)定性[8]。FEA的結(jié)果也證實骨水泥量的增加可以增加相鄰椎體骨折的風險[25],使用大體積的骨水泥對增加繼發(fā)椎體骨折具有顯著影響[33]。然而,這些研究并沒有具體研究椎體強化后骨折椎體不同高度對相鄰椎體生物力學變化的影響。Von Mises應(yīng)力作為一種等效應(yīng)力,常用于生物力學研究中描述骨骼和肌肉的應(yīng)力變化,在我們的研究中,盡管結(jié)果沒有統(tǒng)計學意義,但是仍然可以觀察到,T12椎體高度在椎體強化術(shù)后處于0~3級不同水平,除了L1椎體在屈曲和左側(cè)屈狀態(tài)時,其余均呈現(xiàn)為椎體高度丟失越多,相鄰椎體應(yīng)力越大。該趨勢說明,盡管術(shù)后臨床癥狀緩解效果接近,但是椎體高度恢復(fù)的差異仍然可能會導(dǎo)致相鄰椎體應(yīng)力發(fā)生變化。
4 結(jié)論
通過本研究發(fā)現(xiàn),盡管術(shù)后臨床癥狀緩解效果接近,但是椎體高度恢復(fù)的差異仍然可能會產(chǎn)生相鄰椎體應(yīng)力的變化。其主要的趨勢表現(xiàn)為椎體高度丟失越多,相鄰椎體應(yīng)力越大。因此,在進行椎體強化手術(shù)過程中,為了減少相鄰椎體的應(yīng)力增加,應(yīng)當盡可能的恢復(fù)骨折椎體的椎體高度。

