同型半胱氨酸對FABP4啟動子活性的影響*
熊建團 ,李旭生 ,楊安寧 ,楊松昊 ,鄧梅 ,王磊 ,高源 ,李南 ,楊曉玲 ,賈月霞,姜怡鄧
(1.寧夏醫科大學 藥學院,寧夏 銀川 750004;2.寧夏醫科大學總醫院 骨科,寧夏 銀川750004;3.寧夏醫科大學 基礎醫學院,寧夏 銀川 750004)
脂肪型脂肪酸結合蛋白4(fatty acid binding protein 4, FABP4)屬于脂肪酸結合蛋白大家族的重要成員,主要在脂肪組織中高度表達,在巨噬細胞中也有大量表達[1]。近年來研究表明,FABP4在肥胖和動脈粥樣硬化的發生中發揮重要作用[2]。FABP4表達缺失可通過降低炎癥因子在巨噬細胞中的表達,保護高血脂老鼠避免動脈粥樣硬化的發生[3]。目前國內關于FABP4基因啟動子的研究較少。同型半胱氨酸(Homocysteine, Hcy)是心腦血管疾病的獨立危險因子,通過多種機制影響基因表達,參與疾病發生、發展[4]。本研究以人源FABP4基因為研究對象,成功克隆FABP4基因啟動子,分析確定影響FABP4基因啟動子活性的核心區域,為進一步開展功能研究提供實驗基礎。
1 材料與方法
1.1 主要設備和試劑
L-Hcy和佛波酯(phorbol 12-myristate 13-acetate,PMA)(德國Sigma-Aldric公司),二氧化碳CO2培養箱HF90(上海力新儀器有限公司),胎牛血清(杭州四季青生物工程材料有限公司),青霉素、鏈霉素、PBS緩沖液、DMEM和RPMI 1640培養基購自美國HycLone公司,相差顯微鏡(日本尼康公司),熒光素酶檢測儀器(美國普洛麥格公司),PrimeSTAR HS DNA polymera(大連寶生生物工程公司有限公司),限制性內切酶Xhol、Hind Ⅲ、T4 DNA快速連接酶、DNA Marker及轉染試劑LipofectamineTM3000購自美國Invitrogen公司,DNA提取試劑盒、凝膠回收純化試劑盒、DNA純化試劑盒及雙熒光素酶檢測試劑盒購自美國普洛麥格公司,質粒純化試劑盒(北京天根生化科技有限公司),pGL3-Basic質粒、pRL-TK質粒由本實驗室保存,HEK-293A細胞(四川大學華西醫學院),實驗中所用引物及測序由上海英俊生物有限公司完成。
1.2 啟動子序列分析
根據GenBank中人FABP4基因的序列(GenBank:CR456903.1),查找啟動子區2 000 bp區域,分別根據http://fruitfly.org:9005/seq_tools/promoter.html、http://www.urogene.org/methprimer/index1.html網站預測啟動子結合序列和甲基化島分布情況的結果。
1.3 FABP4基因啟動子報告基因載體的構建
將人FABP4啟動子初步分為4個片段,分別為 -500/-1、-1000/-1、-2000/-1、-2000/-1501, 利用Primer 5設計合成4對特異引物獲得相應片段,并在5’端和3’端分別添加Xhol和Hind Ⅲ酶切位點,引物序列見附表。將目的片段從亞克隆載體上切割并回收,回收目的片段并與pGL3-Basic載體連接,利用雙酶切方法篩選并測序鑒定。

附表 FABP4基因啟動子片段引物設計
1.4 細胞培養
HEK-293A工具細胞使用DMEM培養基,THP-1單核細胞使用RPMI 1640培養液,均含12%胎牛血清。于37℃、5% CO2環境中靜置培養。以500 nmol/L PMA培養液孵育THP-1單核細胞48 h,單核細胞即分化為巨噬細胞,然后給予不用濃度(0、50、100、200和500μmol/L)Hcy干預24 h后進行后續實驗。
1.5 FABP4基因啟動子活性分析
將細胞接種于6孔板中,待細胞生長至80%匯合時,采用LipofectamineTM3000轉染細胞。轉染DNA總量為2μg/孔,pGL3-FABP4不同大小片段質粒與海腎熒光素酶報告基因載體(pRL2TK)的比值為100∶1。將海腎熒光素酶報告基因載體作為內源參照,以消除由于轉染效率及細胞活性等因素帶來的差異。轉染48 h后,按照Promega公司熒光素酶報告基因檢測試劑盒說明書,進行熒光素酶活性檢測。實驗重復6次,每次3個平行實驗,啟動子相對活性以目的基因熒光與海腎熒光的比值(Fluc/Rluc)表示。
1.6 統計學方法
數據分析采用GraphPad Software 6.0統計軟件,計量資料以均數±標準差(±s)表示,多組比較用方差分析,兩兩比較用SNK–q檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 FABP4基因核心啟動子預測分析
通過BDGP生物信息學網站預測,發現在FABP4啟動子區2 000 bp的范圍內含有2個可能的核心啟動子位點,并且得分均>0.95(滿分1.00分)。見圖1。

圖1 FABP4基因核心啟動子預測分析
2.2 FABP4基因啟動子區CpG島生物學預測
通過Methprimer網站預測,筆者觀察到在FABP4啟動子區2 000 bp范圍內沒有CpG島的存在,但是有一段CpG二核苷酸位點相對集中的區域,并且可以在這個相對集中的區域設計甲基化與非甲基化引物,觀察FABP4基因啟動子甲基化程度的改變。見圖2。
2.3 FABP4基因啟動子轉錄起始位點的預測
用生物信息學方法進行分析比對FABP4基因啟動子2 000 bp序列,發現在位于轉錄起始的-67堿基位置和轉錄起始的-1548堿基位置含有CAAT盒,而位于轉錄起始的-808堿基位置含有TATA盒。見圖3。
2.4 FABP4基因啟動子區不同截取片段PCR產物
通過普通PCR擴增得到與預測截取片段大小相等且規整單一的PCR產物。其中,-2000/-1501片段組、-500/-1片段組、-1000/-1片段組、-2000/-1片段組長度分別為500、500、1 000和2 000 bp。見圖4。
2.5 FABP4基因啟動子不同截取片段pGL3載體雙酶切結果
將構建好的FABP4基因啟動子不同截取片段pGL3載體經Hind和Xhol雙酶切后用電泳法分離,均被切出大小約4 000 bp的大片段條帶和與之相對應的與PCR產物相大小一致的小片段條帶。其中,-2000/-1501片段組、-500/-1片段組、-1000/-1片段組、-2000/-1片段組長度分別為500、500、1 000和2 000 bp。大片段的條帶與pGl3空載體Hind、Xhol雙酶切后的產物大小一致。見圖5。
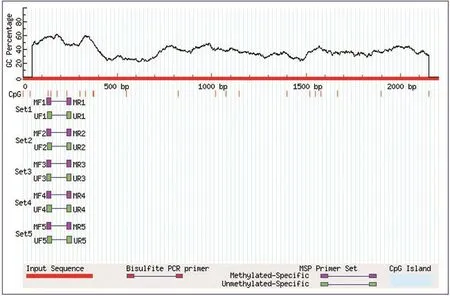
圖2 FABP4基因啟動子區CpG位點分析

圖3 FABP4基因啟動子區轉錄起始位點預測

圖4 各FABP4基因啟動子片段擴增

圖5 各FABP4基因啟動子片段酶切鑒定
2.6 FABP4基因啟動子不同截取片段的熒光素酶活性
以HEK-293A細胞為工具細胞,分別轉入不同長度的FABP4啟動子截取片段,檢測相應片段的螢光素酶活性,-2000/-1501片段組、-2000/-1片段組、-1000/-1片段組、-500/-1片段組細胞中相對熒光素酶活性分別為(0.2103±0.02741)、(0.3203±0.02978)、(0.1542±0.05314)和(0.2595±0.02686),經單因素方差分析,差異有統計學意義(F=16.900,P=0.000),提示不同長度FABP4啟動子截取片段可能具有不同的啟動活性。進一步兩兩比較經SNK–q檢驗,-500/-1片段組、-2000/-1片段組、-2000/-1501片段組啟動活性高于pGL3對照組(P=0.002、0.001和0.011),其中-2000/-1片段組轉錄活性最強。見圖6。
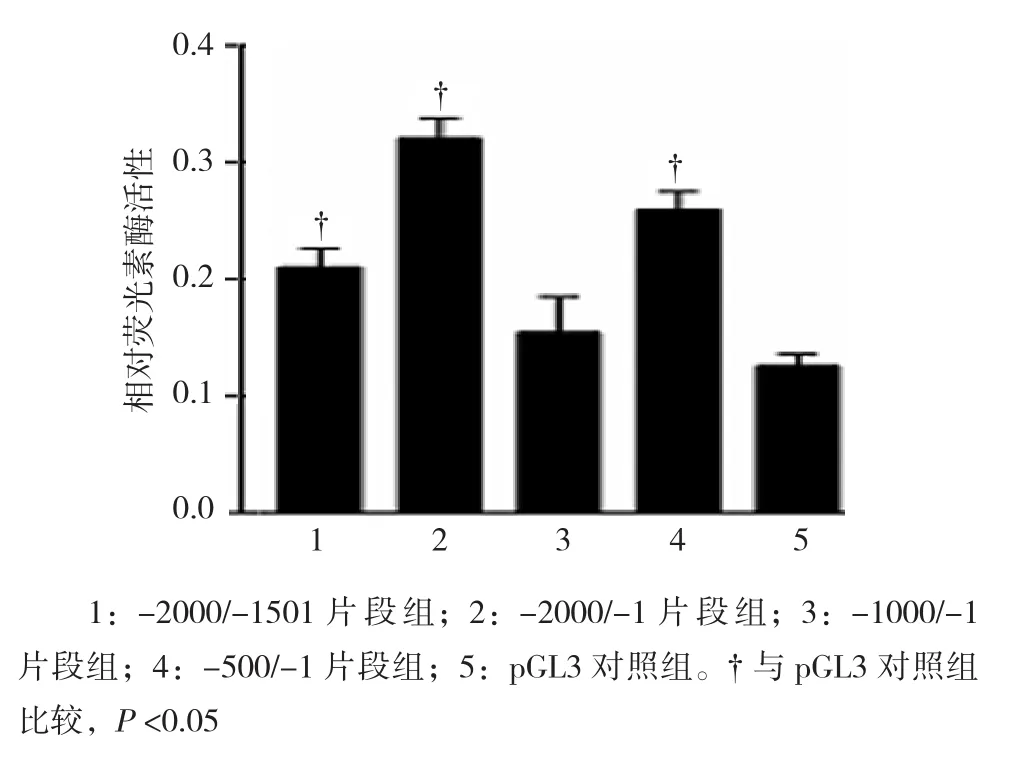
圖6 各FABP4基因啟動子片段熒光素酶活性檢測
2.7 Hcy和5-氮雜胞苷對FABP4基因啟動子的作用
將FABP4基因核心啟動子-2000/-1片段轉染巨噬細胞,并用不同濃度Hcy和5-氮雜胞苷(5-azacytidine, AZC) 干 預 后,0、50、100、200和500μmol/L Hcy組,以及100μmol/L Hcy+AZC組細胞中相對熒光素酶活性分別為(1.260±0.5585)、(1.430±0.1383)、(4.386±0.1711)、(4.029±0.1673)、(1.582±0.1952)和(5.265±0.3834),經單因素方差分析,差異有統計學意義(F=98.000,P=0.000)。進一步兩兩比較經SNK–q檢驗,50和500μmol/L Hcy組與0μmol/L Hcy組比較,差異無統計學意義(P=0.636和 0.400);100和 200μmol/L Hcy組高于0μmol/L Hcy組(均P=0.001);100μmol/L Hcy組用DNA甲基轉移酶抑制劑AZC作用后,FABP4基因啟動活性升高(P=0.002),提示Hcy可以增加巨噬細胞內FABP4核心啟動子片段的活性,而DNA甲基轉移酶抑制劑AZC可以進一步促進Hcy對FABP4啟動子活性的影響。見圖7。
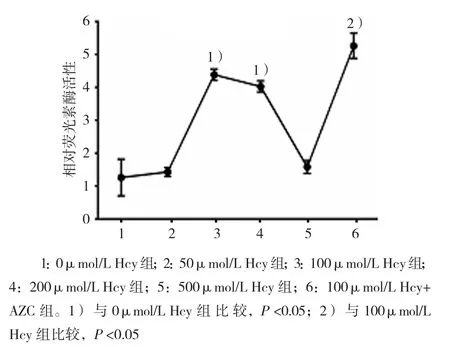
圖7 不同濃度Hcy對FABP4基因核心啟動子活性的影響
3 討論
本研究發現人FABP4基因2 000 bp長度的啟動子區含有3個轉錄起始結合位點,即由2個啟動子區負責轉錄調控,分別位于-2000/-1051、-500/-1和-1000/-500區域,分別為-2000/-1051區域CAAT盒(序列為CCAAT)、位于-500/-1區域CAAT盒(序列為CCAAT)和-1000/-500區域的TATA盒(序列為TATAAAA)。一般真核生物中蛋白質編碼基因的核心啟動子元件分4類:①傳統的TATA盒;②上游核心啟動子元件;③下游啟動子元件;④起始子。起始子只起轉錄起始并無轉錄調節作用,而上游啟動子元件包括CAAT盒和GC盒等,能通過TFⅡ-D復合物的識別和結合來調節轉錄起始的頻率,從而提高轉錄效率,但并不是所有啟動子都含有這些轉錄基本元件[5]。
CAAT盒是轉錄因子CBF在DNA序列上的識別結合位點,其序列格式為CCAAT。CAAT盒位于所轉錄的真核生物基因的近端啟動子,與其他啟動子元件相互調節而發揮作用,通過控制轉錄起始的頻率從而控制啟動子的轉錄活性,是真核生物基因常有的基本轉錄區[6]。而TATA盒是另一個重要基礎元件,是轉錄因子TBP識別的DNA序列,其序列格式通常為TATAWAW(W代表A或T)。通常認為,含有TATA盒的啟動子可能參與組織特異性基因的轉錄調控,而TATA盒本身并無轉錄活性,如果表現出轉錄活性需要其他結構基因共同調控[7]。在FABP基因2 000 bp啟動子區內,CAAT盒位于轉錄起始的-67堿基位置和轉錄起始的-1548堿基位置,對應存在的片段為-500/-1片段和-1501/-2000即表現出來轉錄活性,可以推測FABP4基因是由CAAT盒組成的核心啟動子。而TATA盒則位于轉錄起始的-808堿基位置,存在于-1000/-1片段內而無轉錄活性,則TATA盒在FABP4轉錄中可能未起到轉錄活性作用。
基因啟動子和豐富的CpG序列(GC位點通常未甲基化)中的甲基化修飾被認為與基因表達調控高度相關,是體內重要的轉錄調控方式[8]。一般來說,CpG島通常是基因中GC含量為60%、CpG出現率達到0.65、長度為500 bp的序列,就算這些區域沒有CpG島也有豐富的CpG位點,可被甲基化修飾調控[9]。在FABP4基因啟動子區里,GC含量相對較少,約為38%,在-2000/-1501片段中GC相對集中,含量也僅有47%,因此,FABP4基因啟動子不含CpG島,其調控可能受到散在分布的GC靈活調控。FABP4基因啟動子可能是組織特異性表達的基因啟動子,CpG位點參與基因表達調控的因素之一。-2000/-1501片段的轉錄活性高于對照組。由此證明,FABP4基因本身CpG位點相對集中區域也具有啟動基因表達的能力。-2000/-1片段轉錄活性高于-500/-1片段,可以推測CpG對FABP4基因啟動子轉錄調控起一定促進作用,參與FABP4基因表達調控。本研究還發現,FABP4基因啟動子-1000/-500片段含有2個AML-1a結合區域(序列分別ACACAC和ACATAA)。AML-1a是一種具有與DNA結合的空間結構域,其缺乏相應轉錄激活結構域的轉錄調節蛋白,導致靶基因不能正常轉錄的機制可能是:一方面,AML-1a與DNA結合的結構域能夠和AMLlb/lc競爭結合靶基因DNA結合位點,從而抑制轉錄;另一方面,AML-1a通過改變基因CpG位點中胞嘧啶(C)甲基化修飾生成5-甲基胞嘧啶(5mC)調控基因轉錄,該過程在轉錄調控中最早發生,隨后通過激活或抑制轉錄因子與DNA結合而調節基因轉錄,這一調控主要集中在GC位點密集區[10]。實驗中FABP4基因啟動子-1000/-1片段的轉錄活性低于-500/-1片段,但熒光素酶活性與對照組比較無變化。由此推測FABP4基因-1000/-1片段啟動轉錄過程中可能有負相關調節轉錄因子參與,或者有相關沉默子起關鍵作用。AML-1a是否是負責FABP4基因負調控主要的因子及相關轉錄沉默子的有待進一步研究。同時,包含豐富CpG-2000/-1501片段的-2000/-1片段活性與-1000/-1片段相比又進一步增強,推測-2000/-1501片段對FABP4基因啟動子轉錄活性有非常重要的作用。此外,對照載體pRL-TK所攜帶的啟動子是HSV1-tk基因自身啟動子,屬中等強度啟動子[11]。實驗中筆者發現FABP4基因啟動子的啟動活性均<40%TK啟動活性,由此推測FABP4基因啟動子啟動基因表達能力較弱。使用不同濃度Hcy干預細胞后,100μmol/L Hcy組啟動活性最強。Hcy在體內主要通過2種方式進行代謝:當蛋氨酸過量時,同型半胱氨酸通過轉硫化通路代謝,生成胱硫醚(維生素B6為輔助因子),繼而轉變為半胱氨酸;當蛋氨酸含量較低時,Hcy主要通過蛋氨酸循環途徑進行代謝[12]。SAM協助調解的Hcy被再甲基化形成蛋氨酸需要甲基四氫葉酸和維生素B12作為輔助因子,而自然界真核細胞內甲基化修飾反應唯一甲基來源只有SAM[13]。由此推斷,當Hcy濃度過高時,迅速消耗培養基中的葉酸和維生素B12,SAM產生減少,FABP4啟動子CpG轉甲基減少,DNA發生去甲基化,使轉錄增強。給予葉酸和維生素B12干預后,啟動子活性約降低10%,說明補充一定量的葉酸和維生素B12后,SAM產生進一步增多,轉甲基能力增強,DNA發生甲基化位點增多,使轉錄減低。
綜上所述,本實驗證實FABP4基因啟動子屬于弱啟動子,FABP4基因核心啟動子由CAAT盒組成,部分CpG位點參與FABP4基因轉錄調控,AML-1a可能是調控FABP4基因轉錄的負性轉錄因子,而CpG位點與轉錄因子、沉默子的相互作用有待進一步研究。本研究為進一步研究FABP4基因的功能提供實驗基礎。

