不同鮮食葡萄品種的高溫逆境應答反應研究
查 倩,奚曉軍,和雅妮,蔣愛麗
(上海市農業科學院林木果樹研究所,上海 201403)
溫度是影響葡萄生長發育和產量品質的主要因子,夏季持續的高溫環境會影響葡萄植株生長和果實發育,表現為葉片卷曲失水干枯,果實出現較為嚴重的日灼[1],造成不可逆的經濟損失。
高溫逆境會破壞植物體內活性氧的平衡狀態,屬于氧化還原脅迫[2-4]。植物往往通過提高抗氧化酶活性,減少自由基的傷害,來應答逆境[5-6]。超氧化物歧化酶(SOD)、抗壞血酸過氧化物酶(APX)和過氧化氫酶(CAT)等均參與植物抗氧化反應[7],大多數植物SOD、POD(過氧化物酶)、CAT的酶活性在高溫下表現出增多現象[8-9],并且高溫會導致植物組織中的丙二醛(MDA)等有害物質增多[10]。
此外,高溫逆境下植物會產生一系列生理生化過程,其中光合作用最為敏感[11],研究表明高溫處理會破壞PS II光化學系統,尤其表現在抑制植物光合電子傳遞,降低葉片光化學效率,導致植物不能有效利用吸收的光能,最終破壞光合中心機構[12-15]。高溫脅迫誘發有機體合成一系列熱激蛋白HSPs,其中分子量為15—30 ku的蛋白是sHSPs,會參與保護PS II光化學反應[16-17]。目前,sHSPs蛋白與植物耐熱性相關研究較多[18-19]。
孫軍利等[20]研究認為葡萄高溫逆境與氧化還原平衡關系密切,Luo等[21]發現葡萄葉片的光合作用受溫度影響顯著。我國南方地區主要種植歐美雜種系葡萄品種,并常出現40 ℃以上極端高溫天氣,不同葡萄品種在高溫逆境下的差異應答反應的比較目前還沒有報道。為了探明不同遺傳背景葡萄品種的高溫應答過程,本研究開展了歐美雜種系葡萄高溫逆境應答反應研究,以便為南方地區葡萄產業的健康發展提供理論參考。
1 材料與方法
1.1 試驗材料與設計
試驗于2014年12月—2015年10月在上海市農業科學院進行。葡萄品種有‘巨峰’‘巨玫瑰’‘醉金香’‘夏黑’‘申豐’‘申華’和‘滬培1號’,均屬于歐美雜交品種(V.Vinifera×V.LabruscaL.)。
將一年生盆栽葡萄扦插苗種植于直徑30 cm、高度40 cm的塑料盆內,培養介質為椰糠∶腐殖土 = 1∶1。試驗在智能人工氣候培養箱(PRX-1000C,杭州錢江儀器設備有限公司)中進行,設定白夜持續時間分別為14 h10 h,相對濕度保持在65%—70%,白夜溫度保持在(25±1) ℃(20±1) ℃,光合有效輻射為 200 μmol·m-2·s-1。
待植株長至20—25片功能葉完全展開時進行25 ℃、35 ℃、45 ℃溫度處理,設置處理時間為每天的10:00—16:00,其他時間段(白夜)溫度保持(25±1) ℃(20±1) ℃。每個小區選5株葡萄,設置3個小區。不同溫度梯度分別處理3 h、6 h及150 h后,選第7—9片功能葉進行無損傷的葉綠素熒光測定,重復10次,并取葉片凍存在-70 ℃超低溫冰箱內,用于SOD活性、MDA含量和HSP21蛋白表達的檢測,重復3次。
1.2 測定方法
1.2.1 抗氧化酶(SOD)活性及丙二醛(MDA)含量測定
超氧化物歧化酶(SOD)活性測定采用氮藍四唑NBT法[22];丙二醛(MDA)含量測定采用硫代巴比妥酸TBA顯色法[23]。
1.2.2 葉綠素熒光參數的測定
利用連續激發式熒光儀(Pocket PEA,Hansatech,英國)無損傷測定葡萄葉片葉綠素快相熒光動力學參數,測定前進行20min暗適應處理,OJIP曲線由3 000 μmol·m-2·s-1紅光誘導,測定時間為1s。
葉綠素熒光各參數意義:FvFm=ΦPo為PSII光化學反應中最大光化學效率;PIABS為以吸收光能為基礎的性能指數;ΨEo為反應中心捕獲的激子中用來推動電子傳遞時到電子傳遞鏈中超過QA的其他電子受體的激子占用來推動QA還原激子的比率;ΦEo為用于電子傳遞的量子產額;Wk為K相可變熒光占J相可變熒光的比例;RCQA為單位反應中心激活PSII反應中心的能量;δRo為電子從系統間電子傳遞體傳遞給光系統I(PS I)受體側電子受體的概率[13]。
1.2.3 HSP21蛋白表達分析
采取有機溶劑法提取蛋白質[24],并用BCA蛋白定量試劑盒測定蛋白濃度。提取的20μg蛋白樣品在質量分數為12% SDS-PAGE配置膠中電泳后轉膜,封閉后加入一抗Anti-HSP21(Abcam,England,1∶3 000)[25],4 ℃孵育過夜后加入二抗Anti-rabbit IgG(H+L)(CST,USA,1∶1 000),室溫放置1 h后,浸于電化學發光試劑中顯色。
1.3 統計學分析
利用SPSS 15.0對數據進行統計學分析,P<0.05表示差異顯著。
2 結果與分析
2.1 高溫逆境下不同葡萄品種的表型變化
在25 ℃和35 ℃處理下,各品種葡萄植株生長狀態和表型較為良好。45 ℃處理6 h時‘申華’和‘夏黑’頂梢和幼嫩葉片表現出失水枯萎癥狀,但仍然有健康的功能葉片,并持續到150 h時;45 ℃處理3 h時,‘巨峰’和‘巨玫瑰’頂梢就出現失水枯萎癥狀,6 h后植株大面積的失水枯萎,150 h表現為整株干枯;‘申豐’‘醉金香’和‘滬培1號’在45 ℃處理3 h時植株葉片出現大面積失水枯萎,6 h后整株干枯。觀察表型變化可知‘申華’和‘夏黑’品種的幼樹具有較好的抗高溫性能(圖1)。

A—G為25 ℃ 處理下的‘申華’‘夏黑’‘巨峰’‘巨玫瑰’‘申豐’‘滬培1號’‘醉金香’;a—g為45 ℃處理下‘申華’‘夏黑’‘巨峰’‘巨玫瑰’‘申豐’‘滬培1號’‘醉金香’圖1 25 ℃和45 ℃處理下6 h時不同葡萄品種表型觀察Fig.1 The phenotypic observation of different grape cultivars at 6 h under 25 ℃ and 45 ℃ treatments

圖2 不同溫度處理下不同葡萄品種SOD活性變化Fig.2 The changes of SOD activity in different grapecultivars under different temperature treatments
2.2 高溫下不同葡萄品種SOD活性和MDA積累量的變化
如圖2所示,‘申華’的SOD活性在35 ℃處理6 h時增強明顯,150 h時恢復至原初水平,45 ℃處理 3 h時SOD活性最高,隨后恢復至原初水平;‘夏黑’的SOD活性在35 ℃下變化不明顯,而45 ℃處理 3—6 h時略有降低;‘巨峰’‘巨玫瑰’和‘滬培1號’在高溫下SOD活性變化均不明顯;‘申豐’和‘醉金香’在35 ℃處理SOD活性變化不大,而在45 ℃處理3 h時SOD活性較高。以上可知,高溫逆境下不同葡萄品種氧化還原平衡調節方式有所不同。
由圖3可知,‘申華’在高溫處理下(35 ℃、45 ℃)MDA含量沒有出現明顯的變化;‘夏黑’和‘巨玫瑰’在35 ℃和45 ℃處理下MDA含量均有增加的現象;‘巨峰’‘申豐’‘滬培1號’僅在45 ℃處理MDA含量增加,其中‘滬培1號’表現最為明顯;‘醉金香’在高溫處理下MDA含量變化不顯著。

圖3 不同溫度處理下不同葡萄品種MDA含量變化Fig.3 The changes of MDA in different grapecultivars under different temperature treatments
2.3 高溫對不同葡萄品種葉綠素熒光參數的影響
由圖4可知,與25 ℃處理相比,7個品種在35 ℃處理下FvFm值沒有顯著變化,但在45 ℃處理下不同品種間FvFm值的變化不同。‘申華’在45 ℃處理3 h時FvFm值下降,6 h時有所恢復,150 h時恢復至原初水平;‘夏黑’在45 ℃處理3 h和6 h時FvFm值在降低,150 h時也恢復至原初水平;‘巨峰’在45 ℃處理3 h至6 h時FvFm值持續下降;‘巨玫瑰’45 ℃處理3 h時FvFm值下降,并在6 h時恢復至原初水平;‘申豐’‘滬培1號’和‘醉金香’在高溫3 h時FvFm值都明顯下降。由上可知,45 ℃處理3 h時葡萄葉片PS II反應中心較為活躍。

圖4 不同溫度處理下不同葡萄品種FvFm值變化Fig.4 The changes of FvFm in different grape cultivars under different temperature treatments
由表1可知,35 ℃處理下不同葡萄品種的PS II活性未受到顯著影響,僅‘巨峰’的部分參數值在35 ℃處理3 h時增多,已知PIABS值由光能的吸收效率(ΦPo)、反應中心對光能的轉換效率(ΨEo)及電子傳遞效率(ΦEo)組成,說明一定程度的高溫逆境會增強‘巨峰’PS II反應中心的光能轉換效率和電子傳遞效率,除‘巨蜂’外的其他6個品種35 ℃處理的PIABS值與25 ℃處理無明顯差異。但在45 ℃處理下7個葡萄品種的PIABS值均減少,其中‘申華’‘夏黑’‘巨峰’和‘巨玫瑰’的PIABS值降至0.2—0.6,‘申豐’‘滬培1號’和‘醉金香’的PIABS值降至0.0—0.2,同時伴隨著ΦPo、ΨEo和ΦEo值的減少,說明極端高溫(45 ℃)會降低反應中心的光能吸收效率和后續過程效率。
35 ℃高溫下7個葡萄品種的Wk、δRo和RCQA值與25 ℃無明顯差異,但在45 ℃高溫下7個品種的Wk值和δRo值幾乎均顯著性增多,而RCQA值均有明顯減少,其中‘申豐’‘滬培1號’和‘醉金香’的變化幅度更大。
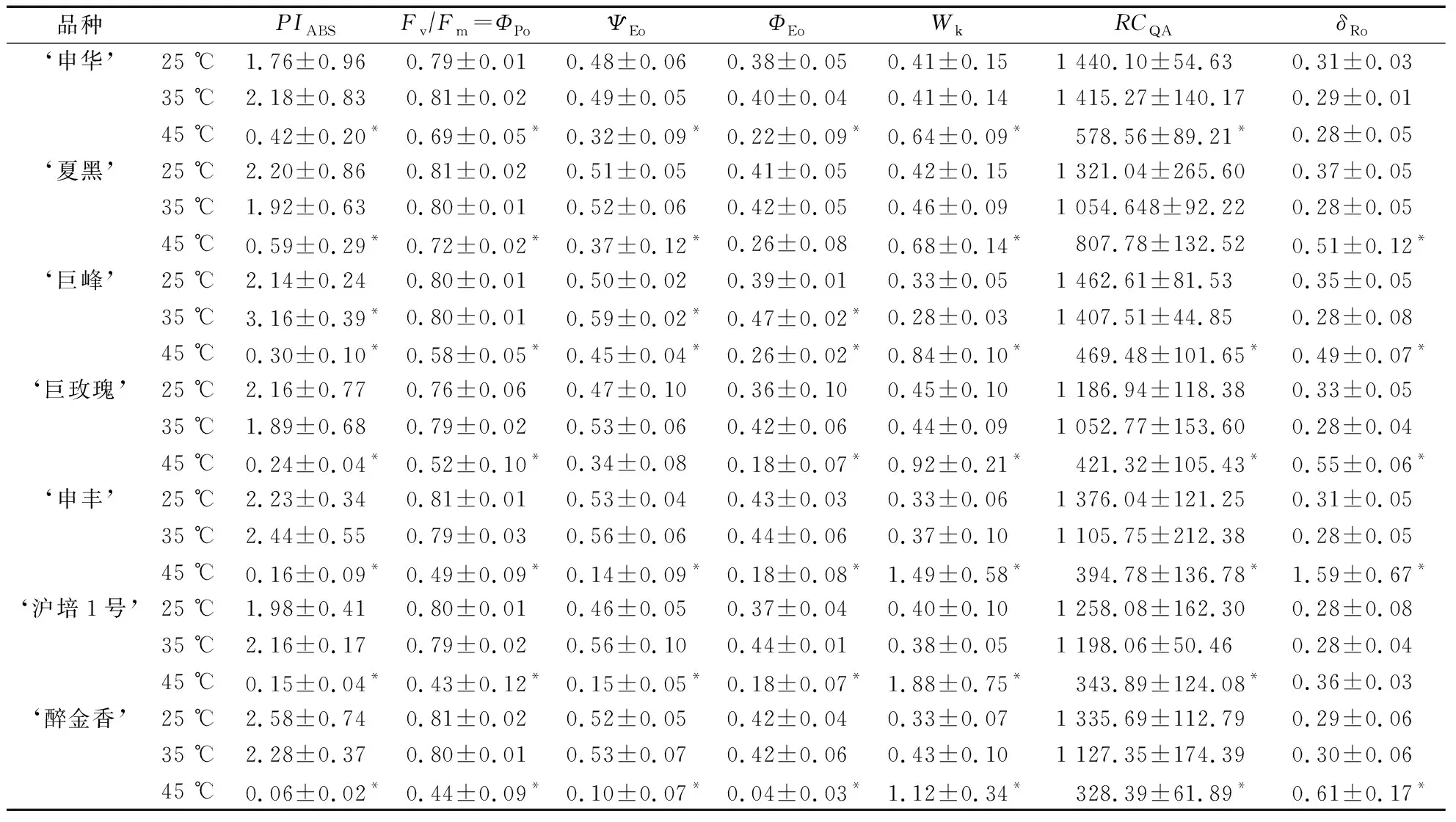
表1 不同溫度處理3 h時不同葡萄品種其他熒光參數比較
注:*表示一個參數在同一葡萄品種中其他溫度處理與25 ℃處理間的顯著性差異(P<0.05)
2.4 高溫逆境下抗逆蛋白HSP21表達量變化
45 ℃處理逆境響應蛋白HSP21表達的檢測見圖5,結果表明:HSP21的蛋白表達與處理時間和葡萄品種均有關系,處理3—6h,‘申華’ HSP21蛋白持續積累,6 h時最多,150 h時略有減少;‘夏黑’3 h時有較小幅度的積累,6—150 h積累量顯著減少;‘巨峰’高溫下3—6 h,蛋白積累增多;‘巨玫瑰’在3 h時蛋白積累較明顯;‘滬培1號’‘醉金香’和‘申豐’這3個品種在高溫處理后HSP21蛋白量減少明顯,這可能與不同品種的耐高溫能力差異有關。

圖5 45 ℃處理下不同葡萄品種HSP21蛋白表達Fig.5 The HSP21 levels of different grape cultivars under 45 ℃ treatment
3 討論與結論
熱害是植物對高溫逆境最為直觀的反應,本研究發現,在25 ℃、35 ℃處理下7個鮮食葡萄品種的植株形態表現均良好。45 ℃處理下不同品種表現不同,‘夏黑’和‘申華’在處理3—6 h時有失水萎蔫出現,在150 h時得到恢復,‘巨峰’和‘巨玫瑰’在處理6 h時葉片大面積失水干枯,處理3 h時‘滬培1號’‘醉金香’和‘申豐’葉片就會大面積失水直至干枯。綜上,7個品種中‘夏黑’和‘申華’在極端高溫(45 ℃)下植株的形態表現良好,‘巨峰’和‘巨玫瑰’次之,‘滬培1號’‘醉金香’和‘申豐’表現差。
高溫逆境下,植物葉片氧化脅迫加劇,MDA等有害物質含量上升,植物通過增強SOD等抗氧化酶活性,可在一定程度上清除過多的有害物質,維持膜系統的穩定性,進而保護葉片光合系統的正常運轉[26],本研究中的葡萄SOD活性受高溫誘導增多,但不同品種表現不一致。并且,高溫逆境下‘申豐’‘滬培1號’‘醉金香’3個品種的MDA含量顯著增加,這與酶蛋白失去活性有關[27]。由上可知,高溫脅迫下SOD活性和MDA含量的變化與品種的耐熱差異性有關[28]。
高溫逆境會傷害植物的光合機構,降低植物的PSII光化學效率[29-30]。本研究表明,35 ℃高溫處理下‘巨峰’的PIABS、FvFm(ΦPo)、ΨEo和ΦEo有所增加,其他葡萄品種的葉綠素熒光參數均無明顯變化。Luo等[21]認為在35 ℃和38 ℃處理下,‘京秀’葡萄的PSII光化學效率均與對照處理沒有顯著性差異[21]。推斷在40 ℃處理下,一些葡萄品種可通過自身的耗散機制來消耗過剩能量[31],不對葡萄葉片的光合原初反應造成影響。但是,45 ℃處理3 h即可明顯影響葡萄葉片的光化學反應PSII活性。葡萄、柑橘、甜椒等植物受到高溫脅迫后FvFm會顯著下降[32-34],與本研究結果一致。本研究還發現,‘申華’‘夏黑’‘巨峰’和‘巨玫瑰’的ΦPo、ΨEo、ΦEo和PIABS值降幅水平顯著低于其他品種,說明這4個品種的PS II受逆境影響較小。不同葡萄品種葉片PS II的供體側指標Wk、受體側指標δRo及反應中心指標RCQA在45 ℃處理3 h時表現出顯著性差異說明PS II的供體側和受體側發生能量和電子轉移的紊亂,導致反應中心中用于激活PS II化學反應的能量減少。對‘左優紅’和‘京秀’葡萄的研究也有相同報道[21,25]。‘申豐’‘滬培1號’和‘醉金香’的Wk、δRo和RCQA值變化幅度較其他品種更為顯著,說明這3個品種的PS II光化學反應對高溫更為敏感,光合系統受到的破壞更大。
此外,‘夏黑’和‘申華’在45 ℃處理150 h后葉綠素熒光參數值和抗氧化酶活性均恢復到正常水平值,這可能與植株的耐熱潛能被激發有關,所以這2個品種表現出較強的高溫耐性。
Zha等[35]認為HSP21與高溫逆境是存在正比關系的,sHSPs蛋白參與植物葉片的PS II反應,能有效地提高植物的耐熱性[36-37],在高溫脅迫中上調表達可能有利于保護植物葉片功能。本研究中高溫處理下‘申華’和‘巨峰’品種的HSP21蛋白水平增多,時間上表現出緩慢積累性和持續性。‘夏黑’和‘巨玫瑰’的HSP21蛋白水平在45 ℃高溫處理后表現為先增加后降低,‘滬培1號’‘醉金香’和‘申豐’的HSP21蛋白在45 ℃高溫處理3 h時降低,說明高溫處理下葉片失水嚴重,對蛋白積累也造成影響,所以不同品種應答高溫逆境是存在差異的,這些差異可能源于品種間不同的遺傳背景。
綜上可知,高溫脅迫會破壞葡萄葉片的光化學反應和氧化還原平衡,不同鮮食葡萄品種均發生不同程度高溫逆境應答反應。從植株的生長狀態、抗氧化酶活性、PS II活性等指標變化來看,7個品種對高溫逆境應答反應的穩定性較好的為‘申華’和‘夏黑’,其次是‘巨峰’和‘巨玫瑰’,‘滬培1號’‘申豐’和‘醉金香’較差。

