構建及應用針對非小細胞肺癌整合素αvβ3受體靶向性納米分子探針:體外實驗研究
沈愛軍,張旭南,李永勇,馮 峰,張建泉,王培軍*
(1.同濟大學附屬同濟醫(yī)院影像科,上海 200065;2.南通大學附屬腫瘤醫(yī)院影像科,江蘇 南通 226361;3.同濟大學醫(yī)學院生物醫(yī)學工程與納米科學研究院,上海 200092)
在我國,肺癌的發(fā)生率和致死率高居惡性腫瘤首位[1],早期、精準診斷以及準確評估肺癌惡性程度和轉移可能性,對于降低患者死亡風險、改善預后具有重要意義。整合素家族中的αvβ3亞型在非小細胞肺癌(non-small cell lung cancer, NSCLC)中呈高表達,并與腫瘤增殖、侵襲及轉移能力相關[2-4]。通過檢測肺癌組織中整合素αvβ3的表達情況,可以實現對肺癌的精準診斷和風險評估。但是,目前檢測肺癌組織中整合素αvβ3的表達基本依賴于組織學方法,須手術或活檢后才能獲得結果。分子影像學的興起,特別是各種新型納米分子成像探針的研發(fā),為無創(chuàng)評價肺癌組織中整合素αvβ3的表達提供了可能[5]。本研究旨在構建以精氨酸-甘氨酸-天冬氨酸多肽(RGD)為靶向基團、牛血清白蛋白(bovine serum albumin, BSA)為載體、Gd為成像劑的新型MR納米分子成像探針RGD-Gd@BSA,并通過體外細胞實驗,探討其用于NSCLC精準診斷和風險評估的可行性。
1 材料與方法
1.1主要材料 BSA(北京鼎國生物技術有限公司);RGD[吉爾生化(上海)有限公司];六水氯化釓 (GdCl3·6H2O,上海阿拉丁生化科技股份有限公司);釓噴酸葡甲胺注射液(Gd-DTPA,北京北陸藥業(yè)股份有限公司);馬來酰亞胺-聚乙二醇2000-N-羥基琥珀酰亞胺(Mal-PEG2000-NHS,北京鍵凱科技股份有限公司);N-乙基馬來酰亞胺(NEM,Sigma Aldrich);二氫卟吩e6(Ce6,Frontier Scientific);肺腺癌A549細胞株和人胚腎293T細胞株(中國科學院生物化學與細胞生物學研究所)。
1.2分子成像探針RGD-Gd@BSA的合成 將5 ml GdCl3·6H2O溶液(0.4 mg/ml)在磁力攪拌下緩慢滴入10 ml BSA溶液中,得到乳白色溶液,繼續(xù)滴加 5 ml NaOH溶液(0.2 mg/ml),至溶液澄清后繼續(xù)室溫下攪拌1 h,超速離心(4 500 r/min)下超濾15 min除去未反應的Gd3+,得到產物Gd@BSA。調節(jié)Gd@BSA溶液pH值至7.2,將5 ml NEM溶液 (0.5 mg/ml)緩慢滴入Gd@BSA溶液中,室溫下反應2 h,透析去除多余NEM。調節(jié)pH值至8.0,向溶液中滴加5 ml Mal-PEG2000-NHS溶液(0.6 mg/ml),繼續(xù)反應2 h,透析去除多余Mal-PEG2000-NHS。調節(jié)pH值至7.0,向溶液中滴加巰基修飾的RGD溶液 5 ml (3 mg/ml),室溫攪拌反應24 h,得到產物RGD-Gd@BSA。加入光敏劑Ce6,反應后獲得Ce6修飾的RGD-Gd@BSA。
1.3分子成像探針RGD-Gd@BSA的相關表征 以X線透射電鏡觀察RGD-Gd@BSA的形態(tài),以納米激光粒度分析儀(型號NanoZS90)檢測RGD-Gd@BSA的水合動力學直徑和Zeta電位,觀察24 h內RGD-Gd@BSA在不同溶液(去離子水、生理鹽水、磷酸鹽緩沖液及細胞培養(yǎng)液)中的粒徑變化,評價分子探針的溶液分散穩(wěn)定性。配置不同Gd3+濃度(0.15、0.30、0.60、1.20和2.40 μmol/L)的Gd@BSA和RGD-Gd@BSA溶液,以3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide, MTT]比色法檢測含不同Gd3+濃度Gd@BSA和RGD-Gd@BSA溶液中人胚腎293T細胞的存活率,評價納米材料的生物安全性。
配置不同Gd3+濃度(0.022、0.043、0.087、0.173、0.347、0.693 mmol/L)的RGD-Gd@BSA和Gd-DTPA溶液,以體外磁場發(fā)生儀(型號MFG-1000)分別檢測不同Gd3+濃度下RGD-Gd@BSA和Gd-DTPA的T1值,將T1值倒數與相應的Gd3+濃度線性擬合,分別得到兩者的T1弛豫率。同時對兩者行MR掃描,獲得T1WI。采用Siemens Magnetom Verio 3.0T MR掃描儀,頭頸線圈。掃描參數:TR 600 ms,TE 15 ms,層厚2 mm,FOV 150 mm×150 mm。

圖1 RGD-Gd@BSA的形貌及尺寸 A.X線透射電鏡圖; B.水合動力學直徑
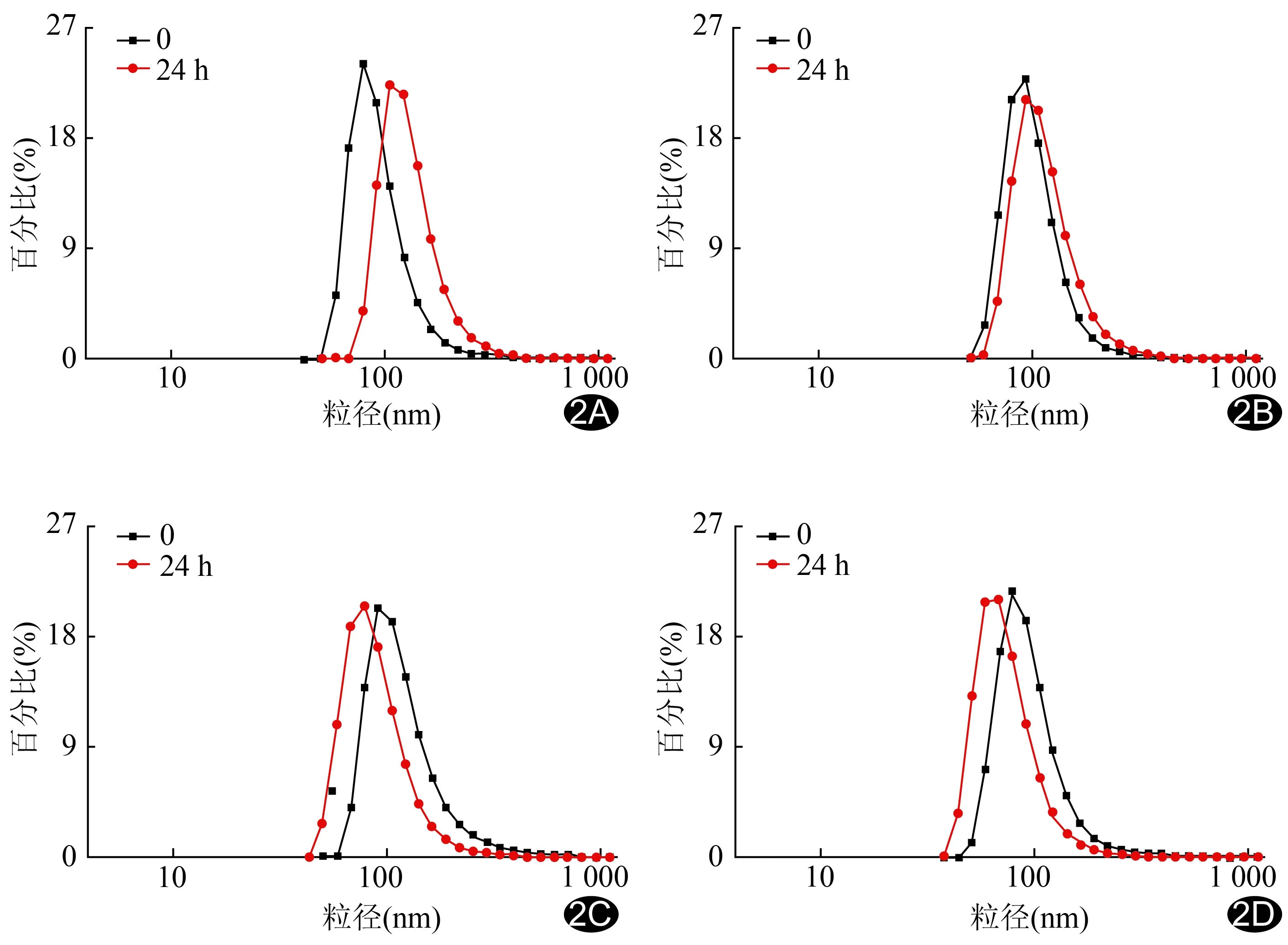
圖2 RGD-Gd@BSA在不同溶液中的分散穩(wěn)定性 A.去離子水; B.生理鹽水; C.磷酸鹽緩沖液; D.細胞培養(yǎng)液
1.4A549細胞靶向性熒光成像 取對數生長期的A549細胞,接種于6孔板中,細胞數3×105個/孔,于飽和濕度、37℃、5% CO2濃度的培養(yǎng)箱中孵育24 h,分別加入光敏劑Ce6修飾的RGD-Gd@BSA(靶向組)和Gd@BSA(非靶向組)溶液(Gd3+濃度為 0.6 μmol/L,2 ml/孔),每組3個復孔,繼續(xù)孵育2 h。以磷酸鹽緩沖液沖洗細胞2遍,加入4%多聚甲醛,每孔 1 ml,室溫下固定10 min。去除多聚甲醛并以磷酸鹽緩沖液沖洗細胞后,每孔加入0.5 ml DAPI溶液室溫避光染色5 min。去除DAPI并以磷酸鹽緩沖液沖洗細胞,滴加抗熒光淬滅封片劑,密封避光保存。熒光共聚焦顯微鏡下分別行細胞成像(激發(fā)波長488 nm,接收630 nm)。
1.5A549細胞靶向MRI 細胞接種培養(yǎng)同熒光共聚焦成像實驗,孵育24 h后分別加入RGD-Gd@BSA(靶向組)和Gd@BSA(非靶向組)溶液,每組2個Gd3+濃度梯度(0.050和0.025 mmol/L),繼續(xù)孵育1.5 h。以磷酸鹽緩沖液沖洗細胞、胰酶消化、離心,所得細胞團以磷酸鹽緩沖液制成細胞懸液,分別置入2 ml EP管內,獲取MR T1WI,參數同前;勾畫ROI,測量其T1WI相對信號強度。
1.6統計學分析 采用SPSS 19.0統計分析軟件。以獨立樣本t檢驗比較2組間T1WI信號強度的差異,P<0.05為差異有統計學意義。
2 結果
2.1RGD-Gd@BSA的表征 X線透射電鏡顯示RGD-Gd@BSA呈類球形,形貌均一,平均水合動力學直徑為(99.52±2.62)nm(圖1);Zeta電位為(-11.07±0.42)mV。在去離子水、生理鹽水、磷酸鹽緩沖液及細胞培養(yǎng)液4種不同溶液中,RGD-Gd@BSA分散穩(wěn)定,連續(xù)觀察24 h,RGD-Gd@BSA的水合動力學直徑變化幅度分別為37.46%、14.62%、25.10%和21.24%(圖2)。體外水溶液MRI顯示,各濃度RGD-Gd@BSA溶液的T1WI信號強度均高于Gd-DTPA(圖3A),RGD-Gd@BSA弛豫率為18.615 L/(mmol·s),而Gd-DTPA為3.404 L/(mmol·s);見圖3B。
2.2細胞毒性試驗 隨Gd3+濃度增加,Gd@BSA和RGD-Gd@BSA對293T細胞均表現出較好的生物相容性,在Gd3+濃度為0.15、0.30、0.60、1.20和2.40 μmol/L的納米探針溶液中,人胚腎293T細胞的存活率分別為:Gd@BSA,81.42%、77.90%、81.44%、77.32%和67.43%;RGD-Gd@BSA,81.74%、86.80%、69.83%、78.41%和66.95%(圖4)。

圖3 不同Gd3+濃度RGD-Gd@BSA及Gd-DTPA溶液體外MR成像效果 A.T1WI; B.T1弛豫率擬合圖
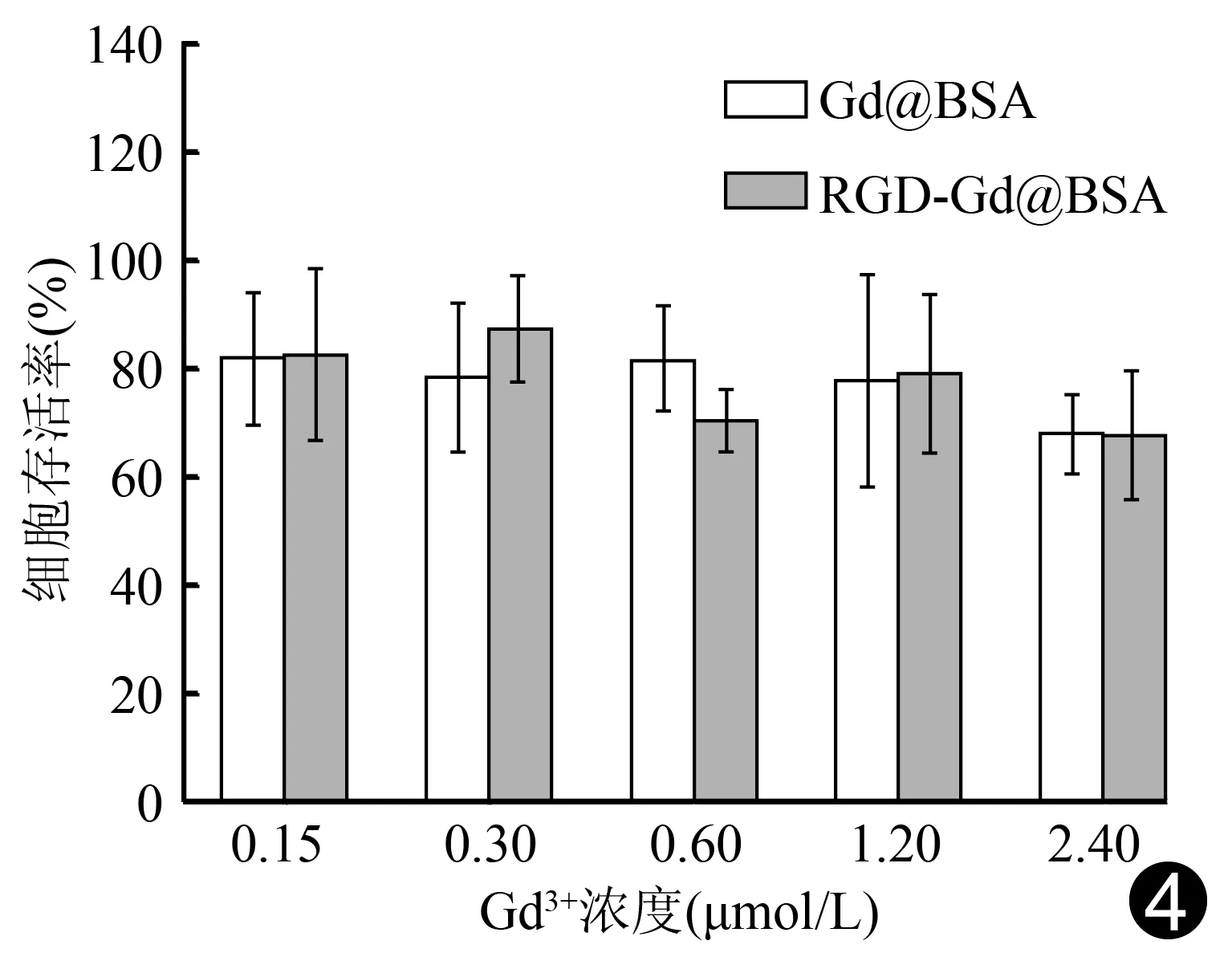
圖4 不同Gd3+濃度Gd@BSA和RGD-Gd@BSA下人胚腎293T細胞的存活率柱形圖
2.3A549細胞靶向性熒光成像 熒光共聚焦顯微鏡下,Gd@BSA和RGD-Gd@BSA均能被人肺腺癌A549細胞吞噬攝取,對RGD-Gd@BSA的攝取多于Gd@BSA,產生更高的熒光強度(圖5)。
2.4A549細胞靶向MRI Gd3+濃度為0.050 mmol/L和0.025 mmol/L時,靶向組(RGD-Gd@BSA)細胞懸液T1WI相對信號強度均高于非靶向組(Gd@BSA),差異均有統計學意義(t=3.907、2.845,P=0.017、0.047,圖6)。
3 討論
在我國,肺癌的發(fā)病率和死亡率急劇上升,已居惡性腫瘤之首。在組織學分型上,NSCLC占肺癌的85%以上[6]。臨床約80%肺癌患者確診時已失去手術機會,50%患者在初次確診時已發(fā)生轉移[7]。因此,早期、精準診斷和準確判斷預后,對于肺癌患者治療方案選擇和提高療效具有重要意義。影像學,特別是CT、MRI的廣泛應用和不斷發(fā)展,極大地提高了肺癌患者病灶的檢出率,然而在腫瘤病灶定性診斷的準確率以及對早期小病灶空間定位的敏感度方面,常規(guī)影像學檢查技術還有一定局限性。
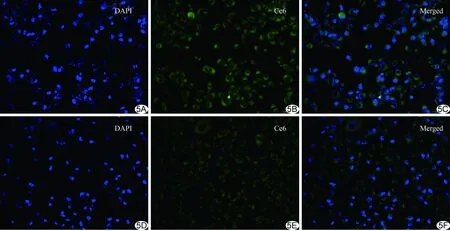
圖5 分子成像探針靶向肺腺癌A549細胞熒光共聚焦成像(×40) A~C.靶向組(RGD-Gd@BSA); D~F.非靶向組(Gd@BSA) (DAPI:細胞核熒光染料,呈藍色熒光;Ce6:染色探針,呈綠色熒光;Merged:二者融合圖像)

圖6 人肺腺癌A549細胞不同Gd3+濃度下T1WI和相對信號強度柱形圖 A.靶向組T1WI; B.非靶向組T1WI; C.T1WI相對信號強度柱形圖(*:P<0.05)
分子影像學技術的飛速發(fā)展,提高了影像醫(yī)學對腫瘤的診斷效能。惡性腫瘤診斷效能主要包括敏感度和特異度兩個方面,而基于納米技術的各類新型分子成像探針的研發(fā)能夠同時提升敏感度和特異度[8]。基于MRI的分子探針研發(fā)成為分子影像學研究領域的熱點,而選擇合適靶點是構建腫瘤特異性MR分子成像探針的關鍵。研究[2,9-10]表明,整合素αvβ3在NSCLC組織中的表達明顯高于癌旁組織,并與腫瘤分化程度、病理分期、侵襲轉移密切相關;且整合素αvβ3能特異性識別含RGD的配體,并通過配體-受體結合的方式調節(jié)腫瘤的生物學行為[11]。因此,本研究以整合素αvβ3為靶點,RGD為靶向基團,Gd為成像劑,構建MR分子成像探針,以期實現對NSCLC的特異性診斷。
MR分子成像探針在腫瘤區(qū)產生特異性MR信號的首要條件是探針能夠順利到達靶組織,然后通過靶向基團(配體)與靶點(受體)特異性結合,使探針在腫瘤內特異性富集。機體內的網狀內皮吞噬系統(reticuloendothelial system, RES)或單核巨噬細胞吞噬系統(mononuclear phagocyte system, MPS)對進入體內的納米顆粒的吞噬清除,是阻礙分子成像探針順利到達腫瘤靶區(qū)的重要因素。研究[12]表明,納米顆粒粒徑為100~200 nm,可有效減少RES或MPS的吞噬,延長其在血液循環(huán)中的時間,進而提升納米顆粒進入腫瘤組織的有效數量。本研究制備的分子成像探針RGD-Gd@BSA粒徑為(99.52±2.62)nm,理論上可有效避免RES或MPS的吞噬,保證其到達腫瘤靶區(qū)的有效數量。溶液分散穩(wěn)定性亦是決定探針能否順利進入腫瘤靶區(qū)的重要因素。本研究以BSA為載體,分子探針表面帶負電荷[Zeta電位為(-11.07±0.42)mV],保證其具有很好的溶液分散穩(wěn)定性。
MR分子成像探針在腫瘤區(qū)產生特異性MR信號的另一個重要條件是探針本身的T1弛豫能力。對于以Gd為代表的順磁性MR對比劑,根據經典的SBM(Slomon-Bloembergen-Morgen)理論[13],提升其T1弛豫率的方法主要包括:①減慢自旋時間;②延長結合水分子的停留時間;③增加結合水分子的數量。本研究設計的分子成像探針RGD-Gd@BSA因存在BSA蛋白載體而分子量較高,能夠有效延長自旋時間,且大分子蛋白本身具有一定的對水分子的束縛作用,故RGD-Gd@BSA具有明顯高于Gd-DTPA對比劑的弛豫率,以提高其T1成像能力。
為驗證RGD-Gd@BSA對NSCLC的靶向能力,本研究分別進行A549細胞靶向性熒光成像和MRI,通過向BSA疏水區(qū)內引入光敏劑Ce6的方法,賦予探針產生熒光的能力。熒光共聚焦顯微鏡下,靶向組A549細胞質內的熒光強度高于非靶向組,表明RGD-Gd@BSA對肺癌A549細胞具有更高的親和力。MRI實驗結果亦表明,靶向組細胞懸液的T1WI相對信號強度高于非靶向組,且差異有統計學意義,提示RGD-Gd@BSA具有NSCLC靶向性MR成像的能力。
總之,本研究設計合成的RGD-Gd@BSA具有較好的生物相容性和溶液分散穩(wěn)定性、較高的T1弛豫率和對肺癌A549細胞的靶向性,可作為用于NSCLC早期、精準診斷和預后評價的MR分子成像探針,值得進一步研究。

