應(yīng)用CRISPR/Cas9體系對(duì)番茄PSY 1基因的定點(diǎn)編輯
成 妍 焦彥生 喬 寧 苗如意
(山西省農(nóng)業(yè)科學(xué)院蔬菜研究所,山西太原 030031)
近年來興起的CRISPR(clustered regularly interspaced short palindromic repeats)/Cas(CRISPR associated)體系是繼 ZFNs(Zinc-finger nucleases)(Urnov et al.,2010) 和 TALENs(transcription activator like effector nucleases)(Joung & Sander,2013)之后的第3代基因組編輯技術(shù)(Sanagala et al.,2017)。CRISPR是廣泛存在于細(xì)菌和古細(xì)菌基因組中的特殊DNA重復(fù)序列,由可俘獲的外源DNA組成,當(dāng)含有同樣序列的外源DNA入侵時(shí),可被細(xì)菌機(jī)體識(shí)別,并進(jìn)行剪切使之表達(dá)沉默,達(dá)到保護(hù)自身安全的目的(Barrangou et al.,2007)。Cas蛋白存在于CRISPR位點(diǎn)附近,是一種雙鏈DNA核酸酶,能在sgRNA(small guide RNA)引導(dǎo)下對(duì)靶位點(diǎn)進(jìn)行切割(Jinek et al.,2012)。目前已經(jīng)發(fā)現(xiàn)多種類型的CRISPR/Cas系統(tǒng),其中CRISPR/Cas9系統(tǒng)組成最為簡(jiǎn)單,只需要1個(gè)Cas9蛋白就可切割DNA雙鏈,形成雙鏈DNA缺口(Mali et al.,2013)。然后細(xì)胞借助HR機(jī)制(homologous recombination) 或 者 NHEJ機(jī) 制(non-homologous end joining)對(duì)斷裂的DNA進(jìn)行修復(fù)(Voytas,2013)。由于CRISPR/Cas9技術(shù)在載體構(gòu)建等方面比ZFNs和TALENs有許多優(yōu)勢(shì),目前該技術(shù)已成功應(yīng)用在多種細(xì)菌、動(dòng)物、植物和人類的基因編輯中(Nekrasov et al.,2013;Wang et al.,2013;Liu &Fan,2014;Liu et al.,2015;楊學(xué)飛 等,2017)。
八氫番茄紅素合成酶(phytoene synthase,PSY)是植物類胡蘿卜素生物合成途徑中促進(jìn)番茄紅素合成的上游關(guān)鍵酶,催化兩分子的牻牛兒基牻牛兒基焦磷酸(geranylgerany pyrophosphate,GGPP)縮合形成八氫番茄紅素,目前已從番茄中分離得到 PSY 1(Fraser et al.,1999)和 PSY 2(Kato et al.,2004)2個(gè)編碼基因。PSY基因在番茄成熟過程中發(fā)揮著重要的作用。番茄作為蔬菜中模式植物,經(jīng)常被應(yīng)用于基因組遺傳操作的研究。英國(guó)諾丁漢大學(xué)植物科學(xué)系Graham Seymour實(shí)驗(yàn)室一直致力于番茄果實(shí)成熟調(diào)控機(jī)制的研究(Liu et al.,2015;Uluisik et al.,2016),目前已完成番茄果實(shí)成熟過程中的轉(zhuǎn)錄組測(cè)序,并對(duì)調(diào)控這一過程的關(guān)鍵基因進(jìn)行了篩選,為了進(jìn)一步研究這些基因的功能,對(duì)這些基因進(jìn)行基因組水平編輯已成為必要。本試驗(yàn)擬在此基礎(chǔ)上建立一種以CRISPR/Cas9系統(tǒng)介導(dǎo)的能夠穩(wěn)定敲除番茄基因的新方法,以期為番茄重要性狀相關(guān)基因功能鑒定提供依據(jù),為構(gòu)建番茄果實(shí)成熟的調(diào)控網(wǎng)絡(luò),揭示果實(shí)成熟機(jī)制提供試驗(yàn)基礎(chǔ)。
1 材料與方法
1.1 試驗(yàn)材料
番茄材料AC++種子由英國(guó)諾丁漢大學(xué)植物科學(xué)系Graham Seymour教授提供。
所用載體、根癌農(nóng)桿菌、大腸桿菌感受態(tài)細(xì)胞均由英國(guó)諾丁漢大學(xué)植物科學(xué)系提供。
1.2 試驗(yàn)方法
1.2.1 番茄PSY 1基因CRISPR/Cas9體系中sgRNA的合成 根據(jù)Mali等(2013)的方法在番茄PSY 1基因序列第1外顯子區(qū)尋找PAM基序和sgRNA序列,并根據(jù)sgRNA序列設(shè)計(jì)特異引物(F1:5′-TG TGGTCTCAATTGGCAGGCAGCCTTGGTGAAGGTTTTAGAGCTAGAAATAGCAAG-3′;F2:5′-TGTGGTCTCA AGCGTAATGCCAACTTTGTAC-3′)。PCR 反應(yīng)體系為 25 μL,包含 9.9 μL ddH2O,12.5 μL Q5 Master mix(QIAGEN),1.25 μL上游引物,1.25 μL下游引物,0.1 μL 載體 pICH86966::AtU6p::sgRNA_PDS(Addgene plasmid 46966)。進(jìn)行35個(gè)循環(huán)的擴(kuò)增,2%的瓊脂糖凝膠電泳分析。
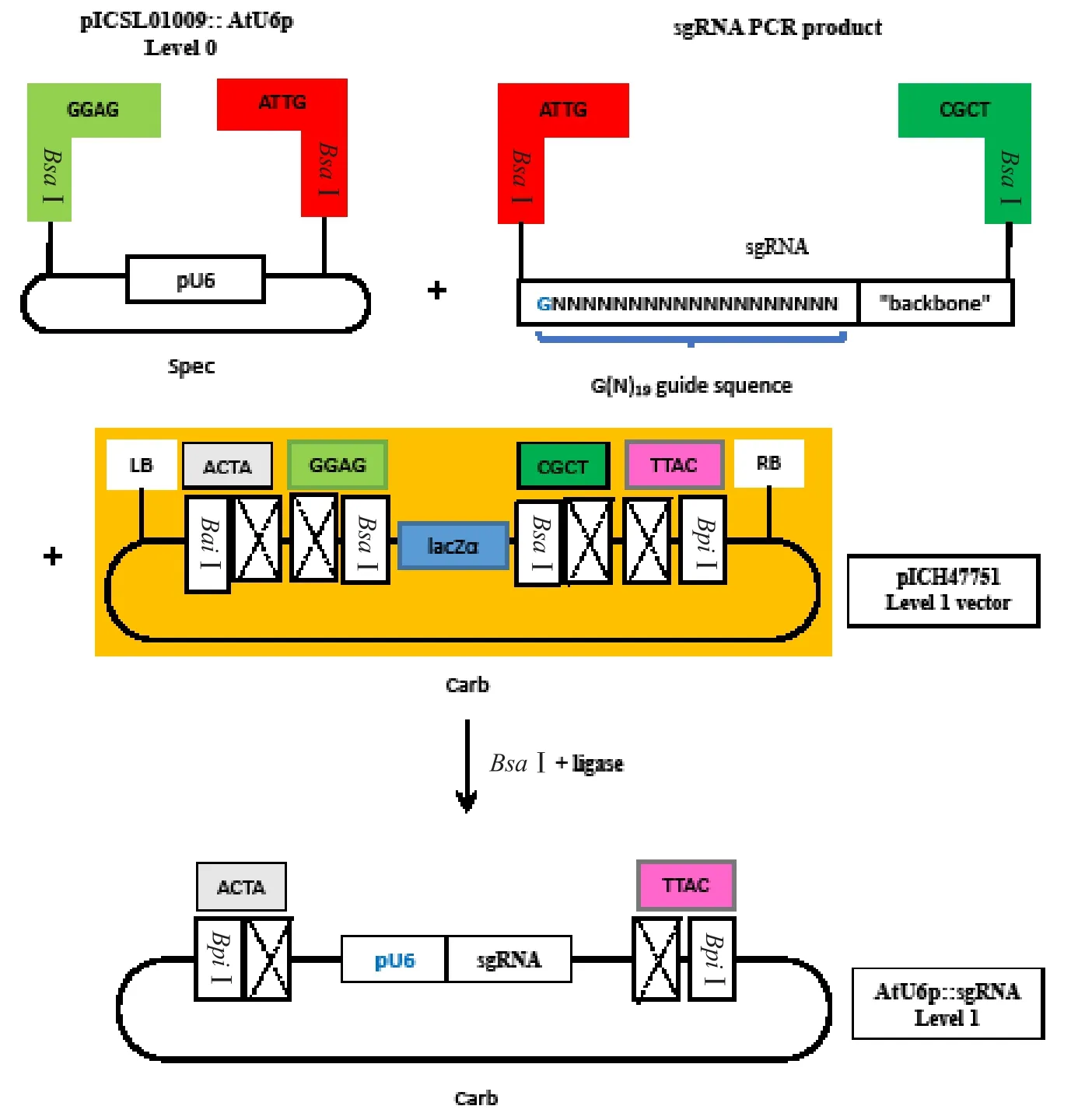
圖1 番茄PSY 1基因CRISPR-Cas9 Level 1載體構(gòu)建圖解
1.2.2 CRISPR/Cas9 Level 1載體構(gòu)建 采用GenElutTMPCR Clean-Up Kit(SIGMA)進(jìn)行sgRNA PCR產(chǎn) 物 純 化。4.4 μL純 化 產(chǎn) 物 與 0.3 μL pICSL01009::AtU6p、0.3 μL pICH47751、1.0 μL 10 mmol·L-1ATP、1.0 μL T7buffer、1.0 μL Bsa I、1.0 μL T7ligase、1.0 μL Cut smart buffer混合進(jìn)行CRISPR-Cas9 Level 1載體連接反應(yīng)(圖1)(Weber et al.,2011)。轉(zhuǎn)化大腸桿菌DH5α(DH8142)感受態(tài)細(xì)胞并克隆。用特異性引物(F1和F2)進(jìn)行菌液PCR鑒定,2%的瓊脂糖凝膠電泳分析。提取陽性菌液的質(zhì)粒DNA,送公司(Eurofins MWG Operon)測(cè)序。分析比對(duì)測(cè)序結(jié)果,檢測(cè)是否成功將雙鏈sgRNA連接到U6-sgRNA載體上。1.2.3 CRISPR/Cas9 Level 2載體構(gòu)建 取0.3 μL構(gòu)建好的 Level 1載體與 0.2 μL pICH47732: NPTⅡ、0.2 μL pICH47742: Cas9、0.3 μL pICH41766、1.0 μL pAGM4723、2.0 μL ddH2O、1.0 μL cut smart buffer、1.0 μL 10 mmol·L-1ATP、1.0 μL Bpi I、1.0 μL T7ligase、1.0 μL T7buffer混合進(jìn)行CRISPRCas9 Level 2載體連接反應(yīng)(圖2)。轉(zhuǎn)化大腸桿菌DH5α(DH8142)感受態(tài)細(xì)胞并克隆。用特異性菌液PCR引物(F1和F2)進(jìn)行PCR鑒定,2%的瓊脂糖凝膠電泳分析。挑選3個(gè)陽性菌液提取質(zhì)粒DNA,測(cè)序。分析比對(duì)測(cè)序結(jié)果,檢測(cè)是否成功將雙鏈sgRNA連接到Cas9載體上。1.2.4 番茄CRISPR/Cas9/PSY 1 Level 2載體轉(zhuǎn)化農(nóng)桿菌 搖菌10 mL(LB+Kanamycin),使其OD600約為1.5左右,然后依據(jù)PuriLink Quick Plasmid DNA Miniprep Kits(Invitrogen)提取連接了PSY 1-sgRNA的CRISPR-Cas9質(zhì)粒,使最終質(zhì)粒濃度大于100 ng·μL-1。取40 μL農(nóng)桿菌EHA105感受態(tài)細(xì)胞與2 μL Level 2質(zhì)粒DNA混勻,并轉(zhuǎn)移到預(yù)冷的電轉(zhuǎn)杯中,在電轉(zhuǎn)儀上進(jìn)行轉(zhuǎn)化(2.5 kV,400 Ω,25 μFD)。之后立即加入 1 mL預(yù)冷的LB培養(yǎng)基,轉(zhuǎn)移到1 mL離心管中,28 ℃振蕩培養(yǎng)3 h。吸取100 μL培養(yǎng)液涂LB平板(含100 mg·L-1Kanamycin),28 ℃培養(yǎng)過夜。在LB平板上挑取白色單克隆到10 mL LB培養(yǎng)基中(含100 mg·L-1Kanamycin),28 ℃培養(yǎng)過夜。用特異性引物(F3:5′-GAAATTTAGATTGAAGCTGG-3′;F4:5′-GTGTTTTCAACTGGGTGTTC-3′)進(jìn)行菌液 PCR鑒定,2%的瓊脂糖凝膠電泳分析。菌液與50%的甘油混合,-80 ℃保存。

圖2 番茄PSY 1基因CRISPR-Cas9 Level 2載體構(gòu)建圖解
1.2.5 CRISPR/Cas9/PSY 1 農(nóng)桿菌轉(zhuǎn)化番茄子葉對(duì)番茄種子進(jìn)行表面消毒,在MS培養(yǎng)基上播種,密度為3粒·cm-2。播種后10~12 d取子葉進(jìn)行預(yù)培養(yǎng)24 h后,放入農(nóng)桿菌菌液中浸泡15 min,再放回到原來的培養(yǎng)基上26 ℃暗培養(yǎng)2 d。將子葉轉(zhuǎn)移到添加有80 mg·L-1Kanamycin和500 mg·L-1Carbenicilin的MS培養(yǎng)基中培養(yǎng)。每3~4周轉(zhuǎn)移1次子葉至新鮮的培養(yǎng)基中。當(dāng)有小植株從愈傷組織中長(zhǎng)出時(shí),轉(zhuǎn)移至添加有0.87 mg·L-1IAA、80 mg·L-1Kanamycin和500 mg·L-1Carbenicilin的MS培養(yǎng)基中生根培養(yǎng)。將生根良好的瓶苗栽植到基質(zhì)中。
1.2.6 突變檢測(cè) 利用DNeasy Plant Mini Kit(QIAGEN)提取野生型和轉(zhuǎn)基因植株的基因組DNA,并檢測(cè)濃度。以提取的基因組DNA為底物,用特異性引物(F3:5′-GAAATTTAGATTGAA GCTGG-3′;F4:5′-GTGTTTTCAACTGGGTGTTC-3′)檢測(cè)再生植株是否為轉(zhuǎn)基因植株。再對(duì)PCR鑒定為轉(zhuǎn)基因的再生植株用特異性引物(F5:5′-TTGG TTTGCCTGTCTGTGGT-3′;F6:5′-TGTGTTTGTGCGC GTAACTG-3′)進(jìn)行PCR擴(kuò)增。然后用2%的瓊脂糖凝膠進(jìn)行檢測(cè)。采用GenElutTMPCR Clean-Up Kit(SIGMA)進(jìn)行PCR產(chǎn)物純化。吸取15 μL純化的PCR產(chǎn)物送公司(Eurofins MWG Operon)測(cè)序,F(xiàn)5為測(cè)序引物。利用DNAMAN軟件將測(cè)序的結(jié)果與野生型進(jìn)行比對(duì),分析確定目的區(qū)間的突變情況。1.2.7 表型性狀鑒定 正常管理遺傳轉(zhuǎn)化植株,待其果實(shí)成熟時(shí),觀察果皮顏色。
2 結(jié)果與分析
2.1 番茄PSY 1基因CRISPR/Cas9體系中sgRNA的合成
理論上,用 pICH86966::AtU6p::sgRNA_PDS為模板擴(kuò)增能合成174 bp的sgRNA(圖3)。本試驗(yàn)利用特異引物擴(kuò)增sgRNA獲得180 bp左右的PCR產(chǎn)物(圖4),與試驗(yàn)設(shè)計(jì)理論結(jié)果一致。
2.2 CRISPR/Cas9 Level 1載體驗(yàn)證
以Level 1載體菌液為模板,重復(fù)sgRNA PCR擴(kuò)增反應(yīng),同樣獲得180 bp左右的PCR產(chǎn)物(圖5),初步斷定sgRNA部分已經(jīng)整合到Level 1載體中。克隆測(cè)序結(jié)果進(jìn)一步表明Level 1載體中包含有Bpi I酶切位點(diǎn)(ACTA和TTAC)、pU6、sgRNA骨架,且均沒有發(fā)生堿基突變。
2.3 CRISPR/Cas9 Level 2載體驗(yàn)證

圖3 番茄PSY 1基因CRISPR-Cas9體系中的sgRNA序列
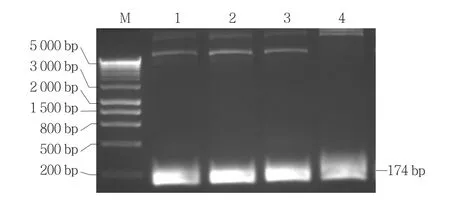
圖5 Level 1載體的擴(kuò)增產(chǎn)物
以Level 2載體菌液為模板,重復(fù)sgRNA PCR擴(kuò)增反應(yīng),同樣獲得180 bp左右的PCR產(chǎn)物(圖3),初步斷定sgRNA部分已經(jīng)整合到Level 2載體中。克隆測(cè)序結(jié)果進(jìn)一步表明Level 2載體中包含有NPT Ⅱ(圖6)、Cas9、sgRNA和L3E部分,且均沒有發(fā)生堿基突變。
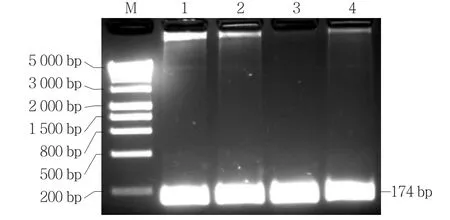
圖6 Level 2載體的擴(kuò)增產(chǎn)物
2.4 轉(zhuǎn)化農(nóng)桿菌的驗(yàn)證
以轉(zhuǎn)化后的農(nóng)桿菌菌液為模板,對(duì)Cas9部分序列進(jìn)行PCR擴(kuò)增反應(yīng),獲得1 800 bp左右的PCR產(chǎn)物(圖7),斷定Level 2載體序列已經(jīng)整合到農(nóng)桿菌中。

圖7 農(nóng)桿菌轉(zhuǎn)化后的擴(kuò)增產(chǎn)物
2.5 轉(zhuǎn)基因植株的驗(yàn)證
通過選擇培養(yǎng)基篩選具有Kanamycin和Carbenicilin抗性的再生植株,進(jìn)行Cas9部分序列的PCR擴(kuò)增反應(yīng),能獲得1 800 bp左右的PCR產(chǎn)物。對(duì)這些再生植株進(jìn)行目標(biāo)區(qū)域PCR擴(kuò)增反應(yīng),獲得831 bp的PCR產(chǎn)物(圖8),測(cè)序后進(jìn)行序列比對(duì),發(fā)現(xiàn)36個(gè)轉(zhuǎn)基因植株中有22個(gè)(61%)PSY 1基因目標(biāo)區(qū)出現(xiàn)不同數(shù)目的堿基缺失、增加或互換(表1)。待轉(zhuǎn)基因植株果實(shí)成熟時(shí),發(fā)現(xiàn)PSY 1基因目標(biāo)區(qū)堿基發(fā)生改變的轉(zhuǎn)基因植株果皮顏色由野生種的紅色變成了黃色或橙色(表1)。其中有14株在PSY 1基因目標(biāo)區(qū)發(fā)生了堿基缺失,其果皮顏色全部表現(xiàn)為黃色。另外的8株在PSY 1基因目標(biāo)區(qū)發(fā)生了堿基變異,顏色全部表現(xiàn)為橙色。表明定點(diǎn)敲除PSY 1基因使番茄果色發(fā)生了改變,驗(yàn)證了PSY 1基因在番茄紅果色形成中的作用。
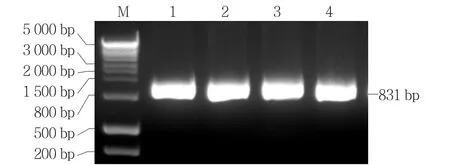
圖8 轉(zhuǎn)基因植株的特異引物擴(kuò)增產(chǎn)物
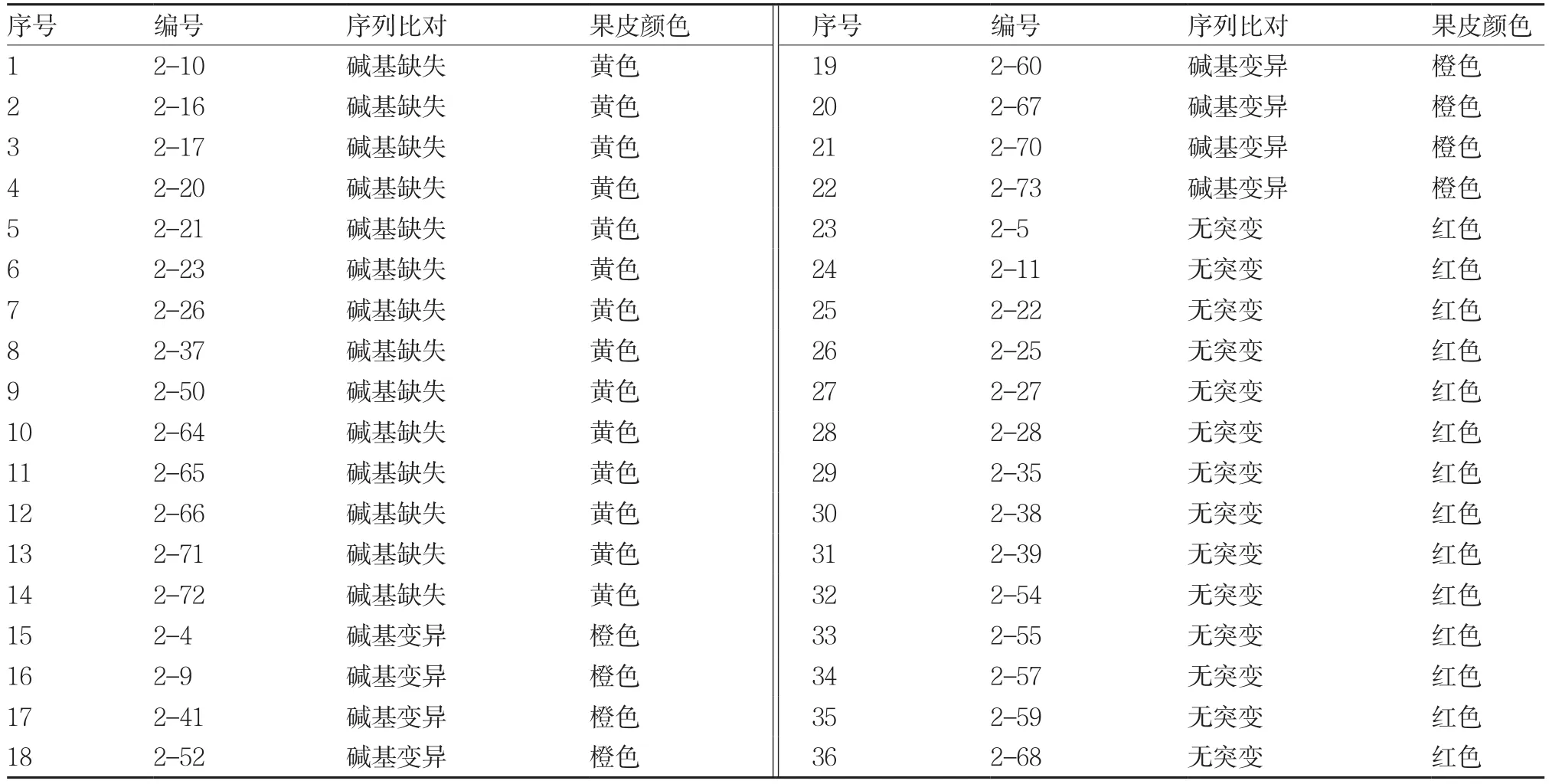
表1 T0植株的序列比對(duì)和果色觀察結(jié)果
3 結(jié)論與討論
相對(duì)于ZFNs和TALENs這兩種目前研究較為成熟的打靶技術(shù),CRISPR/Cas9系統(tǒng)載體更容易構(gòu)建(Voytas,2013)。利用ZFNs和TALENs進(jìn)行基因定點(diǎn)突變,每1個(gè)位點(diǎn)需要構(gòu)建2個(gè)相應(yīng)的核酸酶,且步驟繁瑣,而CRISPR/Cas9系統(tǒng)對(duì)特異位點(diǎn)的識(shí)別僅靠sgRNA的引導(dǎo)(姚祝平 等,2017)。本試驗(yàn)根據(jù)目標(biāo)基因序列按照G(N)19NGG標(biāo)準(zhǔn)設(shè)計(jì)了sgRNA,僅通過兩步連接反應(yīng)就成功構(gòu)建了基因定點(diǎn)突變載體。更具優(yōu)勢(shì)的是,1個(gè)CRISPR/Cas9系統(tǒng)可以由多個(gè)sgRNA組成,對(duì)應(yīng)不同的DNA識(shí)別位點(diǎn),Cas9可以通用,因此構(gòu)建1個(gè)載體即可實(shí)現(xiàn)對(duì)多個(gè)不同位點(diǎn)的打靶(Cong et al.,2013)。而且針對(duì)每個(gè)特異位點(diǎn)的sgRNA只有幾十個(gè)堿基,整個(gè)載體較小,容易實(shí)現(xiàn)轉(zhuǎn)化(Wang et al.,2013)。
CRISPR/Cas9系統(tǒng)能在sgRNA的引導(dǎo)下識(shí)別出特異的靶序列,且發(fā)現(xiàn)靶基因所在位點(diǎn)的雙鏈DNA都會(huì)被Cas蛋白中的核酸內(nèi)切酶剪切,實(shí)現(xiàn)RNA指導(dǎo)的DNA沉默(Liu et al.,2015)。Brooks等(2014)通過CRISPR/Cas9系統(tǒng)定點(diǎn)突變驗(yàn)證了SlAGO7基因在番茄中的作用,并證明了番茄中由CRISPR/Cas9系統(tǒng)介導(dǎo)的SlAGO7基因突變是高效的。蒲艷等(2018)基于S1U6啟動(dòng)子的CRISPR/Cas9基因組編輯載體,在番茄中成功實(shí)現(xiàn)對(duì)內(nèi)源基因的編輯。本試驗(yàn)中有61%的轉(zhuǎn)基因植株實(shí)現(xiàn)了PSY 1基因的定點(diǎn)敲除,使番茄果色發(fā)生了改變,再次證明了CRISPR/Cas9系統(tǒng)在番茄基因敲除中的高效性。
但由于sgRNA與靶位點(diǎn)DNA配對(duì)時(shí)存在種子序列,產(chǎn)生不嚴(yán)謹(jǐn)配對(duì),在整個(gè)遺傳操作過程中還是會(huì)有脫靶現(xiàn)象(Kleinstiver et al.,2015)。在本試驗(yàn)中也有39%的再生植株在PCR檢測(cè)中表現(xiàn)為轉(zhuǎn)基因植株,但對(duì)目標(biāo)區(qū)域進(jìn)行序列測(cè)定后發(fā)現(xiàn)沒有發(fā)生序列改變。通過改變sgRNA的二級(jí)結(jié)構(gòu)、改變sgRNA的長(zhǎng)度、通過互補(bǔ)的切口酶預(yù)先制造雙鏈DNA斷裂,均有效降低了CRISPR/Cas9系統(tǒng)的脫靶率(Doench et al.,2014;Kleinstiver et al.,2016),但這些技術(shù)在具體應(yīng)用中的效果還需進(jìn)一步證實(shí)。
本試驗(yàn)通過CRISPR/Cas9系統(tǒng)成功編輯了番茄PSY 1基因,所有變異均發(fā)生在試驗(yàn)設(shè)計(jì)的PSY 1基因第1外顯子區(qū)的目標(biāo)區(qū)域,使PSY 1基因失去了功能。試驗(yàn)中發(fā)生堿基缺失的果實(shí)表現(xiàn)為黃色,說明這些果實(shí)中沒有番茄紅素,PSY 1基因徹底失去了功能,呈現(xiàn)出少量胡蘿卜素的黃色;而發(fā)生堿基變異的果實(shí)都表現(xiàn)為橙色,說明這些果實(shí)中還含有少量的番茄紅素,與胡蘿卜素共存,呈現(xiàn)為橙色。這些少量的番茄紅素是如何合成的,則需要對(duì)橙色轉(zhuǎn)基因番茄做一步的研究。

