EDTA絡合法測定鉛精礦中鉛鋅鐵
李 方
(湖南有色金屬有限公司黃沙坪礦業分公司,湖南 郴州 424421)
EDTA分子中具有六個可與金屬離子形成配位鍵的原子,能與許多金屬離子形成穩定的絡合物,無色金屬離子與其生成的絡合物仍為無色,有色金屬離子與其形成的絡合物的顏色將加深,基于這些特點,筆者在目前傳統常用的單獨測定方法[1-3]的基礎上,經過大量實驗,擬定出一個一次分解試樣,連續測定鉛鋅鐵的分析方法。本法具有簡便、快速、準確和重現性好等優點,完全可以應用于鉛精礦中對鉛鋅鐵的測定。
1 實驗部分
1.1 主要試劑
所用試劑均為分析純,水為蒸餾水。鹽酸(ρ1.19 g/mL);硝酸(ρ1.42 g/mL);硫酸(ρ1.84g/mL);硫酸(2%);氨水(ρ0.9g/mL);二甲酚橙指示劑(1g/L);磺基水楊酸溶液(100g/L);甲基橙溶液,0.5g/L ;過硫酸銨;抗壞血酸;氯化銨;氟化鈉飽和溶液;硫脲飽和溶液;乙酸-乙酸鈉緩沖溶液(pH5~6);氨性混合液。乙二胺四乙酸二鈉(Na2EDTA)標準滴定溶液(0.0200 mol/L)。
1.2 實驗方法
1.2.1 試液制備
稱取0.2500g試樣于250mL燒杯中,以少量水潤濕礦樣, 加10~15mL 鹽酸,于低溫溶解并趕盡硫化氫,加入5mL硝酸,繼續加熱至無棕色的二氧化氮產生,取下稍冷,加入8mL濃硫酸,加熱至冒濃白煙,取下,冷卻。用水吹洗表面皿及杯壁至體積約75mL,低溫加熱煮沸10min~15min,取下,自然冷至室溫,后流水冷卻,靜置0.5h。用慢速定量濾紙過濾,下面用200mL容量瓶進行承接,以(2+98)的硫酸洗燒杯3次,漏斗6次,再用水各洗滌1次。濾紙和沉淀用作測定鉛之用,濾液用作測定鋅、鐵之用。
1.2.2 測定
(1)鉛的測定。將濾紙撕爛連同沉淀移入原燒杯中,加緩沖液50mL,放置低溫電熱板上加熱至沸并保溫5min~10min,取下,趁熱加飽和NaF10mL,搖動稍等1min,用水沖洗表面皿及杯壁至體積150mL左右,加硫脲飽和液10mL,加抗壞血酸少許,加1~2滴二甲酚橙指示劑,用EDTA標準溶液滴定至溶液由紅色變為亮黃色即為終點。計算鉛的含量。
(2)鐵的測定。向1.2.1的濾液中加入3g~5g氯化銨,0.5g過硫酸銨,用氨水中和溶液至氫氧化鐵沉淀完全,并過量10mL,加熱煮沸3min~5min,取下。用快速定性濾紙過濾,濾液用400mL燒杯承接,用熱的氯化銨-氨水洗液洗滌燒杯與沉淀各6次,再用水各洗1次,沉淀用作測鐵之用,濾液用作測鋅之用。
用熱的鹽酸(1+1)溶解沉淀于原燒杯中,然后用水與鹽酸(1+1)交替洗滌濾紙至無鐵離子(用硫氰酸鹽溶液檢驗,至無血紅色出現)。置燒杯于低溫電爐蒸至溶液約3mL ~ 5mL, 取下,加水至 120mL 左右,用氨水(1+1)中和至有氫氧化鐵沉淀出現,加 15mL 鹽酸(0.1mol/L),加熱至近沸,取下,加入 1mL 磺基水楊酸溶液(100g/L),用EDAT 標準滴定溶液滴定至溶液棕紅色消失為終點。計算鐵的含量[3]。
(3)鋅的測定。將(2)的濾液于電熱板上煮至無氨味,稍冷,用水吹洗杯壁,加入0.2g左右抗壞血酸,加入30mL乙酸-乙酸鈉緩沖溶液,加10mL飽和氟化鈉溶液,10mL硫代硫酸鈉溶液(100g/L),混勻,加2滴二甲酚橙指示劑(1g/L),用EDTA標準滴定溶液滴定至溶液由紫紅色變為黃色為終點。計算鋅的含量。
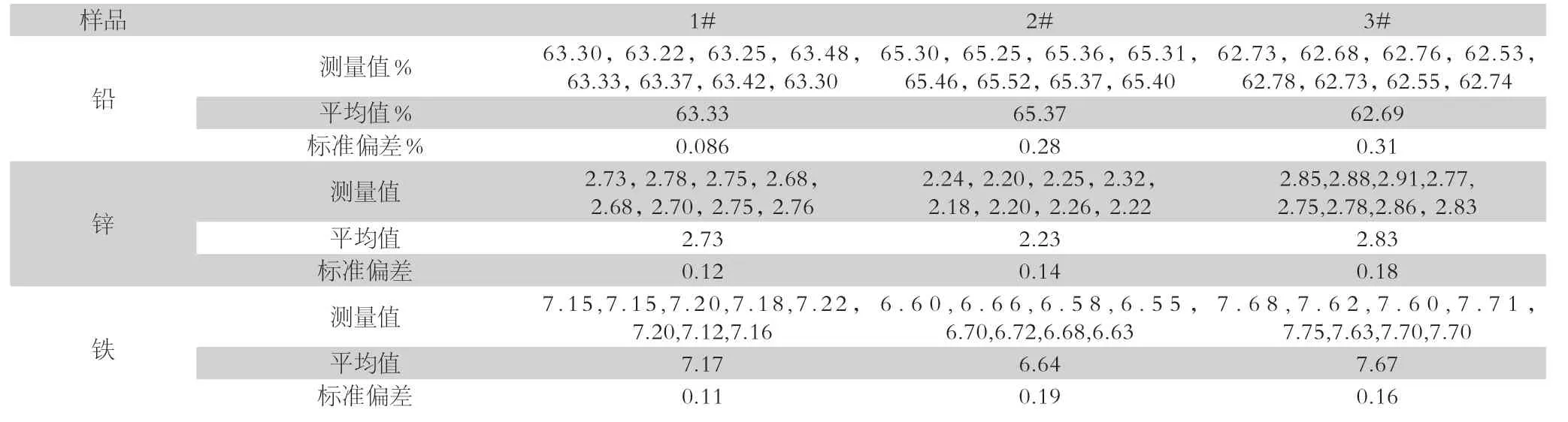
表2 分析結果重現性(n=8,w/%)
2 結果與討論
2.1 測定時酸度的選擇
2.1.1 測鉛時酸度的選擇
硫酸鉛沉淀最適宜的酸度為20%~60%(以重量計)。如下圖1示,當酸度小于20%和大于60%時,硫酸鉛的溶解度都會增大,因此實驗選擇沉淀酸度為30%左右。

圖1 硫酸鉛沉淀
滴定酸度則以PH5.2~5.8為宜,一般分析時加入緩沖液煮沸5~10分鐘即可達到此條件。
2.1.2 測鋅時酸度的選擇
PH應嚴格控制在5~6的范圍,若PH<5則終點提前,結果偏低,若PH>6,由于指示劑本身呈紅色,故無終點,所以蒸發時,氨必須趕盡即能達到要求條件。
2.1.3 測鐵時酸度的選擇
當PH<1時,Fe3+和磺基水楊酸的絡合能力減低,EDTA與Fe3+不定量絡合;PH太大時,鐵易水解產生渾濁,影響滴定。所以應嚴格控制滴定時PH值為1.2~2,此范圍時磺基水楊酸與Fe3+能形成紫紅色絡合物,但其絡合強度遠小于EDTA與Fe3+的絡合強度。因此在滴定終點時,溶液由紫紅色變為Fe3+-EDTA絡合物的淡黃色。所以在滴定前加入0.1mol/L鹽酸15mL,控制體積150mL左右,此時[H+]=0.01mol/L,PH=2,正好滿足要求。
2.2 滴定中干擾物質的影響及消除
測鉛時干擾物質的影響及消除。
鐵、銅:當試料中鐵含量很高時,在硫酸冒煙蒸干時,有黃綠色沉淀出現,用水吹洗則為褐色沉淀,這是鐵生成高價的難溶性硫酸鹽所致,在沉淀硫酸鉛時加入少量抗壞血酸煮沸即可消除。而微量的三價鐵和二價銅在EDTA滴定前加入少量抗壞血酸和硫脲,即可消除其干擾[4];
含碳高的樣品,可在冒濃厚白煙時,沿杯壁滴加1:1的硝硫混合酸除去。含銻高時應預先加入氯化銨4~5克在300℃~400℃熔燒除去,若含銻不太高,加入酒石酸即可消除其影響。若含鍶、鋇高,應用過量的EDTA溶解硫酸鉛沉淀,再用鉛標準液回滴過量的EDTA。干擾元素的分離:鐵、鋁、銅、鋅、鈷、鎳、錳等元素,在滴定條件下,雖能和EDTA絡合而干擾測定,但使鉛成硫酸鉛沉淀時,上述元素已被分離除去。銻、鉍含量高時,易水解夾雜于硫酸鉛沉淀中,但樣品銻含量小于50毫克時,可在酒石酸存在下沉淀硫酸鉛,以消除干擾,少量鉍的干擾亦可在酒石酸存在下消除。
3 樣品分析
測定結果對比。
按實驗方法對3個鉛精礦樣品進行8次重復分析,并同時按國標方法進行分析及與標準值進行結果對照,對照結果見表1,分析結果重現性見表2。

表1 分析結果對照(w/%)
4 結語
由表1、表2可以看出,本方法測定結果穩定,重復性好,與國家標準分析方法測定結果及標準值基本吻合,誤差均在國家標準允許差范圍之內。該方法簡單易行,測定鉛、鋅、鐵三個元素,只需分解一次試樣、使用同一標準溶液,簡化分析流程基礎上大大縮減了分析時間,減少了能源損耗,提高了工作效率。

