不同劑量右美托咪定對體外循環下心臟瓣膜手術患者肺損傷的保護作用
陳玲陽,林仙菊,王明倉,曹建斌
作者單位: 317000浙江省臺州,臺州醫院
體外循環技術(CPB)為心外科手術的順利開展提供重要的保障,然而CPB誘發的炎性肺損傷是患者術后死亡的重要原因。右美托咪定(DEX)是一種高選擇性的 2腎上腺素能受體激動劑,具有顯著的抗炎特性。動物實驗表明DEX能減少內毒素誘導的炎癥反應,抑制促炎細胞因子的表達[1-2],但對人體CPB肺損傷作用機制尚不明確。本文旨在觀察不同劑量DEX對CPB下心內直視手術后肺功能的影響并探討其可能機制。現報道如下。
1 資料與方法
1.1 一般資料 選取浙江省臺州醫院2014年3月至2017年9月擇期行體外循環下心臟瓣膜手術患者96例。年齡43~75歲,體質量45~78 kg,ASAⅡ~Ⅲ級。采用隨機數字表法分為對照組(C)、DEX1組、DEX2組和DEX3組,每組各24例。C組男14例,女10例;平均年齡(56.8±8.4)歲,體質量(63.3±8.5)kg;CPB 時間(125.5±15.6)min;DEX1 組男13例,女 11 例;平均年齡(55.3±7.7)歲,體 質 量(61.3±6.7)kg;CPB 時 間(131±16.3)min;DEX2組男13例,女11例;平均年齡(57.5±6.8.)歲,體質量(64.1±9.0)kg;CPB 時間(128±14.5)min;DEX3組男15例,女9例;平均年齡(57.3±8.7)歲;體質量(65.3±6.0)kg;CPB 時間(129.8±14.7)min。4組患者一般資料差異無統計學意義(P>0.05)。
1.2 方法 患者術前給予常規禁飲禁食處理。術前30min肌注嗎啡0.1mg/kg,東莨菪堿0.3 mg。入室后常規吸氧,并行橈動脈穿刺置管,連續監測心電監護包括心電圖(ECG)、心率(HR)、平均動脈壓(MAP)、中心靜脈壓(CVP)、血氧飽和度(SpO2)和呼吸末二氧化碳分壓(PETCO2)。采用咪達唑侖 0.05mg/kg、依托咪酯0.3 mg/kg、羅庫溴銨1.0 mg/kg,芬太尼5~10 g/kg誘導插管。機械通氣參數設置:VT 8~10ml/kg,RR 10~14次/min,維持PETCO235~40 mmHg(1 mmHg≈0.133 kPa)。誘導完成后行右頸內靜脈穿刺,置入三腔ARROW管,用于輸血血液及活性藥物給藥。術中持續:吸入七氟烷維持麻醉,間斷靜注咪達唑侖、芬太尼維持麻醉,間斷羅庫溴銨維持肌松。采用淺低溫 (鼻咽溫度31~32℃)非搏動性灌注,中度血液稀釋,紅細胞壓積(Hct)23%~25%,體外循環過程中維持MAP于50~80mmHg,術中根據患者情況應用活性藥物。C組:誘導開始前15min0.9%氯化鈉注射液靜脈泵注;其他3組分別在誘導前15 min靜脈泵注DEX 0.3、0.5和 0.8 g·kg-1·h-1直至手術結束。
1.3 觀察指標 記錄麻醉誘導前(右美托咪定用藥前)(T0)、氣管插管前(T1)、氣管插管后(T2)、劈胸骨時(T3)和CPB開始前(T4)HR和MAP;在麻醉誘導前(T0)、CPB結束時(T5)、CPB結束后1 h(T6)、CPB 結束后2 h(T7)和手術后24 h(T8)時點抽取深靜脈血2ml加入枸櫞酸鈉抗凝3000rpm離心5min取血清,采用酶聯免疫吸附法(ELLISA)法測定TNF-、IL-1和HMGB1表達水平。在相同時點采動脈血行血氣分析,記錄吸入氧濃度(FiO2)、PaO2、動脈血二氧化碳分壓(PaCO2),計算氧合指數(OI)和呼吸指數(RI)。公式:OI=PaO2/FiO2,RI=P(A-aDO2)/PaO2。記錄術后7d內肺部感染、低氧血癥和肺不張發生率;記錄ICU滯留時間和住院時間。
1.4 統計方法 采用SPSS22.0統計軟件處理。計量資料采用均數±標準差表示,多組比較采用單因素方差分析,組內比較采用重復測量資料方差分析,偏態分布采用中位數表示,采用Kruskal-wallis秩和檢驗;計數資料采用概率法。P<0.05為差異有統計學意義。
2 結果
2.1 4組血流動力學指標比較 T1~T4時點 DEX2組 HR和 DEX3組 HR、MAP均低于C組(F≥9.62,均P<0.05);DEX3組T2~T4時點HR、MAP均低于DEX1 組(F≥8.67,均P< 0.05)。見表 1。
2.2 4組患者不同時點肺功能指標比較
C組T5~T8時點,DEX1組T5~T7時點,DEX2、DEX3組T5~T6時點OI值均低于T0,4組T5~T8時點RI值均高于T0(F≥11.21,均P<0.05);DEX1 組T5~T7時OI,DEX2、DEX3組T5~T8時點OI值均高于C組,3組T5~T8時點RI值均低于C組(F≥8.76,均P<0.05);與DEX1組比較,DEX2、DEX3組在T5~T8時點OI值明顯升高,RI值明顯降低(F≥9.72,均P<0.05);與DEX2組比較,DEX3組在T5~T8時點RI值顯明顯降低(F≥9.32,均 P < 0.05)。見表 2。
2.3 4組圍術期不同時點炎癥因子比較
4組 T5~ T8時點 TNF-、IL-1和HMGB1 水平均高于T0(F≥21.21,均P<0.05);與比較,DEX1組T5~T7時點、DEX2、DEX3組在T5~T8時點TNF-、IL-1和 HMGB1水平均低于 C組(F≥12.3,均 P<0.05);DEX2、DEX3組T5~T8時TNF-、IL-1和HMGB1水平均低于DEX1組;DEX3組在T5~T7時點 TNF-、IL-1和 HMGB1水平均低于DEX2 組(F≥10.67,均P< 0.05)。見表 3。
2.4 4組術后肺部并發癥、ICU滯留時間和出院時間比較 4組患者術后肺部并發癥比較差異無統計學意義(2=5.87,P>0.05);DEX2和DEX3組ICU滯留時間和住院時間均短于C組和DEX1組(2=9.28,F=9.36,均 P < 0.05),見表 4。
3 討論
維持血流動力學穩定是心血管手術麻醉管理要點,DEX是一種高選擇性的 2腎上腺素能受體激動劑,在臨床上廣泛用于心臟手術、神經外科等圍術期麻醉鎮痛輔助治療[3]。DEX能增加舒芬太尼鎮痛效果,減少舒芬太尼用量,降低惡心嘔吐等并發癥[4]。其作為臨床麻醉的輔助用藥有良好的感抑制交,輔助鎮痛。Ufail等[5]推薦單獨使用DEX鎮靜用藥方案是麻醉誘導前15 min給予0.5~1.0 g/kg復合劑量,持續泵注0.5~1.0 g· kg-1· h-1術中維持。為避免負荷劑量DEX對心臟患者誘導期血流動力學劇烈影響,結合DEX的起效時間需要15~20min,因此,本文采用麻醉誘導前15 min持續靜脈泵注DEX 0.3~0.8 g·kg-1·h-1,分3組來觀察DEX在麻醉誘導期對循環影響。結果說明0.5、0.8 g·kg-1·h-1劑量DEX明顯降低體外循環患者的HR,0.8 g·kg-1·h-1對血壓也明顯影響,其原因包括DEX激動突觸前 2受體,并通過負反饋機制調節腎上腺素的釋放抑制交感神經興奮,從而減慢心率和降低血壓[6]。

表1 4組不同時點血流動力學指標比較
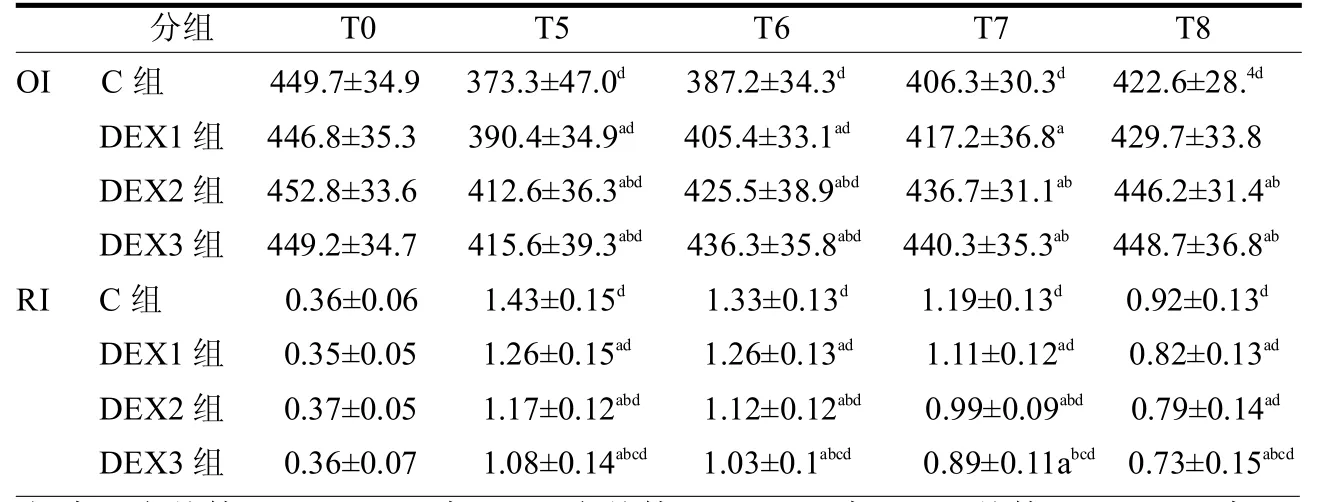
表2 4組患者圍術期不同時點OI和RI比較

表3 4組患者圍術期不同時點炎癥因子比較
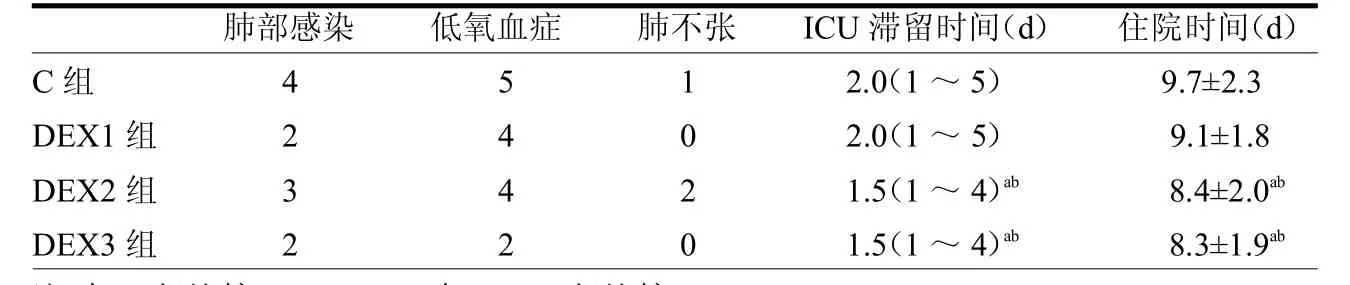
表4 4組術后肺部并發癥及ICU滯留時間和出院時間比較
本文發現體外循環后OI指數顯著降低,RI指數明顯升高,說明體外循環對患者肺功能有顯著影響,且具有一定劑量相關性。TNF-和 IL-1作為反映機體炎性反應和急性肺損傷的早期指標,高遷移率族蛋白1(HMGB1)是一種有高度保守序列的非組蛋白染色體蛋白,能誘導TNF-和IL-1的產生,在急性肺損傷過程中發揮重要作用,嚴重的肺炎性損傷影響患者的預后和康復,增加住院時間和費用[7]。有文獻報道DEX降低體外循環后全身細胞因子 TNF-、IL-1和IL-6等水平,降低單肺通氣患者HMGB1水平,對肺損傷起保護作用[8]。本文結果發現 DEX明顯減低 CPB后TNF-、IL-1和 HMGB1水平,說明DEX能顯著降低體外循環后患者炎性因子水平,在一定范圍內存在劑量相關性。Xiang等[9]通過構建小鼠肺缺血再灌注損傷模型,發現DEX通過激活 2受體抑制促炎細胞因子TNF-、IL-1釋放對肺損傷起保護作用。患者體外循環后炎癥因子水平與患者肺功能結果基本一致,這說明DEX通過抑制炎性因子釋放對體外循環后患者肺功能起保護作用,其機制可能是DEX抑制體外循環誘發的HMGB1釋放,降低TNF-、IL-1水平,減輕肺部炎性反應,加速患者康復。

