shRNA干擾IRS-1基因通過PI3K/AKT通路對人乳頭狀甲狀腺癌細(xì)胞TPC-1增殖和轉(zhuǎn)移能力的調(diào)控作用①
江澤友 徐 燦 葛一漫
(成都中醫(yī)藥大學(xué)附屬醫(yī)院檢驗科,成都610072)
乳頭狀甲狀腺癌是最常見的內(nèi)分泌系統(tǒng)癌癥,近幾十年來發(fā)病率呈逐年上升的趨勢[1,2]。研究表明,乳頭狀甲狀腺癌常見早期癌細(xì)胞及淋巴結(jié)轉(zhuǎn)移,是導(dǎo)致乳頭狀甲狀腺癌患者病情惡化及死亡的主要原因[3]。放射性碘治療是目前治療轉(zhuǎn)移性乳頭狀甲狀腺癌的主要方法,但對于出現(xiàn)遠(yuǎn)端轉(zhuǎn)移的乳頭狀甲狀腺癌患者無顯著療效,10年內(nèi)生存率不足10%[4]。并且長期進(jìn)行放射性碘治療還具有誘導(dǎo)繼發(fā)白血病等的風(fēng)險[5,6]。信號通路狀態(tài)的異常改變是癌癥發(fā)展的主要表現(xiàn)之一[7]。胰島素受體底物-1 (Insulin receptor substrate-1,IRS-1)能調(diào)控多條與細(xì)胞生長及轉(zhuǎn)移相關(guān)信號通路激活,如PI3K信號通路、MEK/ERK信號通路、JAK/STAST信號通路等[8]。研究發(fā)現(xiàn),IRS-1的表達(dá)量與肺癌患者預(yù)后呈負(fù)相關(guān)[9,10]。但I(xiàn)RS-1能否影響乳頭狀甲狀腺癌細(xì)胞生長和轉(zhuǎn)移還未見報道。本文用shRNA沉默IRS-1以探究IRS-1在乳頭狀甲狀腺中的作用及機制,以期為臨床乳頭狀甲狀腺治療提供新的潛在靶標(biāo)。
1 材料與方法
1.1試劑與儀器 CLARIOstar酶標(biāo)儀購自德國BMG Labtech公司;ProFlex PCR儀購自美國Life Technologies公司;電泳儀、轉(zhuǎn)膜儀和凝膠成像系統(tǒng)購自美國Bio-Rad公司。RPMI1640細(xì)胞培養(yǎng)液、胎牛血清和0.25%胰酶購自美國Gibco公司 (貨號:11875119,10099141,25200114);轉(zhuǎn)染試劑盒購自美國Invitrogen公司,反轉(zhuǎn)錄試劑盒、TaqMan One Step PCR試劑盒和Annexin V試劑盒購自北京索萊寶公司 (貨號:RP1100,T2210,CA1020),BCA試劑盒購自碧云天生物科技公司 (貨號:P0011);Matrigel購自美國BD公司 (貨號:354230),Trizol試劑購自美國賽默飛公司(貨號:15596026);PI3K、AKT、p-PI3K和p-AKT一抗購自英國Abcam公司(貨號:ab1678,ab8805,ab191606,ab38449) ,IRS-1抗體購自美國CST公司 (貨號:3048)。
1.2方法
1.2.1細(xì)胞培養(yǎng) 人乳頭狀甲狀腺癌細(xì)胞系TPC-1購自上海紀(jì)寧公司。用含有10%胎牛血清的RIPM1640培養(yǎng)液培養(yǎng)TPC-1細(xì)胞,培養(yǎng)環(huán)境條件為37℃,5%CO2。2 d換液一次。
1.2.2細(xì)胞轉(zhuǎn)染 用胰酶收集細(xì)胞,用培養(yǎng)液將細(xì)胞密度調(diào)整為1×106個/ml并接種于12孔板中,將細(xì)胞隨機分為TPC-1組、sh-scram組和sh-IRS-1組,根據(jù)轉(zhuǎn)染試劑盒說明書用Lipofectamine 2000將sh-IRS-1轉(zhuǎn)染進(jìn)TPC-1細(xì)胞,shRNA轉(zhuǎn)染sh-IRS-1組細(xì)胞,TPC-1組僅加入載體處理,轉(zhuǎn)染6 h后將含有轉(zhuǎn)染試劑的培養(yǎng)液更換為正常培養(yǎng)液繼續(xù)培養(yǎng),48 h 后進(jìn)行檢測。
1.2.3RT-PCR 用Trizol試劑提取轉(zhuǎn)染后的細(xì)胞總RNA,用反轉(zhuǎn)錄試劑盒合成cDNA。用PCR進(jìn)行擴增后,根據(jù)TaqMan One Step PCR試劑盒說明書對mRNA進(jìn)行定量分析,用β-actin作為內(nèi)參。實驗所用到的引物采用Primer3網(wǎng)站設(shè)計,由上海生工合成,引物序列如下:IRS-1 上游引物:5′-AGCCCAAAAGCCCAGGAGAATA-3′,下游引物:5′-TTCCGAGCCAGTCTCTTCTCTA-3′;β-actin上游引物:5′-TCGTGCGTGACATCAAAGAG-3′,下游引物:5′-TGGACAGTGAGGCCAGGATG-3′。
1.2.4Western blot 用RIPA試劑提取各組細(xì)胞蛋白,BCA試劑盒測定各組蛋白濃度。將各組蛋白濃度調(diào)平,用10% SDS-PAGE分離蛋白,半干法將蛋白質(zhì)轉(zhuǎn)移到PVDF膜,并用5%脫脂牛奶封閉PVDF膜,室溫 2 h。2 h后加入適應(yīng)濃度一抗于4℃封閉過夜,第二天洗凈未結(jié)合一抗,加入二抗室溫孵育 1 h,1 h后滴加顯色液于暗室曝光顯影,用凝膠成像系統(tǒng)獲取蛋白質(zhì)條帶圖片。以GAPDH為內(nèi)參,用Image J軟件對蛋白質(zhì)含量進(jìn)行半定量分析。
1.2.5MTT 將細(xì)胞接種于96孔板內(nèi),細(xì)胞密度為1×105個/ml。培養(yǎng)24 h后用sh-IRS-1轉(zhuǎn)染細(xì)胞,分別連續(xù)培養(yǎng)0、1、2、3和4 d后,每孔加入10 μl MTT試劑,繼續(xù)培養(yǎng)4 h后,每孔加入150 μl二甲基亞砜溶液,于搖床上低速振蕩混勻后,用酶標(biāo)儀于570 nm處檢測細(xì)胞吸光度,計算細(xì)胞增殖倍數(shù)。
1.2.6Transwell 將轉(zhuǎn)染后細(xì)胞消化接種于用Matrigel預(yù)先包被的Transwell小室上層中,用無血清培養(yǎng)液進(jìn)行培養(yǎng),小室下層6孔板中則加入正常細(xì)胞培養(yǎng)液。連續(xù)培養(yǎng)48 h后,擦去小室上層未侵襲的細(xì)胞,用結(jié)晶紫將侵襲細(xì)胞染色,于顯微鏡下觀察,每孔隨機選取6個視野進(jìn)行計數(shù)統(tǒng)計。
1.2.7劃痕實驗 實驗前一天用記號筆于12孔板背面劃出5條平行直線,消毒滅菌后備用。實驗當(dāng)天將細(xì)胞接種于12孔板內(nèi),用sh-IRS-1對細(xì)胞進(jìn)行轉(zhuǎn)染后培養(yǎng)24 h,第2天用10 μl槍頭垂直于培養(yǎng)板背面劃痕,用預(yù)冷的PBS將劃下的細(xì)胞洗凈后,加入無血清培養(yǎng)液繼續(xù)培養(yǎng)24 h,用顯微鏡拍照,每孔選取3個視野,測量劃痕寬度,計算劃痕閉合率,劃痕閉合率=(初始劃痕寬度-24 h劃痕寬度)/初始劃痕寬度×100%。
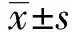
2 結(jié)果
2.1sh-IRS-1對IRS-1表達(dá)的影響 如圖1所示,與sh-scram組比較,sh-IRS-1組TPC-1細(xì)胞IRS-1的mRNA表達(dá)水平明顯降低 (P<0.01,圖1);同時,sh-IRS-1組TPC-1細(xì)胞IRS-1的蛋白表達(dá)水平也明顯低于sh-IRS-1組,差異有統(tǒng)計學(xué)意義(P<0.01,圖1),提示轉(zhuǎn)染成功。
2.2下調(diào)IRS-1表達(dá)對細(xì)胞增殖能力的影響 sh-IRS-1轉(zhuǎn)染細(xì)胞后3 d和4 d,sh-IRS-1組細(xì)胞增殖倍數(shù)顯著低于sh-scram組,差異有統(tǒng)計學(xué)意義 (P<0.05,圖2);同時,與sh-scram組比較,sh-IRS-1組細(xì)胞凋亡率明顯升高 (P<0.01,圖3),表明下調(diào)IRS-1表達(dá)能降低人乳頭瘤甲狀腺癌細(xì)胞增殖能力。
2.3下調(diào)IRS-1表達(dá)對細(xì)胞轉(zhuǎn)移能力的影響 Transwell實驗結(jié)果表明,與sh-scram組比較,sh-IRS-1組細(xì)胞侵襲數(shù)明顯減少 (P<0.01,圖4);同時,sh-IRS-1組TPC-1細(xì)胞劃痕閉合率明顯低于sh-scram組,差異具有統(tǒng)計學(xué)意義 (P<0.01,圖5),表明下調(diào)IRS-1表達(dá)能降低TPC-1細(xì)胞的轉(zhuǎn)移能力。

圖1 sh-IRS-1對TPC-1細(xì)胞IRS-1的mRNA和蛋白質(zhì)表達(dá)的影響Fig.1 Effects of sh-IRS-1 on mRNA level and protein level of IRS-1Note: RT-PCR and Western blot were performed for mRNA level and protein level of IRS-1.n=6,**.P<0.01 versus sh-scram group.All experiments were repeated at least three times,β-actin was used as loading control of RT-PCR,GAPDH was used as loading control of Western blot.

圖2 sh-IRS-1對TPC-1細(xì)胞增殖的影響Fig.2 Effect of sh-IRS-1 on cell proliferation of TPC-1 cellsNote: Cell viability was measured by MTT assay.n=6,*.P<0.05 versus with sh-scram group.
2.4下調(diào)IRS-1表達(dá)對PI3K/AKT信號通路的影響 Western blot實驗結(jié)果發(fā)現(xiàn),sh-IRS-1能抑制TPC-1細(xì)胞p-PI3K和p-AKT表達(dá),能顯著降低p-PI3K/PI3K和p-AKT/AKT的比值 (P<0.01,圖6),表明下調(diào)IRS-1表達(dá)能抑制TPC-1細(xì)胞PI3K/AKT信號通路激活。

圖3 sh-IRS-1對TPC-1細(xì)胞凋亡的影響Fig.3 Effect of sh-IRS-1 on apoptosis of TPC-1 cellsNote: Cell apoptosis rate was determined by flow cymetory.n=6,**.P<0.01 versus sh-scram group.


圖4sh-IRS-1對TPC-1細(xì)胞侵襲能力的影響
Fig.4Effectofsh-IRS-1oninvasionabilityofTPC-1cells
Note: Transwell assay was employed to measure invasion ability of TPC-1 cells.n=6,**.P<0.01 versus sh-scram group.

圖5 sh-IRS-1對TPC-1細(xì)胞遷移能力的影響Fig.5 Effect of sh-IRS-1 on migration ability of TPC-1 cellsNote: Migration ability of TPC-1 cells was determined by wound healing assay.n=6,**.P<0.01 versus sh-scram group.

圖6 sh-IRS-1對PI3K/AKT信號通路的影響Fig.6 Effect of sh-IRS-1 on PI3K/AKT signaling pathwayNote: The expressions of PI3K,p-PI3K,AKT,p-AKT were measured by Western blot.GAPDH was used as loading control.n=6,**.P<0.01 versus sh-scram group.
3 討論
乳頭狀甲狀腺癌是最常見的甲狀腺癌類型,約占所有甲狀腺癌的80%[11]。一般而言,早期乳頭狀甲狀腺癌經(jīng)過手術(shù)治療可以基本治愈[12]。但約有50%的乳頭狀甲狀腺癌患者都具有癌細(xì)胞轉(zhuǎn)移的傾向,這類患者預(yù)后往往較差,并且具有較高的死亡風(fēng)險[13,14]。因此,了解乳頭狀甲狀腺癌細(xì)胞轉(zhuǎn)移的機制、尋找治療的新靶標(biāo)是降低死亡率的關(guān)鍵。IRS-1是一類與胰島素抵抗形成相關(guān)因子,能夠調(diào)節(jié)細(xì)胞新陳代謝和細(xì)胞有絲分裂過程[15]。Hua等[16]研究發(fā)現(xiàn)IRS-1在子宮內(nèi)膜癌中表達(dá)異常增多,與患者的預(yù)后呈負(fù)相關(guān)。IRS-1與乳腺癌的發(fā)生發(fā)展密切相關(guān)[15]。IRS-1還能促進(jìn)惡性間皮細(xì)胞瘤細(xì)胞的生長[17]。有研究表明IRS-1在肝癌早期的高表達(dá)能促進(jìn)肝癌患者的存活,但也有研究報道IRS-1的高表達(dá)能夠促進(jìn)肝癌細(xì)胞的生長[8,18]。據(jù)研究報道,IRS-1在甲狀腺癌中表達(dá)也顯著升高,IRS-1的激活與甲狀腺癌患者較差的預(yù)后有關(guān)[19]。但還未見文獻(xiàn)報道IRS-1在乳頭狀甲狀腺癌中的作用。在本研究中,我們設(shè)計合成shRNA干擾乳頭狀甲狀腺癌TPC-1細(xì)胞IRS-1的表達(dá)發(fā)現(xiàn),sh-IRS-1能顯著降低IRS-1的mRNA表達(dá)水平和蛋白質(zhì)表達(dá)水平,表明shRNA能抑制TPC-1細(xì)胞IRS-1的表達(dá)。TGFβ/Smad3能通過下調(diào)IRS-1在結(jié)腸癌細(xì)胞中的表達(dá)水平抑制癌細(xì)胞增殖、誘導(dǎo)癌細(xì)胞凋亡[20]。本文研究表明,sh-IRS-1轉(zhuǎn)染細(xì)胞后的3 d和4 d,細(xì)胞增殖速度顯著低于sh-scram組,并且sh-IRS-1還能顯著升高TPC-1細(xì)胞的凋亡率,表明下調(diào)IRS-1的表達(dá)水平能抑制乳頭狀甲狀腺癌TPC-1細(xì)胞增殖、誘導(dǎo)癌細(xì)胞凋亡,從而抑制TPC-1細(xì)胞生長。
研究表明,IRS-1在調(diào)控癌細(xì)胞侵襲和轉(zhuǎn)移的過程中發(fā)揮著重要作用[21]。Gibson等[22]的研究發(fā)現(xiàn),敲除IRS-1能促進(jìn)乳腺癌腫瘤的轉(zhuǎn)移。下調(diào)IRS-1表達(dá)能促進(jìn)頭頸部鱗狀細(xì)胞癌的轉(zhuǎn)移[23]。但在乳腺癌、前列腺癌和神經(jīng)母細(xì)胞瘤中,IRS-1能誘導(dǎo)癌細(xì)胞的轉(zhuǎn)移,升高癌細(xì)胞的運動能力[21,24]。IRS-1表達(dá)水平的異常升高與鼻咽癌的淋巴結(jié)轉(zhuǎn)移有關(guān)[25]。miR-128也可通過調(diào)控IRS-1的表達(dá)抑制結(jié)腸癌細(xì)胞生長和轉(zhuǎn)移[26]。本文研究結(jié)果表明,用shRNA干擾IRS-1表達(dá)后,乳頭狀甲狀腺癌TPC-1細(xì)胞侵襲及遷移能力明顯減弱,表明下調(diào)IRS-1表達(dá)能抑制TPC-1細(xì)胞侵襲和遷移,降低TPC-1細(xì)胞的轉(zhuǎn)移能力,提示IRS-1在乳頭狀甲狀腺癌中可能發(fā)揮促癌作用。
PI3K/AKT信號通路是調(diào)控細(xì)胞生長、分化和轉(zhuǎn)移的主要信號通路之一,在乳頭狀甲狀腺癌中處于過度激活的狀態(tài)[27]。研究表明,IRS-1是PI3K/AKT信號通路的主要調(diào)控分子之一,IRS-1可通過調(diào)控PI3K/AKT信號通路的激活影響癌細(xì)胞的增殖、凋亡和轉(zhuǎn)移。Wu等[26]研究發(fā)現(xiàn),miR-128抑制結(jié)腸癌細(xì)胞增殖和遷移的作用與通過下調(diào)IRS-1表達(dá)抑制PI3K/AKT信號通路激活有關(guān)。GPCRs促進(jìn)PI3K/AKT信號通路的激活與促進(jìn)IRS-1表達(dá)有關(guān)[28]。在本研究中,下調(diào)IRS-1能抑制p-PI3K和p-AKT表達(dá),即抑制PI3K和AKT磷酸化,顯著降低p-PI3K/PI3K和p-AKT/AKT的比值,表明sh-IRS-1能抑制PI3K/AKT信號通路激活。
綜上所述,sh-IRS-1能降低乳頭狀甲狀腺癌TPC-1細(xì)胞增殖速度、侵襲及遷移能力,還能升高TPC-1細(xì)胞的凋亡率;同時,sh-RNA還能顯著降低p-PI3K/PI3K和p-AKT/AKT的比值,表明shRNA干擾IRS-1能降低人乳頭狀甲狀腺癌TPC-1細(xì)胞增殖及轉(zhuǎn)移能力,作用機制可能與抑制PI3K/AKT信號通路激活有關(guān)。本研究首次探究了IRS-1在人乳頭狀甲狀腺癌中的作用并初步探討了作用機制,可能為抑制乳頭狀甲狀腺癌的轉(zhuǎn)移提供新的潛在治療靶標(biāo)。

