短期香煙煙霧及脂多糖氣道刺激對小鼠氣道免疫細胞的影響①
陳瑞鳳 梁紫堯 于旭華 尹碩淼 范 龍 林 琳 許銀姬 陳云波 王 奇
(廣州中醫藥大學,廣州510405)
香煙煙霧與脂多糖(Lipopolysaccharide,LPS)作為氣道炎癥刺激物,常用于慢性阻塞性肺病的動物模型的建立。盡管氣道炎癥的主要表現之一氣道免疫炎癥細胞的浸潤,然而國內的多數體內實驗研究著眼于香煙及脂多糖對氣道上皮細胞或肺組織的損傷作用[1],而疏于對氣道免疫細胞的募集及功能的報道。本研究通過運用香煙煙霧短期(4 d)刺激及LPS氣道滴注誘發氣道免疫反應,報道熏煙及LPS對氣道免疫細胞分類計數、免疫細胞形態、免疫細胞應激能力以及氣道組織對免疫細胞趨化成熟作用的影響。
1 材料與方法
1.1材料
1.1.1試劑 脂多糖(Sigma 公司,055:B5,批號:L2880)。NucleoZOL(MNG;貨號740404.2)。異丙醇(廣州化學試劑有限公司)。SYBR Premix Ex TapTMⅡ試劑盒(TaKaRa;貨號RR820A)。PrimeScriptTMRT Master Mix試劑盒(TaKaRa;貨號RR036A)。PDB(2-丁酸佛波醇酯;Sigma aldrich,貨號:P1269)和L-012(8-氨基-5-氯-7-苯基-2,3-二氫吡啶并[3,4-d]噠嗪-1,4-二酮;Wako Pure Chemical Industries,貨號:120-04891)。大前門牌過濾嘴香煙(煙堿含量0.8 mg,焦油量11 mg/支,上海煙草集團)。引物均來源于Invitrogen(Fisher Scientific公司),CXCL-15:上游引物TCAATTCCCACCTT-GAGGCA,下游引物CCAGAATCAACGCAAAGCCA;GM-CSF:上游引物TCAAAGAAGCCCTGAACCTCC,下游引物GTGTTTCACAGTCCGTTTCCG;β-Actin:上游引物GCTCCTAGCACCATGAAGATCA,下游引物AGGGTGTAAAACGCAGCTCA。
1.1.2儀器 多功能臺式冷凍離心機(Allegra X-22R),生物樣品均質器(Bertin technologies),UV-7504型單光束紫外可見分光光度計(上海欣茂儀器有限公司),PCR擴增儀(Applied Biosystem),熒光定量PCR儀(ViiA7),Countstar自動細胞計數儀(上海睿鈺生物科技有限公司),多功能酶標儀(Infinite M1000 PRO),自動液基薄層細胞制片機(HQTCT-Thin PlusⅠ)。
1.1.3實驗動物 SPF級6~8周齡BALB/c小鼠,雌性,體重(20±2)g,由北京維通利華實驗動物技術有限公司提供,許可證號:11400700173607。飼養溫度:(24±3)℃,相對濕度:(40±5)%,光照:明暗交替,噪聲<55 dB,自由攝水攝食,每周更換墊料2次。
1.2方法
1.2.1動物的分組及造模 動物分組:小鼠隨機分為3組,對照組、LPS滴注組和熏煙組,每組動物8~10只。
干預措施:熏煙組:小鼠適應性喂養3 d后,置于18 L熏煙箱中進行熏煙。每次3支香煙,3次/d,煙霧用60 ml注射器注入熏煙箱中。于9 am、12 am、3 pm進行,每次1 h,連續4 d后取材。脂多糖(LPS)組:小鼠進行常規喂養,于取材前24 h經4%戊巴比妥腹腔注射麻醉,切開氣管處皮毛,充分暴露氣管,微量注射器滴入10 μg LPS(濃度2 μg/μl),滴注完成后傾斜上提小鼠軀體,輕揉按摩肺部,使LPS盡可能分布兩肺。縫合頸部皮膚,待小鼠清醒后,置籠內正常飼養。對照組小鼠每天用60 ml注射器將空氣注入18 L熏煙箱中,其余操作同熏煙組小鼠。
1.2.2標本采集 小鼠用10%水合氯醛腹腔注射麻醉,切開氣管處皮毛,充分暴露氣管,經環狀軟骨間隙切開一小口,插入氣管灌洗管(剪成楔形的24G靜脈留置針),向肺內注入1.3 ml生理鹽水,共回收約1 ml含免疫細胞的灌洗液,用于細胞計數及分類計數。完成氣管灌注后切開胸腹,充分暴露心肺,用5 ml生理鹽水進行心臟灌流,洗去肺中殘存血液,切下兩側肺,濾干水分,分裝3份,液氮處理后轉移至-80℃保存,用于PCR檢測。
1.2.3支氣管肺泡灌洗液細胞計數及分類計數 將氣道灌洗液離心3 000 r/min 10 min,去上清液,細胞沉渣重懸于100 μl生理鹽水,加入500 μl的紅細胞裂解液,混勻靜置約2 min后離心2500 r/min,5 min。棄上清液,細胞沉淀重懸800 μl生理鹽水,混勻取20 μl進行細胞計數,用Countstar自動細胞計數儀計算總細胞數,余重懸液進行HE染色涂片,按形態學標準進行細胞分類。
1.2.4細胞PDB誘導的細胞氧化應激測定 根據實驗方案,選用不透光的黑色96孔板,每孔加入50 μl 細胞混懸液。PBD刺激組加入150 μl kreb′s工作液,20 μl PDB工作液,PBD陰性對照組加入170 μl kreb′s工作液,立即進行化學發光測定,每孔測定1 s,共30個循環。ROS含量(RLU/S/1 000 cell)=(測定值-空白值)/50 μl細胞數×1 000。
1.2.5PCR法測定肺組織細胞因子 使用
NucleoZOL試劑提取肺組織中的總RNA 后,用隨機引物逆轉錄合成cDNA。按照TaKaRa擴增試劑盒說明書要求操作,根據2-ΔΔCT公式計算RNA的相對表達量。
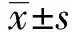
2 結果
2.1香煙煙霧及LPS對小鼠體重的影響 與實驗前相比,對照組小鼠體重未見明顯變化(P>0.05);熏煙4 d后,小鼠體重比熏煙前減少18.9%,其變化差異明顯高于對照組和LPS組(P<0.01);氣管內滴注10 μg LPS 24 h后,小鼠體重無明顯變化(P>0.05)。見表1。
2.2香煙煙霧及LPS對氣道灌洗液細胞總數和分類計數的影響 與對照組相比,熏煙組小鼠氣道灌洗液細胞總數、巨噬細胞計數,中性粒細胞計數和淋巴細胞計數均無明顯變化,(P>0.05);LPS組小鼠在LPS氣道滴注24 h后,氣道灌洗液細胞總數明顯升高,高于對照組和熏煙組(P<0.01)并且巨噬細胞計數和中性粒細胞計數均高于對照組和熏煙組(P<0.01)。見表2、3,說明LPS誘導的免疫細胞募集以單核巨噬細胞和中性粒細胞為主。
2.3香煙煙霧和LPS對免疫細胞形態學的影響 對照組灌洗液中以巨噬細胞為主,偶見中性粒細胞和淋巴細胞。巨噬細胞胞體呈圓或不規則形,胞核形態圓形,深染,大部分細胞質量較少,粉紅色,僅少量細胞細胞質量多,呈淡粉色;中性粒細胞通常呈桿狀或2~3分葉狀。熏煙組細胞以巨噬細胞為主,形態與對照組細胞一致。LPS組小鼠氣道灌洗液可見大量中性粒細胞,細胞核多呈明顯的3~5分葉狀,偶見6~7分葉狀,葉與葉間多有細絲相連;與對照組相比,巨噬細胞體積較大,圓形或不規則形,細胞質較多,淡染,內可見空泡;偶見單核細胞。見圖1。
2.4香煙煙霧和LPS對細胞PDB誘導的細胞氧化應激影響 與對照組和熏煙組相比,LPS氣管滴注的小鼠氣道灌洗液細胞在PDB的誘導下具有更高的ROS產出率(P<0.01),在非PDB的誘導的LPS組小鼠氣道灌洗液細胞的ROS產出率仍較對照組和熏煙組高(P<0.01)。見表4。



GroupsPretest weight(g)Preset weight (g)Weight loss(%)Control group20.57±0.7321.00±1.660.01±3.08Smoke group19.98±0.5316.20±0.54-18.90±1.761)2)LPS group20.5±0.7621.40±0.754.39±1.2
Note:Compared to control group,1)P<0.01;compared to LPS group,2)P<0.01.



GroupsTotal cells(×105)Total macrophages(×105)Total neutrophils(×100)Total lymphocytes(×100)Control group2.86±0.82.66±0.78708.8±843.92 734.4±8 023.2Smoke group1.37±0.681.35±0.671 388.13±4 164.380.0±0.0LPS group6.41±1.982)3)3.11±1.421)3)252 799.93±79 050.362)3)451.58±1 497.7
Note:Compared to control group,1)P<0.05,2)P<0.01;compared to smoke group,3)P<0.01.



GroupsTotalmacrophages(%)Totalneutrophils(%)Totallymphocytes(%)Control group97.75±5.950.38±0.520.73±2.19Smoke group99.22±2.330.78±2.330.00±0.00LPS group49.33±19.701)3)42.29±11.942)3)0.04±0.15
Note:Compared to control group,1)P<0.05,2)P<0.01;compared to smoke group,3)P<0.01.

圖1 香煙煙霧和LPS對免疫細胞形態的影響(HE×400)Fig.1 Effects of cigarette smoke and LPS on immune cell morphology (HE×400)Note: A.Control group;B.Smoke group;C.LPS group.Yellow arrows represented alveolar acrophages,black arrows represented activated macrophages,red arrows represented neutrophils,and blue arrows represented monocytes.



GroupsPDB+PDB-Control group53.73±30.585.37±8.32Smoke group27.72±16.51.87±1.58LPS group4 325.33±159.261)2)21.56±3.041)2)
Note:Compared to control group,1)P<0.01;compared to smoke group,2)P<0.01.



GroupsGM-CSFCXCL-15Control group1.111±0.1721.011±0.048Smoke group1.336±0.1981.035±0.585LPS group10.28±1.4821)2)0.817 3±0.135
Note:Compared to control group,1)P<0.01;compared to smoke group,2)P<0.01.
2.5肺組織中CXCL-15和GM-CSF的影響 與對照組相比,熏煙組小鼠肺組織中GM-CSF和CXCL-15的表達均沒改變(P>0.05)。LPS氣管滴注的小鼠肺組織中GM-CSF表達增高9.26倍(P<0.01),但CXCL-15并未發生改變(P>0.05),見表5。
3 討論
香煙煙霧中含有4 000多種化合物,其中包括了尼古丁、煙焦油、一氧化碳、甲醛、氨氣和DDT等有毒物質[2]。吸煙可引起氣道炎癥,導致慢性支氣管炎、慢阻肺的發生。據報道,短期香煙煙霧刺激小鼠氣道可誘發氣道急性炎癥[3],可表現為氣道巨噬細胞和中性粒細胞增多,而LPS誘導的氣道炎癥具有相似特點[4,5]。因此,本文分別用香煙煙霧和LPS誘導氣道的急性炎癥反應,比較二者對氣道免疫細胞的影響和區別。
在急性感染的過程中,體重下降往往代表了系統炎癥的發生[6]。然而在本次實驗中,4 d(9支煙)二手香煙煙霧暴露并未產生明顯氣道炎癥,因此系統炎癥產生的可能性較低。但熏煙組小鼠體重明顯下降(18.9%),體重下降程度高于既往文獻報道(5%~10%)[7]。熏煙導致體重下降的原因有二,一是炎癥促進新陳代謝,增加了能量消耗;二是尼古丁通過刺激神經受體、影響激素分泌和脂肪代謝,抑制食欲等減輕體重[8]。在本次實驗中,短期熏煙并未導致氣道炎癥細胞明顯增加,因此熏煙組動物體重下降可能主要是由于尼古丁導致。并且本次實驗小鼠體重下降的幅度較大,這可能與香煙尼古丁的含量不同有關。LPS氣道滴注24 h誘發了氣道急性炎癥,短時的急性炎癥反應并未導致明顯的體重下降。
與國外報道相比,本次實驗中4 d(9支煙/d)香煙煙霧暴露并未誘發明顯氣道炎癥反應,細胞數目低于國外報道。其原因可能為:①香煙中成分含量差異;②同種類小鼠基因型可能存在差異,從而導致對刺激的反應程度存在差異;③由于小鼠反應的差異,產生急性炎癥峰值的時間可能有差異。相對于香煙煙霧,LPS可導致氣道炎癥細胞總數升高,主要表現為中性粒細胞數目升高,說明LPS可促進中性粒細胞在氣道的聚集,符合急性炎癥反應的特征。
免疫細胞的形態在一定程度上反映了其功能的狀態。本次實驗通過對氣道灌洗液細胞涂片染色,發現短期(4 d)熏煙小鼠氣道灌洗液細胞在巨噬細胞大小、形狀、中性粒細胞核象方面與對照組并沒有明顯差別,說明短期熏煙并未引起小鼠氣道免疫細胞形態變化。LPS導致氣道巨噬細胞體積增大,形狀不規則改變,細胞質增多,甚至空泡形成,說明單核細胞處于高度激活的狀態;與此同時,LPS導致小鼠氣道中性粒細胞核分葉增多,表明LPS可以誘導中性粒細胞成熟,增強中性粒細胞的吞噬功能。此外,LPS組細胞灌洗液中還可見少量單核細胞,說明LPS刺激誘導血液中的單核細胞向氣道聚集,并可能在局部分化為巨噬細胞。
氣道免疫細胞內ROS的產生,是其發揮免疫作用、殺滅微生物的主要途徑之一[9]。PDB是公認的氧化應激產物誘導劑。本次實驗中LPS組小鼠氣道灌洗細胞在無PDB的誘導刺激下,與對照組相比,即產生較多的ROS,說明LPS有類似PDB的作用。而在PDB的誘導下,LPS組氣道灌洗細胞產生的ROS約為對照組的80倍,說明LPS導致了氣道免疫細胞的強氧化應激狀態,該反應類似于宿主免疫細胞對微生物的反應。而熏煙4 d,并未導致氣道灌洗細胞氧化應激狀態的改變。
CXCL15表達于小鼠體內,是屬于趨化因子家族中的一類細胞因子,其作用類似于CXCL8,可以促進中性粒細胞的募集,其在肺和肺上皮細胞中高表達[10]。本實驗中,我們發現,盡管LPS導致氣道中性粒細胞的聚集,但肺組織中CXCL15并未見明顯升高,說明LPS并不通過CXCL15招募中性粒細胞聚集氣道。GM-CSF具有促進中性粒細胞成熟和趨化中性粒細胞的作用[11,12],有報道認為其為中性粒細胞的炎癥的生物標志物。LPS組小鼠肺組織GM-CSF的表達明顯升高,說明LPS可通過提高肺組織GM-CSF的表達,促進中性粒細胞的成熟和趨化。而香煙煙霧并未導致肺組織CXCL-15和GM-CSF表達升高,也未增加氣道中性粒細胞的數量。
COPD在女性中發病率為5.1%[13],既往COPD實驗研究中多以雄性小鼠作為實驗動物,缺乏雌性小鼠數據。基于香煙煙霧和LPS常用于COPD動物模型的建立,本研究在實驗設計上選用了雌性小鼠作為研究對象,有別于其他實驗研究。此外,本研究對照組通過向箱體內注入空氣的方法進行“假熏煙”,排除了熏煙過程對小鼠造成的影響。但是并沒有向對照組小鼠氣管內滴注生理鹽水,忽略了手術操作和生理鹽水本身對氣道免疫細胞的影響,此為本研究設計上的缺陷。但是根據既往研究數據表明,假手術組(氣管內滴注生理鹽水或PBS)跟空白對照組氣道內炎癥細胞總數并沒有差異[14],且本實驗中對照組細胞總數與其他報道中假手術組細胞總數相似[14,15],說明手術和生理鹽水尚未構成對氣道免疫細胞數量明顯的影響,因此,在本次實驗中未設LPS假手術組并未嚴重影響不同組別數據的可比性。
綜上所述,10 μg LPS氣道滴注可通過增加肺組織GM-CSF的表達,增加中性粒細胞的成熟和募集,并促進了氣道免疫細胞內氧化應激反應及產生ROS的能力,而熏煙4 d未能產生氣道炎癥反應。在建立熏煙聯合脂多糖的COPD動物模型之前,我們有必要了解香煙和脂多糖分別對氣道炎癥免疫的影響,在此基礎上,進一步分析熏煙聯合脂多糖對免疫細胞的交互影響,從而更好地了解并揭示吸煙和感染共同導致COPD的病理機制。本實驗僅揭示了短期香煙煙霧對氣道的急性炎癥刺激作用和免疫反應,更長時間的香煙刺激以及合并反復感染的病理機制,有待進一步研究。

