灌漿期糯米淀粉精細結構變化
王萬里 , 田耀旗 , 謝正軍 *
(1.食品科學與技術國家重點實驗室,江南大學,江蘇 無錫 214122;2.江南大學 食品學院,江蘇 無錫 214122)
淀粉主要在植物體內合成,是食品工業的重要原料,醫藥、化工、紡織工業的主要配料[1]。淀粉合成與水稻胚乳中ADPG焦磷酸化酶(ADPGPase)、淀粉合成酶(SSase)、淀粉分支酶(SBE)和淀粉脫支酶(DBE)密切相關[2]。其中,SSase是一種葡萄糖轉移酶,以腺苷二磷酸葡萄糖(ADPG)為底物,通過α-1,4糖苷鍵不斷增加直鏈或者支鏈的葡糖糖單元[3];SBE在支鏈淀粉形成過程中的作用機制是切斷α-1,4糖苷鍵并形成α-1,6糖苷鍵,與可溶性淀粉酶共同作用形成支鏈淀粉[4]。DBE能夠切去支鏈淀粉不規整的分支,在支鏈淀粉合成過程中也起重要作用[5]。然而,在灌漿期稻米成熟過程中,上述各大酶類活性呈動態變化,會引起淀粉精細結構變化[6]。因此收割時間必然影響其在食品應用中的性能,比如慢消化性和抗老化特性。
作 者 采 用 SEM、LPSA、XRD、HPLC-AEC、HPSEC-MALLS-RI技術,研究灌漿期間糯米淀粉形態、晶體、分子結構變化,以期揭示糯稻米灌漿期成熟過程中淀粉精細結構變化規律,為篩選慢消化性、抗老化性等新型糯米淀粉食品的加工原料提供科學依據。
1 材料與方法
1.1 試劑與儀器
灌漿期糯米:湖北黃岡市售產品;葡糖糖測定試劑盒(葡糖氧化酶法):上海榮盛生物藥業有限公司產品;異淀粉酶:1 000 u/mL,愛爾蘭megazyme公司產品。
掃描電子顯微鏡:Quanta-200型,荷蘭FEI公司產品;激光粒度分析儀:S3500型,美國Microtrac公司產品;X-射線衍射儀:D8-Advance型,德國Bruker AXS公司產品;高效尺寸排阻色譜聯合多角度激光檢測器和示差檢測器檢測系統;輸送泵:1525型,美國Waters公司產品;多角度激光檢測儀:DAWN HELEOSⅡ型,美國Wyatt公司產品;示差折光檢測器:2414型,美國Waters公司產品;高效陰離子交換色譜:ICS5000型,美國Dionex公司產品。
1.2 實驗方法
1.2.1 灌漿期稻谷取樣 灌漿期糯米稻谷收割于湖北蘄春大別山區,灌漿時間分別為揚花后11、13、15、17、22、27 和 35 d,收割后冷凍干燥,然后置于自封袋密封于-50℃保存。
1.2.2 灌漿期淀粉提取 淀粉提取參考Chiou等人方法[7],并略改進。脫殼后的糯米500 g于1 L質量分數0.2%NaOH溶液浸泡24 h,去上清液后用NaOH溶液洗3次,磨碎,然后加入3 L質量分數0.2%NaOH溶液,過膠體磨,再稀釋到5 L置于圓柱玻璃器皿中,靜置1 h,沉淀分為3層,取中間層(淀粉),加去離子水,并用質量分數0.1%HCl溶液中和,離心(5 000 r/min,5 min),去上清液,沉淀淀粉用去離子水洗3遍,于40℃熱風干燥箱中干燥3 d,過100目篩后,在盛有飽和氯化鈉水溶液的密閉容器中平衡1周備用。
1.2.3 淀粉顆粒形態測定 在室溫下,將原淀粉分別固定在樣品臺上,鍍金(10 nm),抽真空后在5.0 kV加速電壓下用掃描電鏡觀察,并拍下掃描圖片,測定淀粉顆粒粒徑分布[8-9]。
1.2.4 淀粉晶體結構測定 分別稱取0.5 g淀粉制成平整平面樣品試片[10]。測試條件為:加速電壓40 kV,電流 30 mA,掃描范圍(2θ)為 3°~45°,掃描速度為 2°/min,步長 0.02°,實驗重復 3 次,用 MDI Jade 5.0軟件進行結果分析。
1.2.5 淀粉分子結構測定 側鏈分布測定參照Guodong Liu等人方法[11]。50 mg原淀粉加入10 mL醋酸鈉緩沖液(0.01 mol/L,pH 3.5),然后在沸水浴中加熱30 min,冷卻到37℃,取2 mL淀粉溶液于5 mL離心管中并加入100 μL稀釋后的異淀粉酶(100 U/mL),震蕩保溫24 h后,沸水浴5 min滅活,離心(5 000 r/min,10 min),取出0.5 mL 上清液加入4.5 mL去離子水,過0.45 μm水相濾膜,注入高效陰離子交換色譜系統(HPAEC-PAD)。測定條件:色譜柱 CarboPac PA200,柱溫 25 ℃,進樣量 25 μL;流動相A為150 mmol/L NaOH溶液,流動相B為含500 mmol/L NaAC 的 NaOH(150 mmol/L)溶液;流量1 mL/min,洗脫條件參照許晶晶等人的方法[12]。
相對分子質量測定參照Song-Ho Yoo等人的方法[13]。分別將樣品溶解于體積分數90%DMSO溶液中,沸水浴1 h,冷卻后加5倍體積的無水乙醇靜置 1 h,離心(5 000 r/min,5 min),用乙醇洗滌 3 次后烘干。制備樣品溶液,于沸水浴中加熱1 h,使樣品充分分散溶解,然后過0.45 μm水相濾膜,注入HPSEC-MALLS-RI系統中。測定條件:樣品測定前,系統經葡聚糖標準系列物校正;串聯色譜柱為OHpak SB-806 HQ,OHpak SB-804 HQ;流動相為含有質量分數0.02%NaN3的NaNO3溶液,流量0.6 mL/min,柱溫55℃;多角度激光光散射儀的光源波長為623.8 nm。用系統自帶的Astra軟件分析所得實驗數據,并采用兩階多項式Berry方程擬合得出淀粉相對分子質量分布。
2 結果分析
2.1 灌漿期糯米顆粒形貌分析
由圖1可見,不同灌漿天數的糯米淀粉顆粒大多數呈多邊形,且粒徑多分布在5~8 μm范圍。淀粉顆粒呈現出一些凹坑,這是由于淀粉經堿液處理,蛋白質從淀粉表面剝離時,造成結構破損,導致顆粒表面出現凹坑[14]。在灌漿初期可以看到有少量的小球體狀,即含有未成熟淀粉顆粒的淀粉體。隨著灌漿天數的增加,這種顆粒漸漸變大并裂變成多邊體的顆粒。灌漿第35 d,稻谷成熟時,這種球狀體淀粉顆粒轉化成為成熟的多邊體淀粉顆粒并消失。


圖1 不同灌漿天數糯米淀粉掃描電鏡圖Fig.1 SEM of waxy rice starches from seeds harvested at different pollination stage
從圖2可知,在灌漿期間,整體淀粉顆粒峰值粒徑在不斷增大,從5.92 μm 增大到6.77 μm。 反映了淀粉中未成熟淀粉顆粒粒徑不斷增加。在灌漿前期,有關淀粉合成的酶活性較高,淀粉積累比較快速,使粒徑增長比較快。在灌漿后期大部分淀粉顆粒成熟,且主要淀粉合成酶酶活極低,使淀粉粒徑維持在6.7 μm左右。

圖2 不同灌漿天數糯米淀粉顆粒粒徑分布Fig.2 Particle diameter distribution of waxy rice starches at different pollination stage
2.2 晶體特性分析
淀粉在合成過程中,支鏈淀粉的非還原端與顆粒表面垂直,由內到外,呈放射狀排列分子鏈之間通過氫鍵締結,形成晶體層和無定形層交替的半晶體結構[15]。其中晶體層由側鏈的雙螺旋結構緊密排列而成;無定形層主要包括松散分支點與直鏈淀粉[16]。在淀粉合成過程中,側鏈都有一定的長度要求。并影響分支簇結構的形成,同時造成了淀粉粒晶體結構的差異。如圖3所示,不同灌漿天數糯米淀粉的 X-衍射圖, 樣品的 2θ 角為 15.2°、18.5°、18.2°、23.2°。顯示較強的衍射峰,為A型結晶峰,與先前報道一致[17]。但不同樣品間晶體結構差異主要表現在X衍射圖譜出峰之間的相對強度上,比如灌漿22和27 d 樣品在 2θ=18.2°峰強度比 2θ=17.5°高, 而灌漿13 d淀粉則相反。說明在灌漿期淀粉的晶型不發生改變,但淀粉結晶區內的α-1,6糖苷鍵上的葡萄糖基間的夾角可能發生了變化[18]。說明在灌漿期間糯米淀粉微晶排列或者結晶區的晶胞結構發生了變化。淀粉的結晶度也受支鏈淀粉側鏈長短的影響[19]。在2θ角為20°附近沒有衍射峰出現,表明淀粉中幾乎不含淀粉-脂質復合物晶體。

圖3 不同灌漿天數糯米淀粉的X-衍射圖Fig.3 X-ray diffraction patterns of waxy rice starches from seeds harvested at different pollination stage
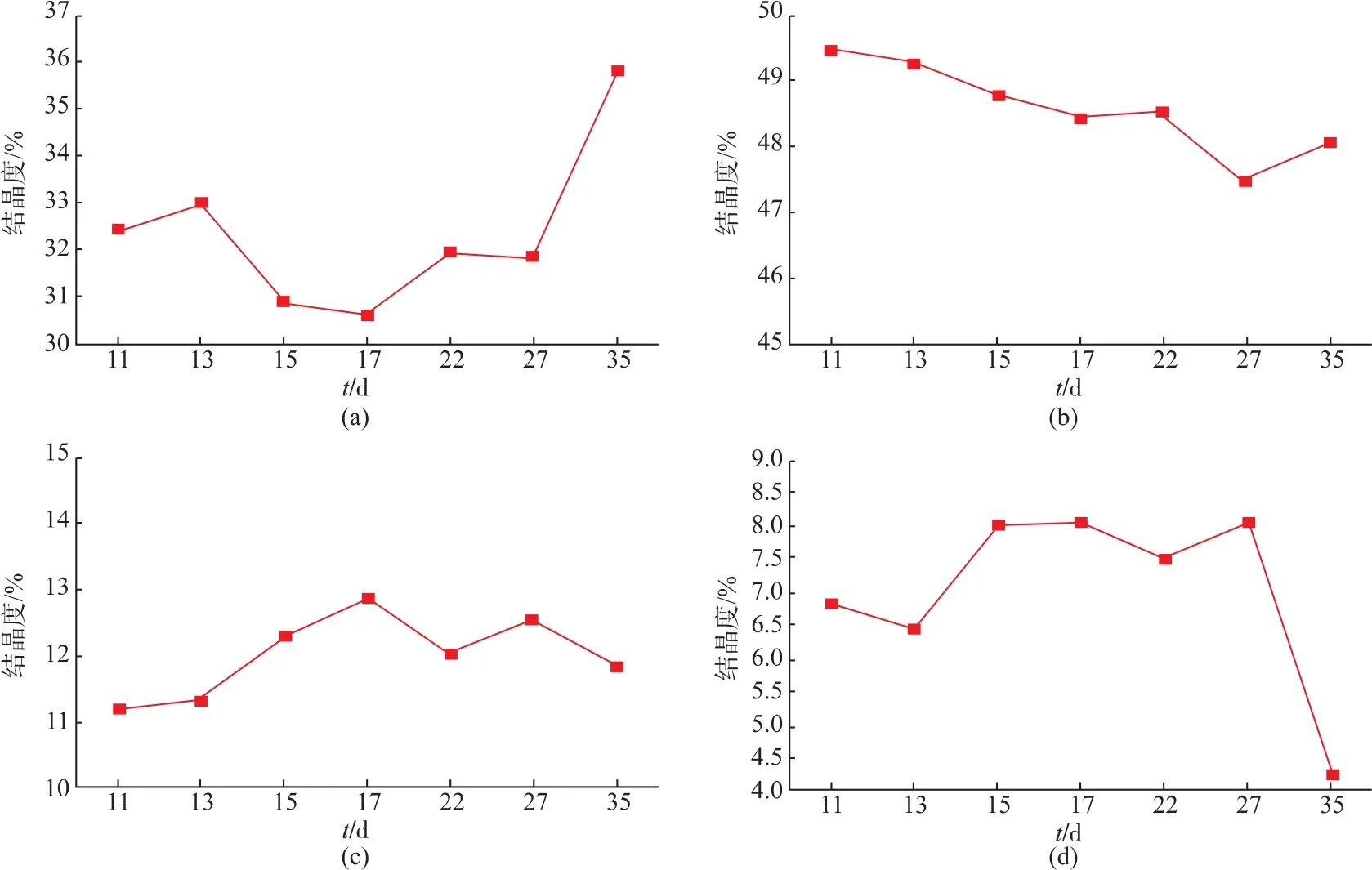
圖4 不同灌漿天數的糯米淀粉側鏈分布變化Fig.4 Unit chain distribution of debranched amylopectins isolated from waxy rice starches at different pollination stage
圖3中相對結晶度的大小表征了淀粉中晶體的含量。從灌漿11~35 d,糯米淀粉的結晶度從31.0%增加到37.5%,說明了反映了晶體含量在不斷增加,從而使灌漿期間淀粉顆粒的結構越來越堅固。
2.3 淀粉分子結構分析
2.3.1 淀粉側鏈分析 根據Liu G報道[11],不同聚合度側鏈劃分:A 鏈,DP 6~12;B1 鏈,DP 13~24;B2鏈,DP 25~36;B3 鏈,DP≥37。 在淀粉顆粒成長過程中,各種有關淀粉合成酶的變化一直在變化,導致淀粉顆粒內外部側鏈比例以及相對分子質量存在差異,糯米淀粉顆粒粒徑分布的變化必然引起分子結構的變化。由圖4可見,在整個灌漿期間A鏈結晶度整體表現為先略下降再增加的趨勢,B1鏈結晶度整體為下降態勢。B2鏈結晶度基本在11.21%~12.85%范圍內,變化比較小。其中A和B1鏈占淀粉側比較大的比例,并形成雙螺旋進而形成結晶。它們的變化趨勢與淀粉相對結晶度變化不一致,但對微晶的排列和晶體的結構產生影響,反映了在灌漿期側鏈變化不足以對淀粉結晶度產生影響,說明其結晶的增加是由其他無定形的轉變而來。鏈B3所占比例較小,在灌漿前期略有增加,在灌漿后期減少到4.25%,在后期,短鏈增加使長鏈含量減少。2.3.2 淀粉分子特性分析 在食品中,淀粉多處于水環境中,用水溶液作溶解液和流動相得出的研究結果更能反映淀粉在水環境中真實的狀態。
由表1可以看出,在灌漿期間,旋轉半徑(Rw)則在153.3~207.6 nm之間,在灌漿后期變大,與重均相對分子質量(Mw)變化一致。重均相對分子質量(Mw) 從灌漿 11 d 的 6.817×107, 到灌漿 17 d 為5.905×107,然后灌漿 27 d淀粉的相對分子質量1.696×108最大。糯米淀粉的數均相對分子質量(Mn)變化范圍從 4.924×107~1.428×108。Z 均相對分子質量(Mz)在 4.634×107~1.800×108范圍內。整體來看,灌漿后期淀粉的Mw和Mn比前期大,說明了具有高密度側鏈的大分子淀粉含量增加。
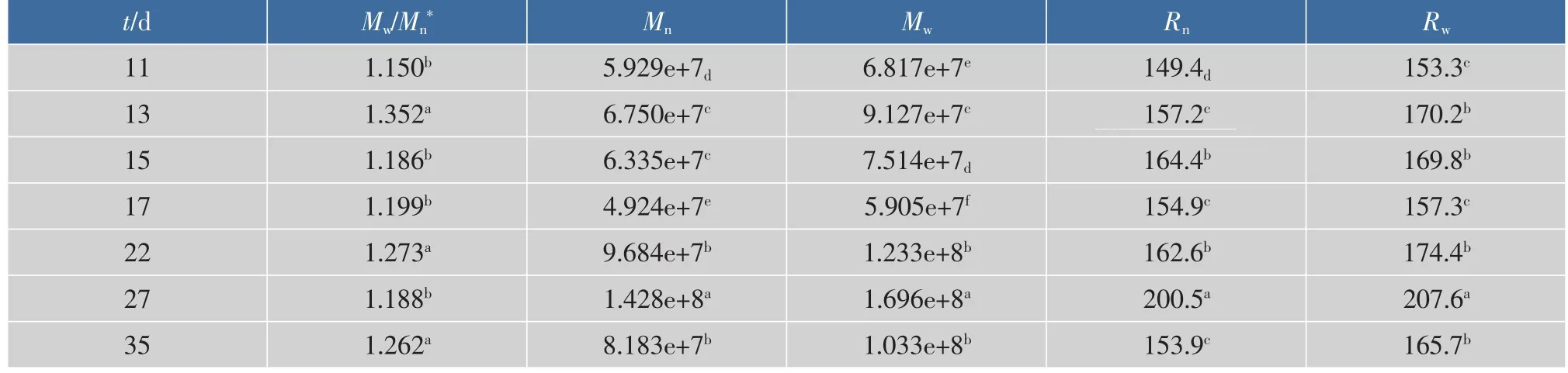
表1 不同灌漿時間糯米淀粉分子特性Table 1 Molecular characterization of waxy rice starches at different pollination stage
2.3.3 淀粉分子構象分析 淀粉大分子在水溶液中重均相對分子質量與均方根半徑(RMS)的關系,可以用公式表示:RMS=KMγ表示。RMS隨著Mw的增大而增大。指數γ可表征溶液中大分子不同的構象。γ為0.33時,大分子為球狀構象,γ為0.5-0.6時為無規則的線團構象。
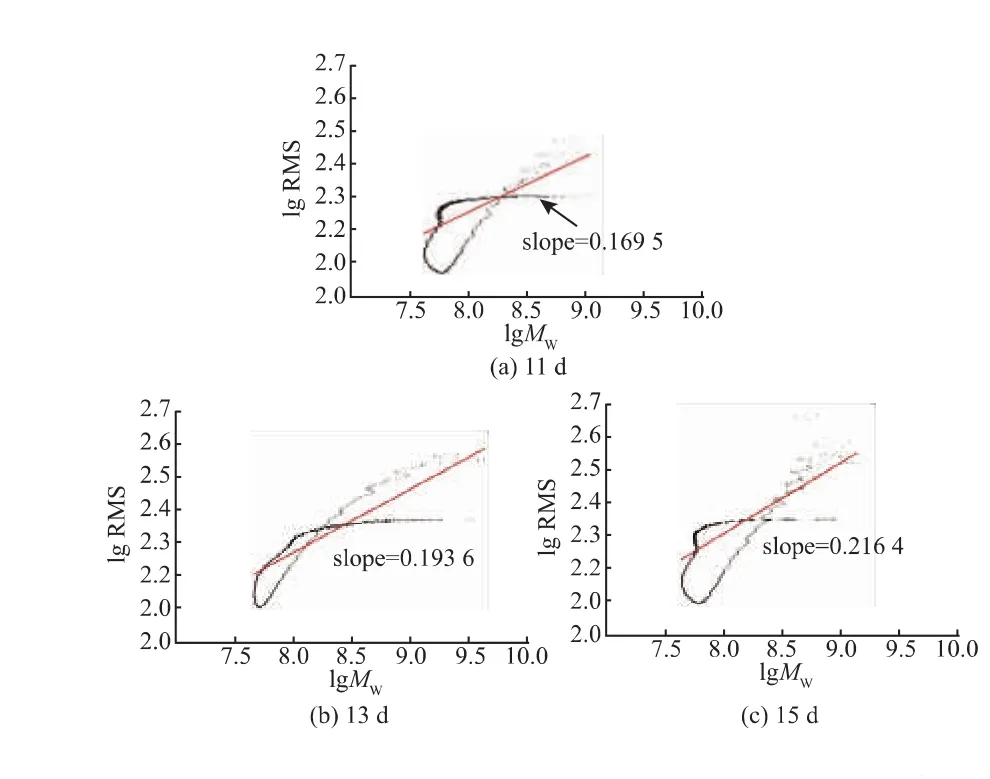

圖5 不同灌漿天數糯米淀粉的RMS半徑對摩爾質量圖(直線是對數據的擬合)Fig.5 Relationships of between the weight-average molecular weight (Mw) and z-averaged mean square radius(RMS)
由圖5可見,斜率即γ在0.1378~0.2164范圍內,這是由于淀粉在水溶液中聚集導致的。近似水平的數據點所在的RMS代表著不同樣品的聚集體所占體積的大小。聚集特性受淀粉相對分子質量的大小和排列的影響。 灌漿 11、13、15、17、22、27、35 d糯米淀粉聚集體的 RMS分別為 200、235、220、207、230、250、213 nm。灌漿27 d糯米淀粉具有較大聚集體,說明其在水溶液中比較容易聚集。
3 結語
1)在灌漿初期出現小球體狀未成熟淀粉顆粒,隨著灌漿天數的增加,顆粒峰值粒徑從5.92 μm增加到 6.77 μm。
2)從灌漿11~35 d,糯米淀粉的晶體結構發生了變化且結晶度從31.0%增加到37.5%,反映了在灌漿期間淀粉中的晶體含量在不斷增加。
3)在灌漿后期,灌漿后期淀粉的 Mw,Mn,Mz比前期較大,具有高密度側鏈的大分子淀粉分子含量增加;灌漿后期的糯米淀粉分子在水溶液比較容易聚集,且形成最大聚集體。
4)灌漿11 d糯米淀粉短鏈A、B1鏈含量較多,相對分子質量較小,同時在水中不易聚集,可作為米糕、糯米團的原料以抑制產品回生;灌漿27 d糯米淀粉短鏈A、B1鏈含量較少,相對分子質量大,容易聚集,可作為粉絲、粉條等產品的原料以促進產品回生硬化。灌漿35 d糯米顆粒最大且結晶度最大,可用來制作抗性淀粉、慢消化淀粉等產品的主要原料。

