遼寧地區豬偽狂犬病毒病原學檢測與遺傳演化分析
楊洺揚,楊本勇,申貫男,關 淼,李井春,梁 喬,張 健,李 蓉,王宏燕,楊國麗
(遼寧省動物疫病預防控制中心,遼寧 沈陽 110164)
偽狂犬病(Pseudorabies,PR)是由偽狂犬病毒(Pseudorabies virus,PRV)(皰疹病毒1型,奧耶茲氏病病毒Aujeszky’disease virus)引起的多種家畜和野生動物共患傳染病[1]。偽狂犬病毒可感染犬、貓、老鼠、山羊、綿羊、牛、豬和多種野生動物等,但豬是偽狂犬病毒唯一自然宿主[2-3]。豬只感染后主要表現為母豬繁殖障礙和仔豬神經癥狀并伴有較高的死亡率。目前該病在我國已廣泛存在,給我國養豬業造成極大經濟損失,我國農業部已將其列為二類動物疫病[4-7]。
偽狂犬病毒是屬于水痘病毒屬,皰疹病毒科,α皰疹病毒亞科的線型雙股DNA病毒,目前僅有1個血清型。病毒基因組共包含143 461個脫氧核糖核苷酸以及不少于72個開放閱讀框編碼的約70個病毒蛋白。其中gD基因所編碼蛋白是重要的中和抗原,與誘導產生免疫保護反應有關[8]。gE基因是主要的毒力基因之一,能夠促進感染細胞與非感染細胞間的融合,介導病毒的細胞間擴散,是偽狂犬病毒入侵中樞神經的必需致病因子[9]。因此,gD、gE蛋白基因序列的比對分析對于偽狂犬病毒的遺傳演化分析具有重要意義[10-11]。
本研究對遼寧地區采集的豬組織臟器樣品進行豬偽狂犬病毒實時熒光PCR試驗檢測,將其中1株陽性毒株命名為LNP-1株并進行gD、gE基因測序和遺傳進化分析,為深入研究遼寧省豬偽狂犬病流行規律提供科學的依據。
1 材料與方法
1.1 材料
1.1.1 樣品來源2017年8月,遼寧省某無害化處理廠采集豬組織臟器30份。
1.1.2 主要試劑DNA提取試劑DNA/RNA磁珠法核酸提取試劑盒購自天隆科技公司,熒光PCR反應試劑豬偽狂犬病毒(gE基因)實時熒光PCR檢測試劑盒購自世紀元亨公司,PCR反應試劑高GC含量模板PCR擴增試劑盒購自生工生物公司,凝膠回收試劑DNA片段純化回收試劑盒購自Omega公司,其他化學試劑為分析純。
1.1.3 引物參照GenBank已登錄的Ea株、Fa株、JS-2012株、Battha株等參考毒株的基因組序列,應用Primer 5.0軟件設計針對gD基因和gE基因的特異性擴增引物(gD1、gE1),2對引物均由生工生物技術有限公司合成。
1.2 方法
1.2.1 病毒提取和實時熒光PCR檢測按照DNA/RNA提取試劑盒說明書和豬偽狂犬(gE基因)實時熒光PCR檢測試劑盒說明書方法進行。
1.2.2 gD基因/gE基因PCR擴增利用引物gD1/gE1擴增偽狂犬病毒gD/gE基因序列,反應體系25 μL:DNA模 板 2.5 μL,2×High GC PCR Buffer(withMg2+)12.5 μL,上、下游引物各 1 μL,dNTP Mix 0.25 μL,Taq DNA Polymerase 0.25 μL,Sterilized ddH2O 7.5 μL補足。反應程序gD:95℃5 min,94℃50 s,55℃45 s,72℃75 s,72℃10 min。gE:95℃5 min,94℃50 s,56.5℃45 s,72℃100 s,72℃10 min。PCR擴增產物用1%瓊脂糖凝膠電泳檢測。
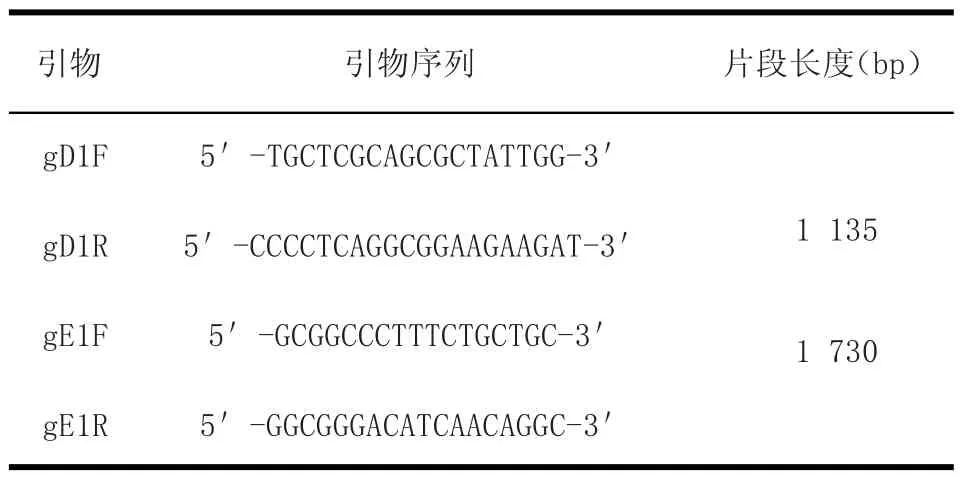
表1 引物Table 1Primers
1.2.3 目的片段回收測序利用DNA片段純化/回收試劑盒回收目的片段,送至生工生物技術有限公司進行基因測序。
1.2.4 gD基因/gE基因序列拼接分析比對利用DNA-STAR軟件Editseq和Megalign程序進行gD基因/gE基因序列拼接,與GenBank中登錄的PRV參考毒株進行同源性比較并構建基因系統進化樹,分析毒株遺傳演化規律。
2 結果與分析
2.1 實時熒光 P C R檢測結果對采集自無害化處理廠30份豬組織臟器樣品進行DNA核酸提取實時熒光PCR檢測。結果表明,4份樣品為偽狂犬gE基因核酸陽性,將其中一株命名為LNP-1株CT值16.2(如圖1)。
2.2 g D/ g E基因 P C R擴增結果將LNP-1株利用gD/gE基因引物特異性擴增,經瓊脂糖凝膠電泳檢測顯示符合擴增目的片段大小(如圖2),經純化回收后送生物公司測序。
2.3 g D/ g E基因序列分析比對結果
2.3.1 gD基因分析比對結果PRV LNP-1株gD基因全長1 203 bp,序列相對保守。gD基因的同源性分析結果(如圖3)表明PRV LNP-1株的gD基因與其他分離株的核酸序列同源性均在98%以上。其與TJ株,HeN1株的gD基因序列同源性最高,達到99.9%。以GenBank中提取的部分代表毒株gD基因序列作為參考序列構建系統進化樹(如圖4)。結果表明LNP-1株gD基因與TJ、HeN1、ZJ01等近年來我國分離毒株遺傳關系接近,有相同進化源。與另一分支的Bartha、Kaplan、Kolchis等早期國外經典毒株遺傳關系較遠。將基因序列進行比對發現,gD基因與經典疫苗毒株Bartha株gD基因相比在831~836位之間插入了連續的6個堿基,存在多個A-G替換(如圖5)。

圖1 實時熒光PCR檢測結果Fig.1 Detection result by real-time fluorescent quantitative PCR
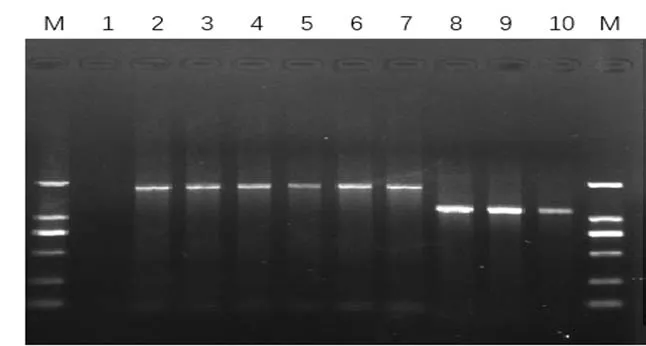
圖2 LNP-1株基因擴增結果Fig.2 RT-PCR amplication of LNP-1

圖3 PRV LNP-1株和參考毒株間的gD基因的同源性比較Fig.3 Sequence similarility of gD gene of LNP-1 and other reference strains
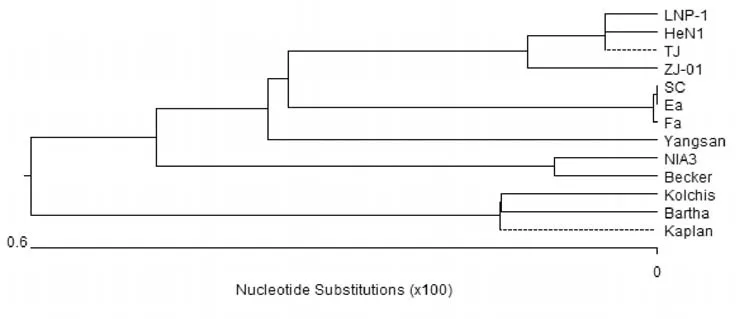
圖4 PRV LNP-1株gD基因進化樹分析Fig.4 Phylogenetic analysis of PRV LNP-1 gD gene
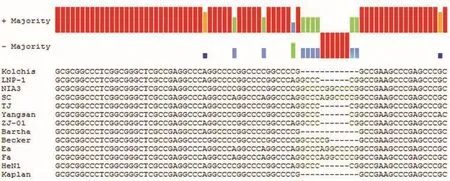
圖5 PRV LNP-1株和參考毒株間的gD基因的序列分析Fig.5 Sequence analysis of gD gene of LNP-1 and other reference strains

圖6 PRV LNP-1株和參考毒株間的gE基因的同源性比較Fig.6 Sequence similarility of gE gene of LNP-1 and other reference strains
2.3.2 gE基因分析比對結果 PRV LNP-1株gE基因全長1 740 bp。gE基因的同源性分析結果(如圖6)表明,PRV LNP-1株的gE基因與其他分離株的核酸序列同源性在96.9~99.8%之間。LNP-1株的gE基因與近年來國內分離株(JS-2012株、HLJ8株、HB-BD株)的基因序列同源性最高,達到99.8%。而與其他不同年份分離的毒株同源性相對較低。以GenBank中登錄的部分gE基因全序列作為參考序列,構建系統進化樹(如圖7)。表明LNP-1株gE基因與HB-BD株、HLJ8株、ZJ01株、JS2012株、HeN1株等近年來我國分離毒株遺傳關系接近,有相同進化源。與另一分支的NIA3、Becker、Kaplan、Kolchis等早期國外經典毒株遺傳關系較遠。將LNP-1 gE基因與其他參考毒株兩兩比對分析表明其與不同毒株間存在部分堿基替換,其中以A-G替換為主。另外,與其他參考毒株進行多序列比對,發現LNP-1 gE基因序列中最具特征性的變化就是在兩個部位分別存在3個連續堿基的插入,分別是第142~144位GAC插入以及1 488~1 490位CGA的插入(如圖8)。
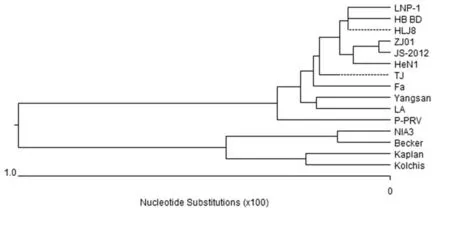
圖7 PRV LNP-1株gE基因進化樹分析Fig.7 Phylogenetic analysis of PRV LNP-1 gE gene

圖8 PRV LNP-1株和參考毒株間的gE基因的序列分析Fig.8 Sequence analysis of gE gene of LNP-1 and other reference strains
3 討論
本研究結果分析表明PRV LNP-1毒株基因與HeN1株、TJ株、ZJ01株、JS-2012株等近年來我國分離毒株遺傳關系接近,有相同進化源。與另一分支的Bartha、Kaplan、Kolchis等早期國外經典毒株遺傳關系較遠。基因序列比對發現,gD基因與經典疫苗毒株Bartha株gD基因相比在831~836位之間插入了連續的6個堿基即增加2個氨基酸,并有多個A-G替換,相關學者推斷可能會導致抗原性及免疫原性發生變化[12-13]。gE基因與近年來國內分離變異毒株(JS-2012株、HLJ8株、HB-BD株)的基因序列同源性很高,并且基因序列中第142~144位和1 488~1 490位分別存在GAC和CGA堿基插入,從而增加了1個天冬氨酸,符合近年國內偽狂犬變異毒株gE基因突變特征,因此推斷PRV LNP-1毒株可能為偽狂犬變異毒株,但該突變是否能夠改變病毒毒力和抗原性,導致目前疫苗免疫失敗仍需進一步研究[14-16]。

