是誰拿到通往斯德哥爾摩的門票
——2018年諾貝爾科學獎概覽
編譯 方宇寧

2018年諾貝爾生理學或醫學、物理學和化學獎分別授予在癌癥治療、增強激光束強度和進化蛋白質研究方面做出杰出貢獻的科學家
對于世界頂尖的科學家們來說,10月初是他們翹首以盼的一段日子,盡管很少有人會承認這一點,但許多為科學事業做出了杰出貢獻的人都希望在這個時候會有一個電話打進來,而且通常是在午夜,這個電話將告訴他們,他們被邀請參加在斯德哥爾摩舉行的圣誕季節的慶祝活動,當然還有不菲的獎金。阿爾弗雷德·諾貝爾在他的遺囑中列出的頒發科學獎三大學科——物理學、化學、生理學或醫學——被認為是對人類做出重大貢獻的科學研究領域,雖然也有一些人認為這些獎項已經過時,但獲得這幾個獎項的諾獎得主,他們的聲望仍將如日中天。
生理學或醫學獎:讓治愈癌癥有望成為現實
這一次的生理學或醫學獎授予在腫瘤免疫領域做出貢獻的德克薩斯大學的詹姆斯·艾利森(James Allison)和日本京都大學免疫學家本庶佑(Tasuku Honjo),他們在“抑制消極免疫調節作用以治療癌癥”研究中的重大發現為人類治愈癌癥帶來了新的希望。一些晚期癌癥患者通過治療病情得以緩解的病例表明,利用人體免疫系統來攻擊惡性腫瘤的夢想有可能得以實現。免疫系統是一個防御寄生蟲和病原體的細胞網絡。然而,幾十年來想要利用它有效攻擊癌癥的免疫療法的努力都無疾而終,到20世紀90年代止,多次失敗導致大多數研究者和公司不得不放棄這一領域的研究和開發。
艾利森博士是為數不多從未失去希望的人之一,他對在T細胞表面發現的一種叫作CTLA-4的蛋白質特別感興趣,T細胞是免疫系統中主要的細胞類型之一。1994年,當他在加州大學伯克利分校時,他和其他人發現CTLA-4抑制了T細胞對癌癥的反應能力,于是他通過抗體來阻止這種蛋白質產生,從而阻止了對免疫細胞的抑制作用,被解除抑制作用的T細胞可以通過攻擊癌細胞來對腫瘤做出反應,實驗表明,被注入這種CTLA-4阻斷抗體的小鼠,它們體內的腫瘤很快就消失了。
在太平洋的另一邊,日本京都大學免疫學家本庶佑博士自1992年以來一直在研究另一種不同的免疫系統蛋白質,1999年他證明了這種蛋白質PD-1像CTLA-4一樣,似乎也對免疫系統產生了抑制作用。這再一次表明,阻斷這種蛋白質的活性似乎是一種很有前途的抗癌策略。本庶佑博士非常確信這一點,他一直在推動這方面的研究,他找到了一家生物技術公司,嘗試將他的研究成果開發成一種癌癥治療方法。
最終,一些公司開始開發針對這兩個“免疫檢查點”蛋白質的抑制劑分子,2010年,制藥公司百時美施貴寶開發了一種藥物,是用來治療惡性黑色素瘤的抗CTLA-4的抗體,結果令人震驚,這是第一種能夠提高這種疾病生存率的藥物。
今天,對免疫檢查點抑制劑的研究正在蓬勃發展。事實證明,對PD-1產生影響的分子在制藥公司中更受歡迎,因為與CTLA-4有關的一些副作用更難處理,目前1 100多個與PD-1相關的試驗正在進行。免疫療法現在是腫瘤學最熱門的領域,在未來5到10年里,它很可能會改變多種癌癥的治療方式。
物理學獎:開發光學工具、增強激光束光強
2018年諾貝爾物理學獎由發明了“光學鑷子”及其在生物系統中的應用的美國物理學家阿瑟·阿斯金(Arthur Ashkin)與研發出制造高強度、超短激光脈沖方法的美國學者杰拉德·穆魯(G é rard Mourou)和加拿大學者唐娜·斯特里克蘭(Donna Strickland)分享,斯特里克蘭是第3位獲諾貝爾物理學獎的女性。
阿瑟·阿斯金曾在貝爾實驗室工作,現已退休,他發明的光學鑷子可通過產生的微小激光束操縱極微小物質,如生物細胞、病毒甚至單個原子。他發明的方法之所以可行是因為正如麥克斯韋在1862年時所提出并于1900年由彼得·列別捷夫(Pyotr Lebedev)所證明的理論那樣,發光的光子攜帶動量,意味著它們可對接觸到的任何表面施加壓力。
阿斯金博士一開始的發明與科幻小說中常見的牽引光束正好相反,不是將物體拉向激光發射器,而是利用輻射壓力將需要操縱的物質推開。之后他很快對這一發明做了改進,讓激光束的中間部分變得更強,由此產生了一種力,與直覺相反,它往往是將抓取到的粒子移回到光束中心,然后將它困在那里,再加上一個聚焦激光的顯微鏡頭,產生一種拉力來對抗推力。他發明的這種裝置可以穩穩地操縱粒子等物質,甚至可以在三維空間中隨意移動它們。
這聽起來很復雜,其中煩瑣的數學計算并不適合一般人。諾貝爾獎委員以電吹風和乒乓球為道具展示了其基本原理,任何記得在學校里學過的物理學知識的人都知道,吹風機可以將乒乓球這樣比較輕的物體困在熱空氣中,使它懸浮起來。目前,阿斯金博士發明的方法已經在許多科學領域內得到應用,從探測細胞中微小分子機器的結構,到一次夾住一個原子組裝某種化學分子等。
自1960年研發出制造高強度、超短激光脈沖的方法之后,激光的最大光強迅速上升(見下圖),到1970年時提升了近10萬倍,但之后一直停滯不前。但在斯特里克蘭博士(她在紐約州羅切斯特大學的博士論文中曾探討過這個問題)和她的導師穆魯博士研發出了“啁啾脈沖增強技術”后,激光束的強度才再次迅速提升。
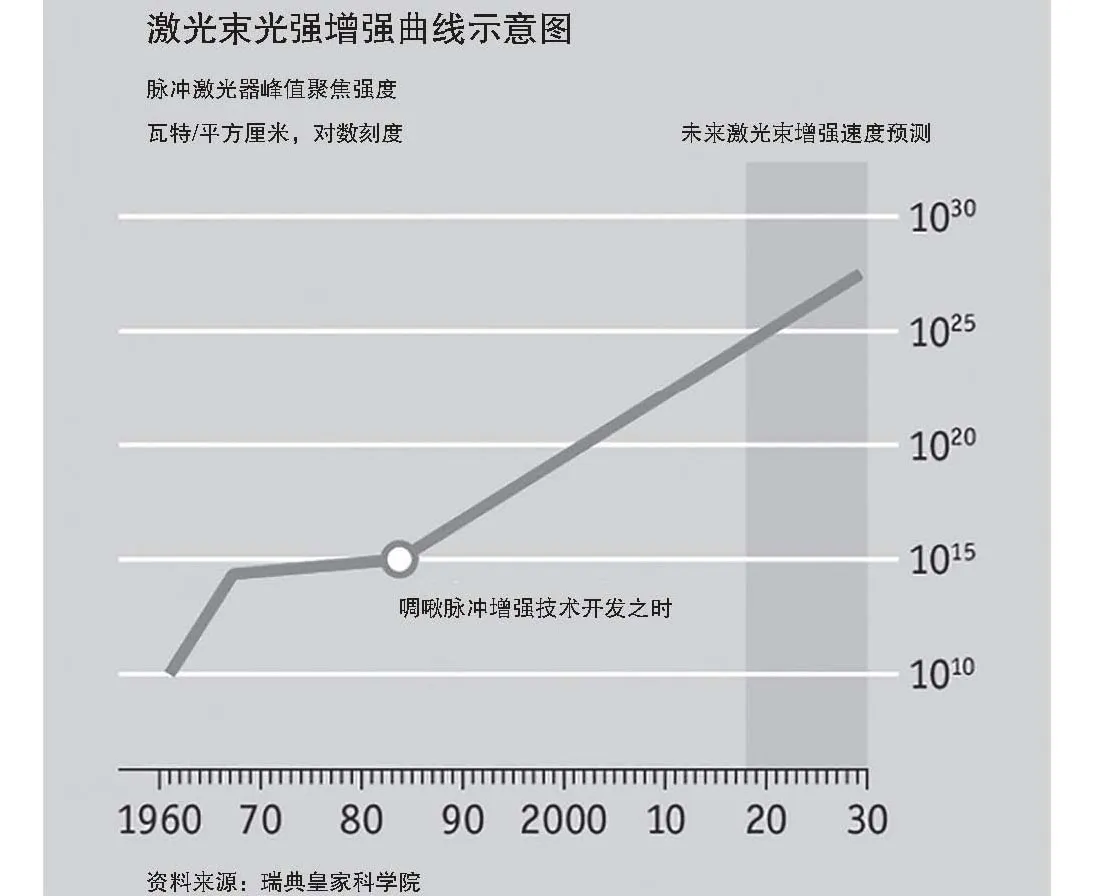
資料來源:瑞典皇家科學院
產生高強度激光光束的困難在于,它們會對發出激光光束的機器造成損害。解決方案的細節聽起來很煩瑣,但它的原理卻很簡單,讓短歷時的激光束持續更久時間。同樣的能量在更長的時間內傳播,會導致產生更低的最大功率,由此產生的光束可以在不破壞任何敏感元件的情況下再得到進一步增強。最后一步是將增強的光束壓縮到最初的短歷時,從而產生極大的功率,現代激光束可以達到一拍瓦量級的峰值功率,所產生的能量大約是核電站的100萬倍。
大功率短激光脈沖激光器用途廣泛。諾貝爾獎委員會重點關注的是常見的眼部手術,激光光束在眼部手術中可用于眼睛表面的塑形,以矯正近視。其他用途包括從新型粒子加速器的工作試驗,到獲得超短時間尺度上探測物質行為的能力。
化學獎:駕馭進化力量推動生物化學革命
2018年諾貝爾化學獎由發明了“酶的定向進化”技術的美國化學家、加州理工學院的弗朗西絲·阿諾德(Frances Arnold)與開發了“噬菌體展示技術”的美國生物化學家喬治·史密斯(George Smith)和英國生物化學家格雷戈里·溫特爵士(Gregory Winter)分享。這3位獲獎者通過駕馭進化的力量,制造出在醫學和化學上有更多用途的蛋白質。例如,由人為定向進化產生的酶被用于制造包括生物燃料到藥物等各種物質,“噬菌體展示”技術產生的抗體可用于對抗人類自身免疫疾病和治療癌癥。
阿諾德博士在大學本科時學的是機械和航天工程,她通過“定向進化”產生合成酶(催化化學反應的蛋白質)分享了這次化學獎的一半。像其他任何一位工程師一樣,剛開始嘗試重新設計酶時,她認為,做出某些改變應該能夠提高它們的催化能力,但事實證明這非常困難。
就像所有的蛋白質一樣,酶是由成千上萬氨基酸組成的鏈狀分子,生物體內的這種分子有20多種。20世紀90年代,阿諾德博士面對重新設計蛋白質可能導致的令人眼花繚亂的各種可能性,她決定放棄以往的做法,轉而進行“定向進化”的嘗試。
她一直在嘗試對枯草桿菌蛋白酶進行修飾,這樣它就可以在二甲基甲酰胺(DMF)這種溶劑中起作用。她開始將各種突變隨機引入到枯草桿菌蛋白酶的基因中,從而產生成千上萬種不同版本的基因。接下來,她將這些經過修飾的基因插入細菌中,產生數千種經過基因修飾的枯草桿菌蛋白酶。
然后她對這些經過基因修飾的枯草桿菌蛋白酶進行評估,看其中哪些酶能夠分解酪蛋白,酪蛋白是二甲基甲酰胺(DMF)中的一種蛋白,然后她再在其中擇優進行進一步隨機突變和篩選,在重復了3輪這一過程后,她發現枯草桿菌蛋白酶的一種變體在溶劑中所起的作用比原來的酶要高出256倍。自從她取得這一突破以來,研究人員(包括阿諾德博士本人)都開始利用這種“定向進化”來定制藥物和生物燃料所需要的酶。

史密斯博士和溫特爵士也在定向進化研究領域做出了他們的貢獻。史密斯博士發明的噬菌體展示技術可用來驅動新蛋白質的進化。它的工作原理是向噬菌體(一種感染細菌的病毒)添加額外的基因,噬菌體通過劫持細菌的蛋白質制造機器來繁殖。然后受到感染的細菌會產生數千份原始病毒的拷貝,即額外基因編碼的蛋白質。
溫特博士(當時他還是一位博士)很快意識到噬菌體展示可以用來引導抗體的進化,這些抗體是專門定制附著在其他蛋白質(通常屬于寄生蟲和病原體的蛋白質)上的蛋白質,為了讓這些蛋白質附著其上,并對被免疫系統破壞的一部分細胞做出標記,他在細胞表面上創造了數十億種不同抗體的噬菌體,并找出那些喜歡以這種方式黏附在TNF-alpha上的抗體,TNF-alpha是一種會引起自身免疫性疾病炎癥的蛋白質,選出最佳候選者然后重復以上過程,經過幾輪這樣的過程產生了一種能與TNF-alpha緊密結合的抗體。
1989年,溫特博士和他的同事成立了一家名為劍橋抗體技術的公司來生產這種他們稱之為阿達木單抗(adadumab)的蛋白質,現在這種蛋白質由一家大型制藥公司雅培進行市場推廣,用于治療風濕性關節炎和炎癥性腸病。溫特博士在2004年被授予爵士爵位。阿達木單抗的成功促使人們努力開發能夠用來攻擊腫瘤、阿爾茨海默病和狼瘡的抗體。
根據阿爾弗雷德·諾貝爾遺囑的規定,諾貝爾獎將授予那些“為人類最大利益”做出貢獻的科學家。2018年,頒獎委員會似乎很好地達成了諾貝爾當年的心愿。
資料來源 The Economist

