HPV聯合MNNG對Het-1A細胞惡性轉化的影響
馬 月,鄭雨虹,趙 超,劉 冉,浦躍樸,尹立紅*
(東南大學公共衛生學院環境醫學工程教育部重點實驗室,江蘇 南京 210009)
食管癌的發生發展是一個多因素作用、多基因參與、多階段發展的復雜性過程[1-2]。1982年Syrj?nen在食管癌組織中觀察到類似人乳頭狀瘤病毒(human papilloma virus,HPV)感染的特征性改變,首次提出了食管癌可能與HPV感染有關的可能性[3]。在認識其復雜病因的過程中,越來越多證據表明HPV感染與食管癌的發生發展相關,但是HPV在細胞轉化的過程中發揮著誘導細胞永生化的作用,作為獨立因素致癌的證據不足,HPV更有可能在食管癌發生發展的過程中發揮著協同和促進作用。環境流行病學研究表明亞硝胺類化合物能夠導致人胃癌、食管癌等多種腫瘤發生,N-甲 基 -N′-硝 基 -N-亞 硝 基 胍 (N-methyl-N′-nitro-N-nitrosoguanidine,MNNG)是一種N-亞硝基化合物,動物實驗表明其可誘發胃癌、食管癌、結直腸癌等。本課題組前期研究結果顯示,淮安食管癌高發區食管癌的發生與HPV感染具有一定關聯,而高發區飲用水檢測中也發現亞硝胺類物質暴露水平較高。因此,本研究通過慢病毒轉染使正常人食管上皮細胞Het-1A穩定表達高危型HPV-18,聯合MNNG染毒構建細胞惡性轉化模型,探討HPV對細胞惡性轉化過程的影響。
1 材料與方法
1.1 實驗材料
人正常食管上皮細胞Het-1A,由東南大學環境醫學工程教育部重點實驗室提供。課題組前期完成慢病毒介導HPV全長基因轉染,通過嘌呤霉素篩選得到陽性克隆,擴增培養后,用熒光定量PCR檢測HPV DNA的表達,獲取穩定攜帶HPV基因組DNA的Het-1A細胞。主要試劑包括:胎牛血清(Genial),RPMI-1640(南京源之信生物技術有限公司),胰蛋白酶和青-鏈霉素混合液(南京生興生物技術有限公司),CCK-8細胞活力檢測試劑盒(上海七海復泰生物科技有限公司),細胞周期檢測試劑盒(江蘇凱基生物技術股份有限公司),BD Matrigel基質膠(Corning)。
1.2 方法
1.2.1 細胞培養 培養基采用PRIM-1640(含10%胎牛血清),MNNG染毒劑量2 μmol/L。細胞分組如下:對照組,轉染空載體病毒的Het-1A細胞,常規培養;HPV-18單獨處理組(HPV),HPV-18-Het-1A穩定轉染株細胞,常規培養;MNNG單獨處理組(MNNG),轉染空載體病毒的Het-1A細胞用2 μmol/L MNNG染毒,每代1次,染毒24 h;MNNG與HPV聯合處理組(HPV+MNNG),HPV-18-Het-1A穩定轉染株細胞用2 μmol/L MNNG染毒,每代1次,染毒24 h。
1.2.2 細胞形態觀察 觀察細胞在持續慢性染毒過程中4組細胞的形態變化,對比染毒初期(第10代)及末期35代細胞形態,并拍照保存。
1.2.3 CCK-8檢測細胞增殖 選取第10代、20代及35代細胞,各組細胞胰酶消化離心,收集對數生長期細胞,以每孔1萬個細胞接種于96孔板,每組設5個平行孔,24 h后按照CCK-8試劑盒說明書每100 μL完全培養基加10 μL CCK-8試劑,于CO2體積分數為5%、37 ℃培養箱中作用2 h后,用酶標儀測定吸光度D(450)值。以對照組為基礎,計算實驗組細胞增殖率。
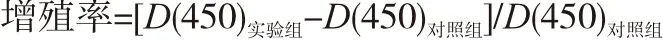
1.2.4 細胞周期檢測 各組細胞胰酶消化離心收集后吹打成單細胞懸液加70%乙醇1 mL,4 ℃固定過夜,加200 μL RNase A于37 ℃孵育30 min以去除RNA,上機前加入500 μL PI染色液混勻后,4 ℃避光染色30 min,采用流式細胞儀檢測。用增殖指數[(S+G2)/(G1+S+G2)×100%]表示細胞的增殖狀況。
1.2.5 Annexin V-APC/PI雙染法檢測細胞凋亡 用不含EDTA胰酶消化4組細胞,各收集3×105個細胞,PBS 洗滌。300 μL結合緩沖液重懸細胞后,分別加入3 μL Annexin V-APC和3 μL PI標記,室溫避光反應,1 h內上流式細胞儀檢測。
1.2.6 檢測細胞侵襲能力 將基質膠溶解到RPMI-1640 培養基后均勻平鋪transwell小室置4 ℃冰箱過夜。將各組細胞制成單細胞懸液,按每孔5×105接種于小室上層,小室下層中加入含20% FBS的培養基,37 ℃、CO2體積分數為5%的細胞培養箱孵育27 h 后清洗小室,甲醇固定,結晶紫染色,洗凈晾干,鏡下拍照計數。
1.2.7 檢測細胞遷移能力 將各組細胞制成單細胞懸液,按每孔2×105個細胞接種于Transwell上層小室,小室下層中加入含20% FBS的培養基,37 ℃、CO2體積分數為5%的細胞培養箱中孵育27 h,清洗小室,甲醇固定,結晶紫染色,洗凈晾干,鏡下拍照計數。
1.2.8 軟瓊脂集落形成試驗 1.4%低熔點瓊脂糖與2×培養基以1∶1的體積等比例混合,制備下層膠置于4 ℃待凝。取4組細胞,胰酶消化離心,接種細胞密度為100/cm2。0.7%低熔點瓊脂糖與2×培養基以1∶1的體積等比例混合,制備上層瓊脂。1 mL上層瓊脂和細胞懸液充分混勻,加入10 cm皿中。37 ℃、CO2體積分數為5%的細胞培養箱中培養3周。倒置顯微鏡下觀察集落的大小,并拍照保存。按下式計算集落形成率,實驗重復3次。
集落形成率=集落數/接種細胞數×100%
1.2.9 裸鼠成瘤試驗 選取4~6周齡裸鼠20只,隨機分成4組,每組5只。結合細胞功能實驗結果及惡性轉化相關指標,將第35代的4組細胞消化后重懸成單細胞懸液,調整濃度為5×107/mL,取0.2 mL接種在裸鼠右側腋下。觀察裸鼠的成瘤情況,并用游標卡尺進行測量,記錄長徑和短徑,按公式(體積=1/2長徑×短徑2)計算腫瘤體積。最后對腫瘤組織進行病理學檢查。
1.3 統計學分析
應用SPSS 19.0軟件對結果進行統計分析。采用方差分析進行比較,檢驗水準α=0.05。
2 結 果
2.1 細胞形態
隨著染毒代數的增加,HPV+MNNG組和MNNG組細胞形態變化明顯,由原來體積較小的圓形鋪路石樣緊密貼合的生長情況轉變為體積增大,出現偽足、拉絲的不規則松散狀態,出現了類間質性轉化樣改變。與HPV組和對照組有明顯差異。細胞形態改變如圖1所示。各組細胞不同代的改變說明MNNG暴露促進了細胞形態的改變,HPV+MNNG聯合作用組與MNNG單獨作用組有相同的變化趨勢,且形態改變更明顯。
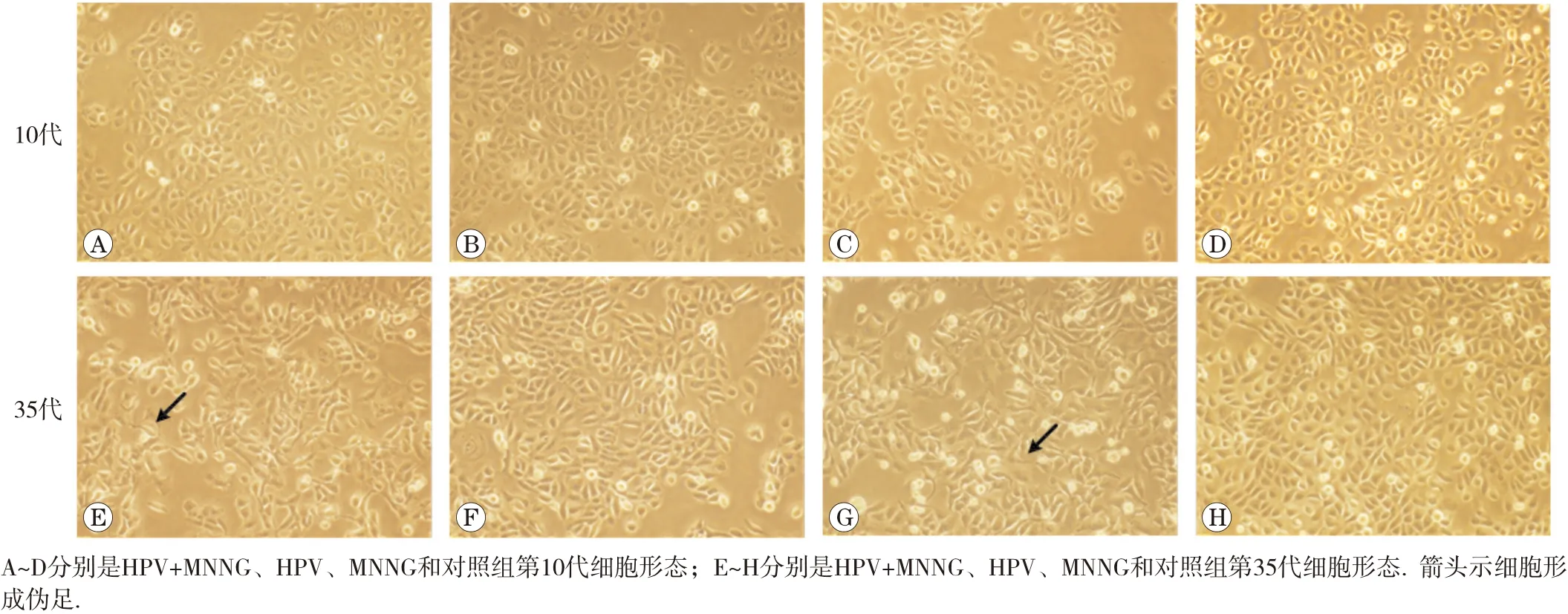
圖1 各組細胞形態變化(×100)
2.2 CCK-8法檢測細胞增殖活力
第10代,染毒初期MNNG單獨染毒組、HPV轉染組及HPV+MNNG聯合作用組細胞增殖率較對照組均升高(P<0.05);第20代聯合作用組、單獨MNNG染毒組和HPV轉染組增殖抑制率分別為(31.21±2.00)%、(20.10±2.14)%、(22.63±2.17)%,增殖活力較對照組(0)均降低(P<0.05);隨著染毒代數的增加,第35代MNNG單獨染毒組、HPV組及HPV+MNNG聯合作用組細胞增殖率較對照組(0)明顯增強(P<0.05),且聯合作用組細胞增殖率[(23.32±2.76)%]高于MNNG染毒組[(12.88±1.93)%] (P<0.05)。MNNG作用下細胞的增殖活力經歷了先升高后下降再升高的過程,在染毒第20和35代時HPV+ MNNG組在MNNG的毒性作用下增殖率改變較MNNG組更明顯,說明在HPV的作用下,細胞對毒物的敏感程度提高,且在染毒35代時,聯合組保持4組最高水平,提示HPV+MNNG聯合作用下促進了細胞的增殖活力,如圖2所示。

圖2 不同代數各組細胞增殖率
2.3 流式細胞術檢測細胞周期
各代細胞周期分布如圖3所示。染毒初期(第10代),細胞受到毒作用刺激處于應激階段,HPV+MNNG組與MNNG組較對照組S期和G2期均增加(P<0.05),且增殖指數HPV+MNNG組[(64.44±0.27)%]明顯高于MNNG組[(61.35±0.03)%](P<0.05)。隨著毒作用的累積,到染毒第20代,染毒組細胞周期發生了阻滯,HPV+MNNG和MNNG組細胞周期分別阻滯在G2期和S期,聯合作用組增殖指數最低[(62.58±0.17)%],顯著低于其他各組(P<0.05)。至染毒第35代,染毒組隨著細胞自我修復的進行,細胞周期分布發生了變化,4組細胞增殖指數由高到低依次是HPV+MNNG組[(69.19±0.02)%]、MNNG組 [(64.92±0.05)%]、 HPV組 [(58.54±0.06) %]和對照組[(60.48±0.05)%],聯合作用組與對照組相比,G1期降低(P<0.05),S期與G2期均增高(P<0.05),說明此階段,HPV+MNNG聯合作用及MNNG單獨作用均對細胞的增殖起促進作用,且聯合作用下細胞的增殖活性最強。此結果提示,HPV可能通過對細胞的周期調控,促進DNA的合成及有絲分裂,促進細胞的增殖,從而促進惡性轉化的發生與發展。
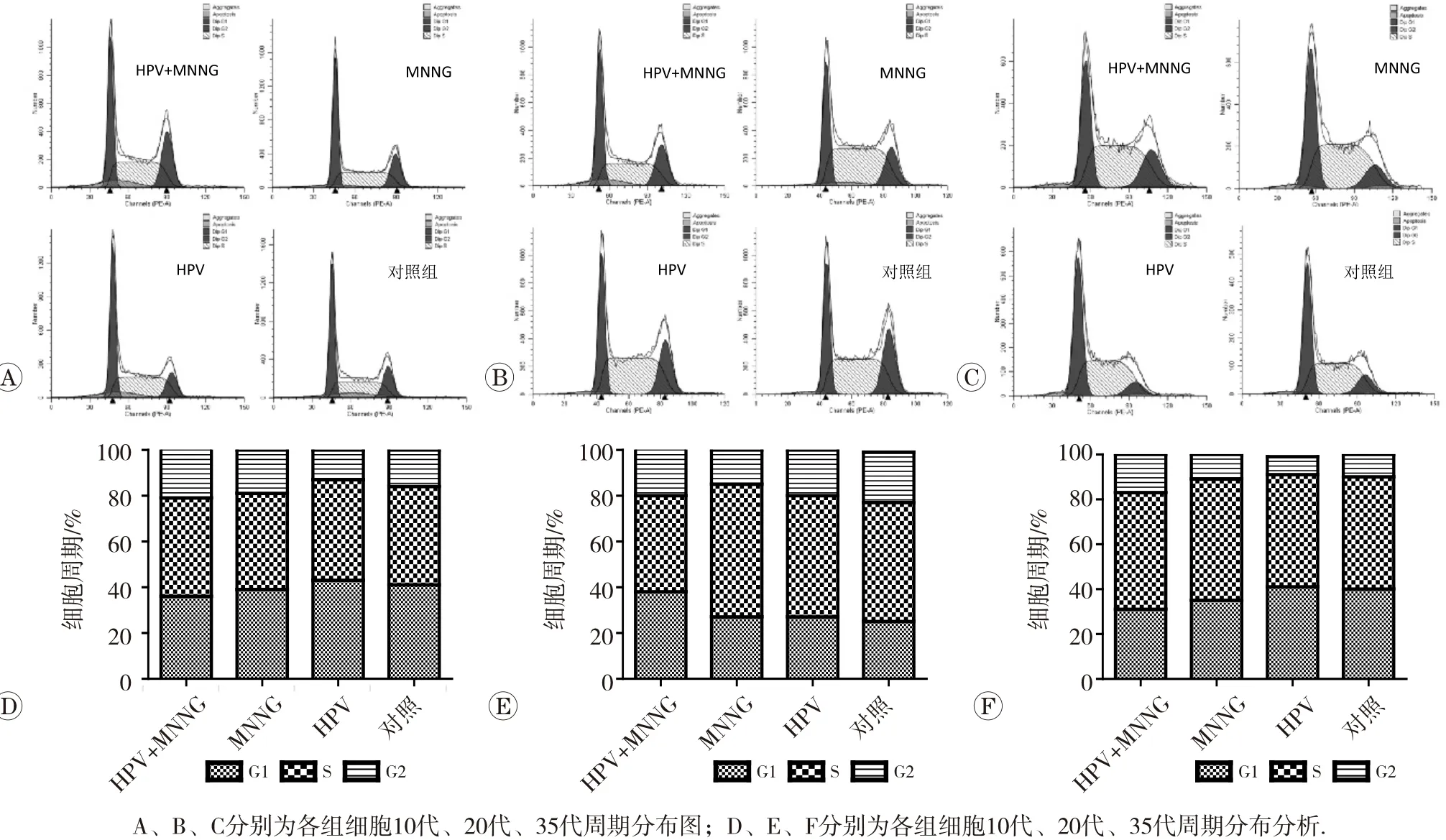
圖3 不同代各組細胞周期分布
2.4 細胞凋亡
MNNG和HPV作用于正常上皮細胞后,細胞凋亡率隨著染毒的代數增加發生了明顯變化。染毒初期(第10代),MNNG組總凋亡率高于其他各組(P<0.05),如表1所示。隨著毒作用累積,第20代HPV+MNNG、MNNG組凋亡率均高于HPV和對照組(P<0.05),如表2所示。染毒至第35代,HPV+MNNG組、HPV組早期凋亡率高于對照組,差異有統計學意義(P<0.05)。4組的總凋亡率由高到低依次為MNNG、HPV+MNNG、HPV和對照組,如表3所示。MNNG組的總凋亡率高于HPV+MNNG組(P<0.05),并且高于HPV組與對照組(P<0.05),說明MNNG+HPV聯合作用下,相比于MNNG單獨作用的細胞凋亡減少。結果表明,HPV作為生物因素對細胞產生的影響是個復雜的過程,在細胞的惡性轉化過程中可能存在不同于單一化學物質的調控途徑,HPV與MNNG的聯合減少了MNNG單獨作用下細胞的凋亡率,同時也說明HPV促進了細胞的增殖,在某種程度上加速了惡性轉化的進程。
表1 第10代各組細胞凋亡率(%,
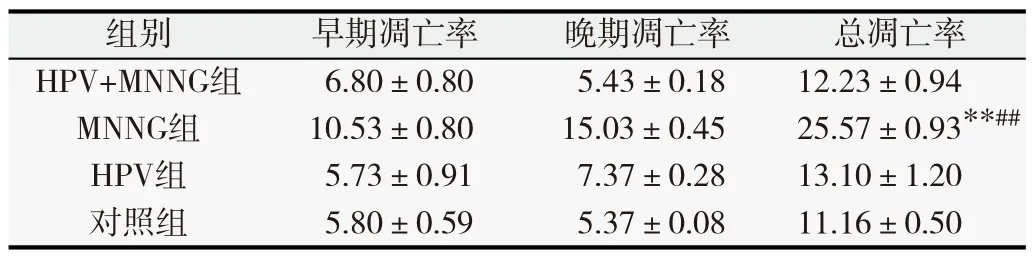
表1 第10代各組細胞凋亡率(%,
與對照組相比,**P<0.01;與聯合作用組比較,# #P<0.01.
總凋亡率12.23±0.94**25.57±0.93##13.10±1.2011.16±0.50
表2 第20代各組細胞凋亡率(%,
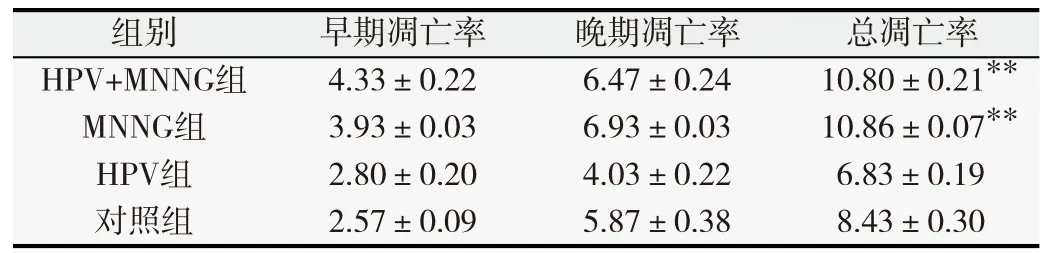
表2 第20代各組細胞凋亡率(%,
與對照組比較,*P<0.05,**P<0.01.
總凋亡率**10.80±0.21**10.86±0.076.83±0.19對照組2.57±0.09 5.87±0.38 8.43±0.30
2.5 細胞侵襲與遷移
細胞的侵襲遷移能力是反映細胞惡性轉化的重要指標。染毒初期(第10代),4組細胞侵襲試驗穿膜數均較少,染毒至第20代,穿膜數均增多,但組間差異均不明顯(P>0.05)。如圖4和圖5所示。細胞染毒至35代,侵襲結果顯示,HPV+MNNG聯合作用組穿膜細胞數(353.4±0.2)明顯高于MNNG組(220.7±0.0)(P<0.01), 而MNNG組與HPV作用組(220.2±0.2)差異不大(P> 0.05),對照組穿膜數最少(162.4±0.7)。細胞遷移試驗顯示,4組細胞穿膜數均有顯著性差異,細胞遷移能力由強到弱依次是HPV+MNNG、HPV、MNNG和對照組(各組細胞穿膜數依次為268.1±0.4、113.3±0.3、111.6±0.5、101.1±0.2)。聯合作用組的遷移能力與MNNG組有顯著性差異(P<0.01),遷移試驗結果如圖6和圖7所示。結果顯示,結合細胞侵襲遷移能力與細胞的形態改變,HPV+MNNG聯合作用可能促進了上皮間質性轉化,后者在腫瘤形成和侵襲轉移中起著重要作用,是引發惡性腫瘤的關鍵因素,提示HPV在腫瘤形成的過程中可能發揮著重要的作用。
表3 第35代各組細胞凋亡率(%,
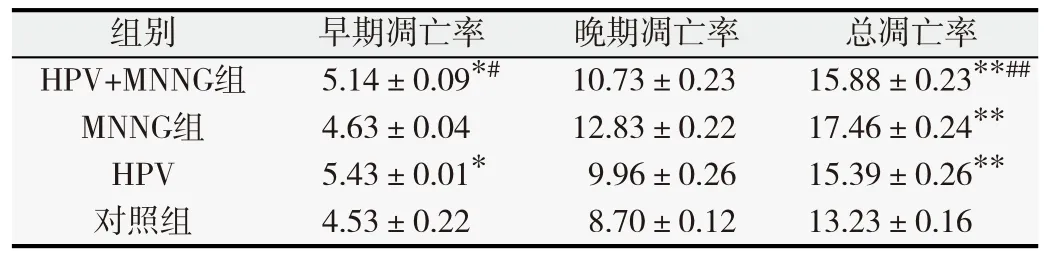
表3 第35代各組細胞凋亡率(%,
與對照組比較,*P<0.05,**P<0.01;與MNNG單獨作用組比較,#P<0.05,##P<0.01.
對照組4.53±0.22 8.70±0.12 13.23±0.16
2.6 軟瓊脂集落形成試驗
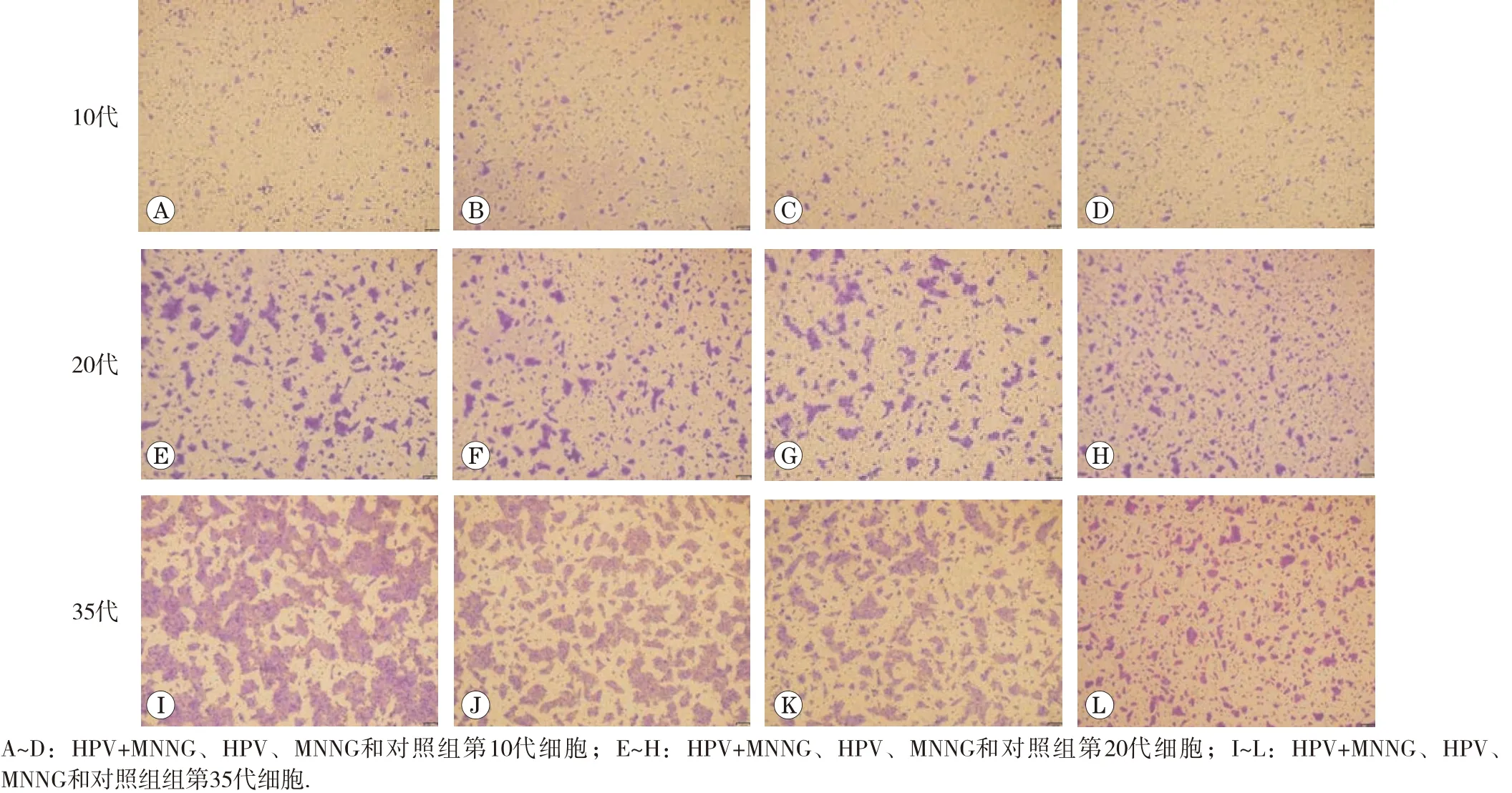
圖4 各組第10、20、35代細胞侵襲試驗結果(×200)
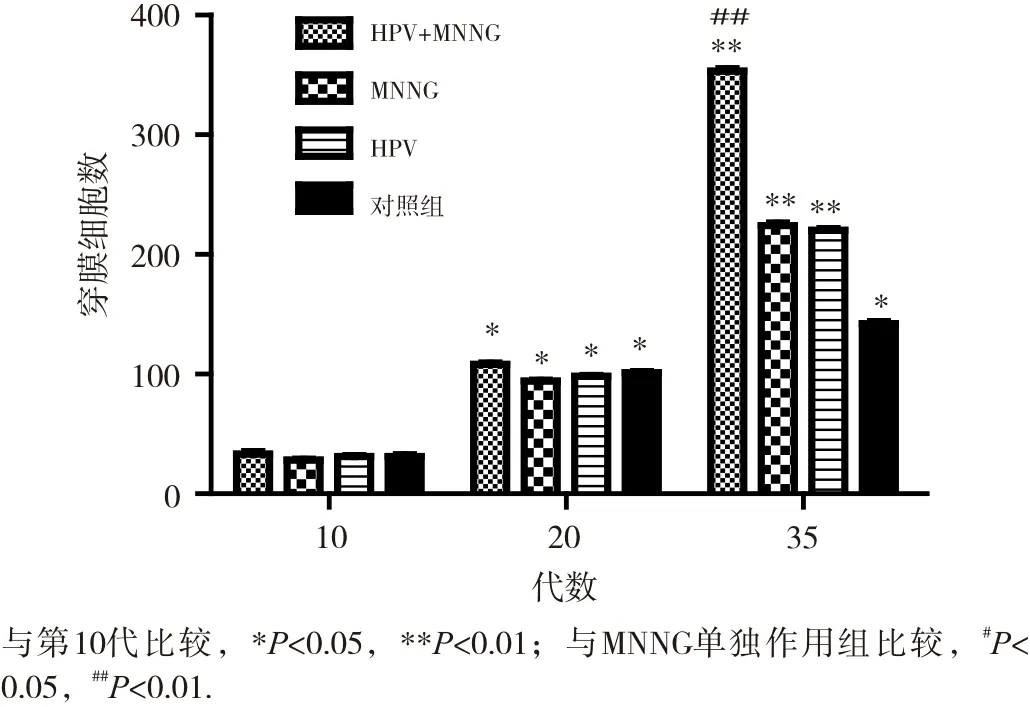
圖5 不同代數的各組細胞侵襲能力變化
各組細胞在第10代及20代時無集落形成,HPV與MNNG聯合作用組細胞在染毒第30代在軟瓊脂上可見較小集落(每個集落細胞數<50個)。至第35代,HPV+MNNG組可形成明顯集落,集落形態典型,如圖8所示。且HPV+MNNG、MNNG、HPV組集落形成率分別為(30.8±0.2)%、(27.1±0.3)%、(18.6±0.1)%,對照組集落形成數量較少,集落較小,且HPV+MNNG組在軟瓊脂的集落形成率明顯高于其他各組(P<0.05),如圖9。顯示HPV+MNNG聯合作用誘導的細胞具有非錨定獨立性生長能力,具有惡性轉化的表征。
2.7 裸鼠成瘤實驗及病理組織學檢查
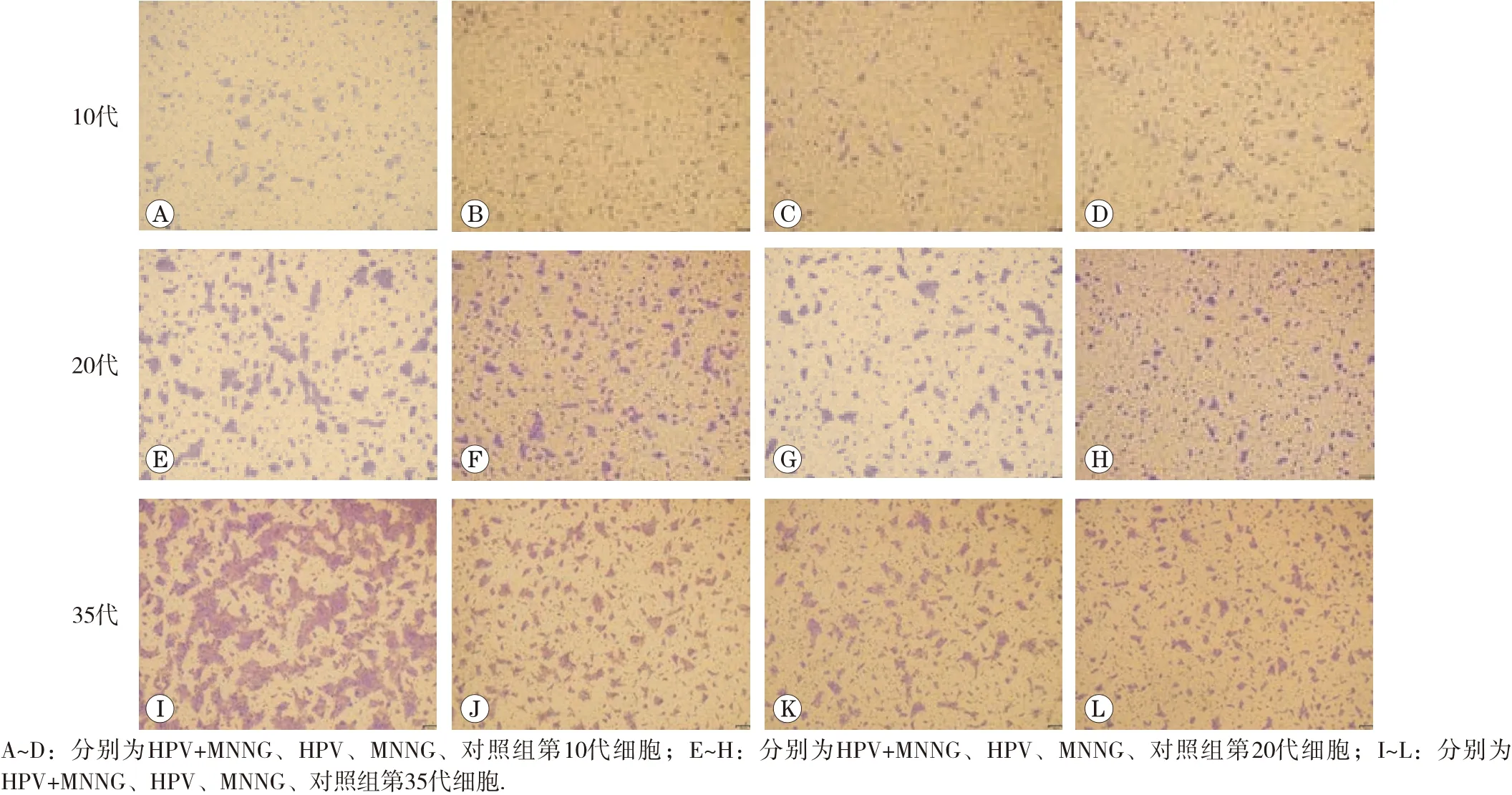
圖6 第35代各組細胞遷移試驗結果(×200)
實驗過程中裸鼠生存狀態良好,未出現不良反應。將第35代各組細胞接種于裸鼠,HPV組、對照組未成瘤,HPV+MNNG組與MNNG組接種2 d后注射局部均出可觸及腫物,瘤體逐漸增大,兩周左右兩組瘤體平均直徑分別達6.6和6.9 mm,兩周后各組瘤體體積不再有增大的趨勢。HPV+MNNG與MNNG組成瘤率均為100%,且兩組瘤體大小無顯著差異(P>0.05)。瘤體血供較為豐富,切面光滑平整。瘤體HE染色均發現類似腫瘤樣特征,細胞結構散亂,排列不規則,核大深染,如圖10。結果提示聯合作用組與MNNG單獨作用組細胞發生了惡性轉化,具備裸鼠體內致瘤能力。
3 討 論
人乳頭狀瘤病毒(HPV)是一類嗜鱗狀上皮環狀DNA病毒,可引起增生性病變[4-5]、乳頭瘤、鱗狀細胞疣狀病變[6-8]。HPV的傳播與周圍環境的直接或者間接接觸都可能有關,如空氣、土壤、食物、衣物等,除此之外人與人之間的皮膚接觸等也是HPV的主要傳播方式。研究已經證實,特定類型的高危型HPV 在宮頸的感染是導致宮頸癌的主要原因,此外HPV在口腔癌的發生發展中也發揮著重要作用[3]。 Zou等[9]運用PCR方法檢測HPV得出高危型HPV的感染顯著提高了食管癌發病風險的結論;Cao等[10]通過免疫組化和原位雜交檢測食管癌組織中HPV感染情況,發現在食管癌組織中HPV感染率顯著高于正常對照。有分子流行病學研究[11]發現50%~80%食管癌組織均有HPV不同亞型的感染,其中HPV-16/18型占60%左右,80%的腫瘤細胞發現有HPV DNA整合入宿主細胞DNA。越來越多的研究表明HPV感染在食管癌發生發展過程中扮演重要角色。
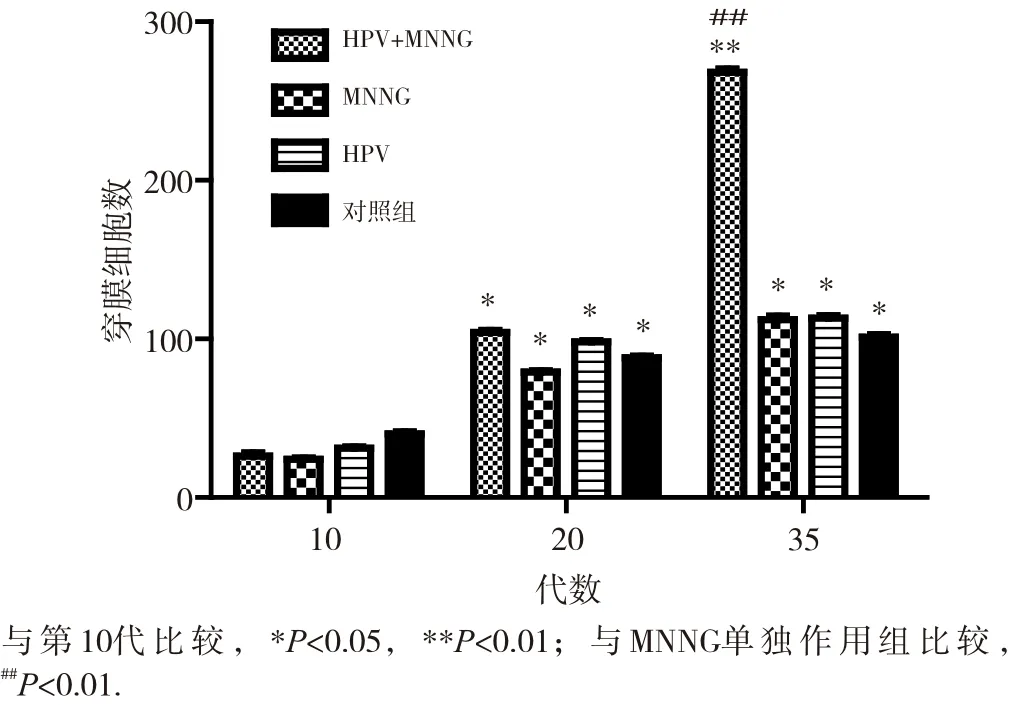
圖7 不同代數各組細胞遷移能力的變化
高危型HPV E6蛋白和多種蛋白相互作用,其中p53與細胞周期凋亡等功能緊密相關,E6蛋白與抑癌蛋白p53作用可將p53蛋白通過泛素蛋白酶體途徑降 解[12-13],使DNA損傷的細胞不能正常修復也不會發生凋亡,損傷累積增加最終可能導致正常細胞的惡性轉化[14-15],E6蛋白還能改變端粒酶活性。端粒酶是一種使染色體穩定并能增加分裂增殖能力的一類酶,正常情況下隨著分裂增加,端粒變短,細胞最終喪失分裂能力[16-18]。同樣被廣泛研究的E7蛋白,能與細胞周期中G1/S階段發揮重要作用的Rb家族蛋白結合并通過泛素-26S蛋白酶體途徑將其降解[19]。E7蛋白能夠下調p21蛋白及p27蛋白的表達,他們均是Rb蛋白通路中對細胞周期調控發揮重要作用的蛋白,同時,p21與抑癌作用密切相關,p27同樣可通過影響細胞周期使細胞過度增生,進而誘導腫瘤的發生[14-20]。除此之外,E6、E7作為主要癌蛋白與細胞的凋亡、免疫調節、細胞黏附、增殖等緊密相關。本實驗中高危型HPV的穩定表達對細胞的增殖、周期等多種功能產生影響。
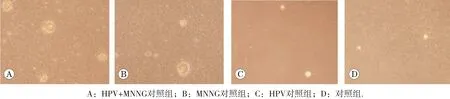
圖8 第35代各組細胞軟瓊脂集落形成試驗結果(×100)
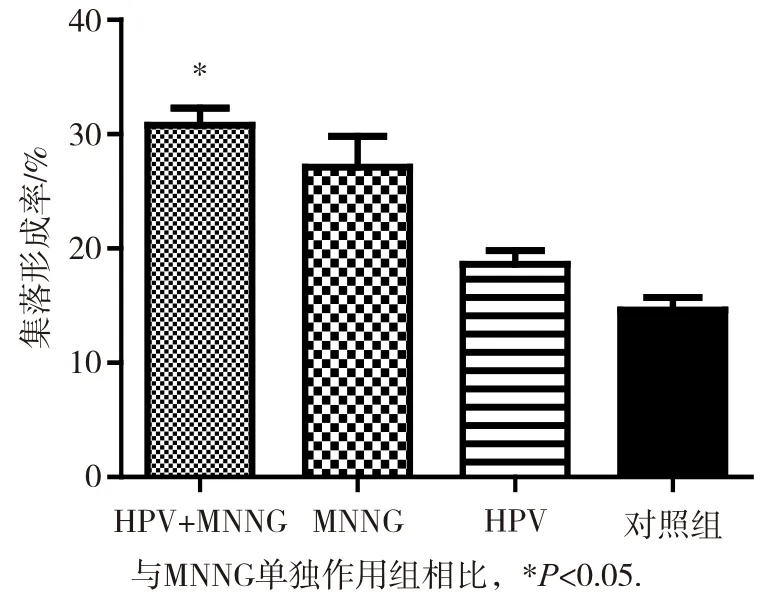
圖9 第35代各組細胞集落形成率
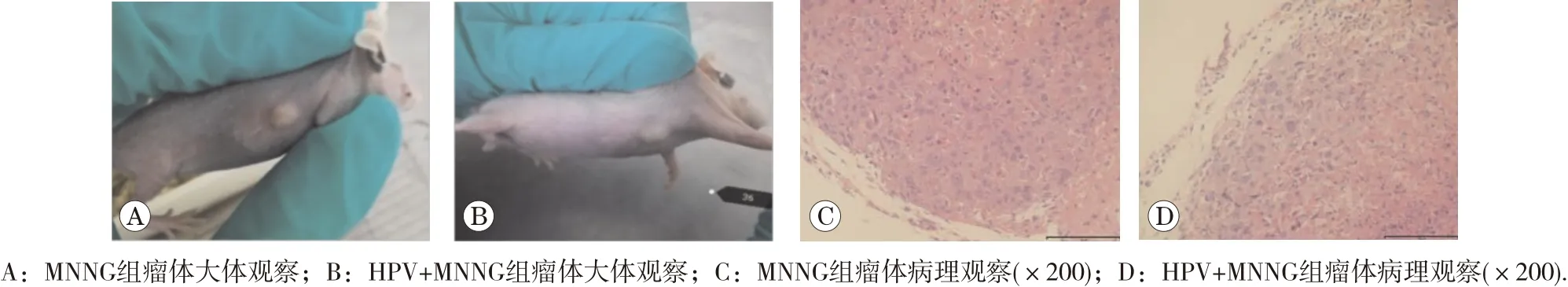
圖10 裸鼠成瘤實驗的大體與病理觀察
本實驗中食管正常上皮細胞Het-1A在慢性MNNG 染毒過程中,HPV聯合MNNG發揮的作用在毒性刺激過程中比單因素作用更為敏感,二者在染毒初期增殖活性增高,可能是輕微毒作用下的應激反應。隨著毒作用累積,MNNG對細胞生長出現抑制效應,HPV與MNNG聯合作用組對細胞增殖周期抑制的程度高于單因素作用組。MNNG作為直接致癌物,能直接損傷DNA誘發癌變。細胞受到毒性累積作用之后引起DNA 損傷,并不斷進行損傷后的自我修復,在反復損傷與修復的過程中,細胞的高分裂速度導致DNA復制的穩定性降低,一旦發生錯誤修復,并且固定下來會引起不可逆的改變,標志著DNA發生突變。隨著DNA損傷修復的進行,實驗中聯合作用組細胞的增殖活力高于單獨作用組,在4組中處于最高水平,MNNG單獨作用組次之。隨著染毒代數的增加,HPV與MNNG聯合作用組的總凋亡率低于MNNG單獨作用組,而HPV單獨作用組總凋亡率高于空載體對照組,聯合作用下,HPV在染毒過程中對細胞的凋亡發揮著一定的抑制作用,而HPV單因素處理下,促進了細胞的凋亡。相比于MNNG單獨作用,HPV與MNNG聯合作用使Het-1A細胞更早出現了促進增殖及抗凋亡的功能表現,HPV可能在致Het-1A細胞的惡性轉化中發揮著協同與促進作用。
在腫瘤發生發展的過程中,經常伴隨上皮細胞間質性轉化的發生,食管癌作為具有侵襲遷移特性的惡性腫瘤,在其發生發展過程中,越來越多的研究證實EMT在其中扮演重要的角色。在腫瘤發生過程中,正常上皮細胞發生EMT,進而發生原位癌,腫瘤細胞可通過EMT形成局部擴散。研究證實,肝癌、結腸癌、宮頸癌,乳腺癌等多種腫瘤侵襲轉移的過程中存在EMT的發生,其嚴重程度與EMT相關[12],為改善惡性腫瘤的預后,EMT在腫瘤發生發展過程中的機制研究成為熱點。本實驗中HPV與MNNG聯合作用組、MNNG單獨作用組形態隨著染毒次數的增加發生明顯變化,細胞失去規則的形狀,變細變長,出現偽足,有類似上皮間質轉化的表征。此外,細胞的侵襲遷移試驗結果顯示,HPV與MNNG聯合作用的穿膜細胞數均明顯高于MNNG單獨作用組,染毒組細胞穿膜數明顯高于對照組。HPV與MNNG聯合作用具備更強的侵襲和遷移能力,提示HPV在這個過程中可能促進了上皮間質性轉化,從而促進惡性轉化的進程,同時為后續研究提供了思路。
HPV與MNNG聯合作用和MNNG單獨作用相比,雖然裸鼠成瘤試驗中瘤體大小及生長速度差異不大,但是在惡性轉化的過程當中,聯合作用組的軟瓊脂非錨定獨立生長能力明顯高于MNNG單獨作用組。聯合作用組在染毒30代時就已經可以形成較小集落,而MNNG單獨作用組并無集落形成;染毒至35代,MNNG單獨作用組可形成陽性集落,而HPV與MNNG聯合作用下形成的陽性集落更多且更大,說明HPV促進了細胞的非錨定獨立生長能力,使細胞更早的具備惡性表征。
綜上所述,在Het-1A細胞惡性轉化過程中,HPV與MNNG聯合作用顯示出細胞增殖能力、抗凋亡能力、侵襲遷移能力及非錨定獨立生長能力均強于MNNG單獨作用組的毒性作用特征,更早的具備了惡性轉化的表征。HPV聯合MNNG致Het-1A細胞惡性轉化模型的成功構建說明,HPV在細胞惡性轉化的過程中發揮著促進與協同的作用,加快了細胞惡性轉化的進程。

