中西醫結合治療小兒過敏性紫癜76例臨床觀察
開封市中醫院兒科,河南 開封 475000
過敏性紫癜是一種由免疫復合物介導的全身中小血管炎,主要累及皮膚、胃腸道、關節和腎臟,臨床表現為特征性皮疹,常伴關節痛、關節積液、腹痛、便血及蛋白尿、血尿[1]。導致患兒發病的原因可能與過敏、藥物作用、病原體感染等因素有關[2],近年來炎性細胞因子致病備受關注。本病多見于2~8歲年齡段的兒童,男孩居多,四季均可發病,而以春、秋兩季較多見。西醫治療小兒過敏性紫癜多為尋找和去除致病因素,控制感染,抗凝、抗過敏、應用糖皮質激素和免疫抑制劑等[3],雖然有效,但存在用藥時間長、容易反復發作、療效欠佳等不足[4-5]。有研究表明犀角地黃湯在過敏性紫癜的治療中取得很好療效[6],筆者采用孟魯司特鈉聯合犀角地黃湯加減治療兒童過敏性紫癜,現報道如下。
1 資料與方法
1.1 一般資料 152例患兒均為2016年6月至2017年12月在我院門診就診的過敏性紫癜患兒,隨機將其為治療組和觀察組各76例。治療組中男40例,女36例;年齡3~12歲,平均年齡(5.40±3.20)歲;病程1~30 d,平均(8.42±3.82)d,單純皮膚型56例,伴關節痛14例,伴腹痛4例,混合型2例。觀察組中男38例,女38例;年齡3~11,平均(5.20±3.40)歲;病程1~33 d,平均(8.52±3.68)d,單純皮膚型54例,伴關節痛14例,伴腹痛6例,混合型2例。兩組在年齡、性別、病程方面及伴隨癥狀方面均無統計學差異(P>0.05),具有可比性。
1.2 診斷標準 參照《中醫兒科學》[7]中過敏性紫癜的診斷標準:①發病前有上呼吸道感染史,或藥物、食物過等病史;②皮膚分批出現對稱分布、大小不等、高出皮面、壓之不退色的斑丘疹樣紫癜,以雙下肢伸側及臀部為主;③可伴有消化道癥狀,或腹痛、關節痛、尿異常等;④血常規、血小板計數、出血時間、凝血時間均在正常范圍。
1.3 辨證標準 參考《中醫臨床診療指南釋義:兒科疾病分冊》[8]中紫癜血熱妄行證的相關辨證標準:主癥為起病急驟,有密集型瘀點瘀斑滲于皮下,色澤鮮紅或暗紅;次癥為發熱,鼻衄,小便短赤,大便干結;舌紅、苔黃,脈數。
1.4 納入標準 ①符合上述過敏性紫癜的診斷標準的紫癜患兒;②年齡在2~12歲之間;③無腎臟損傷病史;④家長同意配合臨床觀察。
1.5 排除標準 ①不符合納入標準者;②合并心血管、肝臟、腎臟和造血系統等嚴重原發性疾病,精神病患者;③伴有咳嗽、發熱等感染者;④家屬或患兒不配合者。
1.6 治療方法 所有患兒臥床休息,避免接觸過敏原。基礎治療給予維生素C片(四川蜀中制藥有限公司生產,國藥準字H51020297,0.1g×100片/瓶)0.1~0.2 g/次,3次/d口服;雙嘧達莫片(山西云鵬制藥有限公司生產,國藥準字H14020797,25 mg×100片/瓶)3~5 mg/kg·d,分3次;西替利嗪糖漿(魯南貝特制藥有限公司生產,國藥準字H20050889,120 mL:0.12 g/瓶,12歲以上兒童:每次10 mL;6~11歲兒童:5 mL;2~5歲兒童:2.5 mL,均1次/d)。治療30 d。
對照組在基礎治療基礎上加用孟魯司特鈉咀嚼片治療(5 mg×7片,四川大冢制藥有限公司,國藥準字H20064828),2~5歲患兒服用4 mg/次,5~14歲患兒5 mg/次,每晚睡前口服1次,30 d為1個療程,治療1個療程。
觀察組在對照組基礎上加用犀角地黃湯加味治療:水牛角15 g,生地黃10 g,牡丹皮10 g,芍藥6 g,紫草6 g。如皮膚瘙癢加蟬蛻6 g,地膚子10 g,徐長卿10 g以祛風通絡止癢;腹痛者加炒白芍10 g,香櫞皮10 g,佛手6 g理氣止疼;關節疼痛加牛膝10 g,木瓜10 g,海風藤15 g;紫癜反復加徐長卿10 g,地膚子10 g,烏梅10 g。此方為開封市中醫院名醫工作室王喜聰主任臨床常用方,方藥采用我院新綠藥智能顆粒(由四川新綠色藥業科技發展股份有限公司提供)。開水沖100mL,分早晚溫服,療程30 d。
1.7 觀察指標 患兒皮疹、腹痛、關節疼痛消退時間,治療前后兩組白細胞介素-6(IL-6)、白細胞介素-8(IL-8)、腫瘤壞死因子-α(TNT-α)水平變化,此三項指標于治療前后晨起7∶00空腹抽血,由我院檢驗科采用ELISA法檢測。
1.8 療效標準 依照《中醫病癥診斷療效標準》[9]判定療效。臨床控制:臨床癥狀、體征消失;顯效:臨床癥狀、體征明顯改善;有效:臨床癥狀、體征均有好轉;無效:臨床癥狀、體征均無明顯改善,甚或加重。
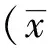
2 結果
對照組有2例患兒未堅持服藥剔除。
2.1 兩組臨床療效比較 治療后,治療組總有效率97.4%,高于對照組的83.8%,差異有統計學意義(P<0.05)。見表1。

表1 兩組臨床療效比較 [例(%)]
注:與對照組相比,*P<0.05。
2.2 兩組臨床癥狀(紫癜、關節疼痛、腹痛)消失時間比較 治療組各癥狀消失時間均短于對照組,差異有統計學意義(P<0.05)。見表2。
2.3 兩組炎性因子比較 組內治療后IL-6、IL-8、TNF-α炎性因子與治療前相比均下降明顯(P<0.05)。組間治療后相比,治療組觀察組炎性因子下降水平明顯低于對照組,差異有統計學意義(P<0.05)。見表3。
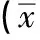
表2 兩組臨床癥狀消失時間比較 ±s,d)
注:與對照組相比,*P<0.05。
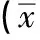
表3 兩組治療前后炎性因子比較 ±s,ng/L)
注:與治療前相比,*P<0.05;兩組治療后相比,#P<0.05。
3 討論
目前多數研究證實,HSP最主要的發病機制是免疫反應,是多種致敏源作用于敏感機體而導致的Ⅱ型變態反應,產生抗原繼而誘導產生自身抗體,從而形成循環免疫復合物沉積于小動脈及毛細血管壁或基底膜,造成免疫損傷,引起全身中小動脈出血性疾病[10]。對照組臨床用藥中,維生素C片口服具有增強毛細血管抵抗力,降低毛細血管通透性與脆性[11];雙嘧達莫片為磷酸二酯酶抑制劑,可提高血小板內環磷酸腺苷水平,阻止血小板凝聚以防止血栓形成,減弱血管通透性[12];西替利嗪糖漿屬于第二代抗組胺藥物,可抑制變態反應炎癥中嗜酸性粒細胞,阻斷變態反應,減輕血管壁炎性滲出和降低毛細血管通透性[13]。
近年來炎性細胞因子備受關注。IL-6由巨噬細胞、T細胞、巴細胞、內皮細胞等多種細胞產生。IL-6可促進B細胞分化及Ig的分泌,產生大量IgA,形成免疫復合物沉積于毛細血管壁及腎小球系膜區而引起損傷[14]。朱紅等[15]研究表明HSP患兒血清IL-6、IL-8和TNF-α水平均高于健康對照組。HSP急性期特征性表現為外周血白細胞增多及血管周圍多形核白細胞浸潤,可激活內皮細胞釋放大量IL-8,而IL-8增加有助于HSP患兒血管周圍聚集和白細胞增多。其升高可使中性粒細胞被趨化并釋放蛋白酶,使血管發生炎性損傷[16]。TNF-α為單核巨噬細胞產生,作為主要的促炎癥因子,可刺激免疫活性細胞產生白介素等炎癥因子,亦可誘導血管內皮細胞表達細胞間黏附分子1(ICAM-1)等黏附分子,促進白細胞黏附于血管內皮導致血管內皮損傷[17]。孟魯司特鈉是常用的強效白三烯受體拮抗劑,能抑制變應反應、降低毛細血管通透性,減輕出血滲出和水腫,還能減少炎性細胞浸潤,逐漸應用于治療兒童過敏性紫癜中,但部分患者療效欠佳,治療后病情易復發[18-19]。
古代醫籍中并無“過敏性紫癜”的病名,可歸屬于“肌衄”、“紫斑”、“葡萄疫”、“斑疹及“血證”等范疇。小兒臟腑嬌嫩,形氣未充,肺常不足,衛外不固,風熱之邪更易侵犯機體,如與氣血相搏,可傷及血絡,迫血妄行,滲于皮下,發為紫癜。“離經之血即為瘀”及“久病入絡致瘀”。《幼幼集成·諸血證治》曰:“外干六淫,內傷飲食,氣留不行,血壅不濡,是以熱極涌泄,不無妄動之患若郁熱內逼,必致榮血妄行”。犀角地黃湯首載《小品方》,組成藥物為犀角(現多用水牛角代替)、生地黃、芍藥、牡丹皮,為治療血熱妄行證常用方。方用苦咸寒的犀角為君藥,清心肝而能解熱毒,并且寒而不遏,直入血分以涼血;臣以味甘苦而性寒之生地黃,清熱涼血,養陰生津,既能助犀角解血分之熱,又能止血;白芍苦酸微寒,養血斂陰,且助生地黃泄熱涼血和營,尤適用于熱盛出血者;丹皮苦辛微寒,清熱涼血,且活血散瘀,可收化斑之效,與芍藥共為佐使藥。四藥合用,共成清熱解毒、涼血散瘀之劑。
本研究中,孟魯司特鈉聯合犀角地黃湯加減治療小兒HSP血熱妄行證,總有效率97.4%,明顯高于對照組的83.8%(P<0.05)。觀察組在皮膚紫癜、腹痛、關節痛消退時間上比較均短于對照組(P<0.05),表明孟魯司特鈉聯合犀角地黃湯加減可明顯改善其臨床癥狀,提高臨床療效。兩組治療后IL-6、IL-8、TNF-α炎性因子水平與治療前相比均下降(P<0.05),且觀察組炎性因子下降水平明顯低于對照組(P<0.05),表明孟魯司特鈉聯合犀角地黃湯加減能有效降低HSP患兒的炎性因子水平。
綜上所述,中西醫結合治療小兒HSP血熱妄行證療效顯著,能有效緩解紫癜患兒臨床癥狀,縮短病程,降低炎性因子水平,值得臨床應用。

