旋毛蟲5′-nucleotidase基因特征與克隆表達
廖成水,王曉利,杜付玉,郁 川,余祖華,張春杰,李銀聚,吳庭才,劉明遠,程相朝
旋毛蟲是一種重要的人獸共患胞內寄生蟲,寄生于宿主骨骼肌細胞,目前旋毛蟲具有9個種和3個基因型12個物種[1]。一旦攝入含有旋毛蟲幼蟲的動物肉后,肌肉幼蟲通過消化酶從包囊釋放到胃中,進入腸道后發育為感染性幼蟲[2]。1835年Page和Owen在實驗中首次分離旋毛蟲[3],隨后大量研究發現旋毛蟲幼蟲入侵機體不是簡單的機械性滲透的結果[4-5],并且認為排泄/分泌產物在旋毛蟲發育、侵襲和寄生過程中起著重要作用[6]。
核酸酶廣泛存在于微生物,主要參與營養代謝、遺傳物質的復制、重組和修復機制以及與微生物感染、免疫有關[7]。旋毛蟲基因組中擁有125種龐大的DNase II家族蛋白,并且一半以上屬于編碼排泄/分泌產物[8],但DNase II家族蛋白在旋毛蟲的識別和侵入過程中起的關鍵作用仍未得到很好闡述。Wang等研究發現旋毛蟲體外感染腸上皮細胞時可產生5′-nucleotidase蛋白[9]。5′-nucleotidase是一個核苷酸代謝酶,催化核苷5′-二磷酸酯的水解中生成5′-單磷酸核苷[10]。許多寄生蟲可分泌5′-nucleotidase,但目前有關旋毛蟲5′-nucleotidase基因及蛋白的研究報道較少。為此,本研究對旋毛蟲5′-nucleotidase基因進行克隆,并進行了原核表達,為進一步5′-nucleotidase在旋毛蟲感染過程中的作用研究奠定基礎。
1 材料與方法
1.1動物、質粒、菌株和蟲種 Wistar大鼠(200.0±20.0 g)購自吉林大學白求恩醫學院動物實驗中心;中國河南豬旋毛蟲分離株Trichinellaspiralis(genotype T1),國際標準蟲種編號為ISS534,由本室大鼠傳代保種;pUC18和pET-32a購自寶生物工程(大連)有限公司,由本實驗常規保存;大腸桿菌DH5α和大腸桿菌Rosetta購自德國Novagen公司,由本實驗常規凍存。
1.2主要試劑 胰蛋白胨和酵母浸出物購自英國OXOID公司;TaqPCR Master Mix(2x,blue dye)DNA Marker、BamHI、HindIII、RNA PCR Kit (AMV) Ver.3.0、T4連接酶和His標簽鎳柱親和層析蛋白純化試劑盒均購自寶生物工程(大連)有限公司;質粒小量提取試劑盒購于北京康為世紀生物科技有限公司。異丙基-β-D-硫代半乳糖苷(IPTG)購自Sigma公司。AxyPrep DNA凝膠回收試劑盒購自康寧生命科學(吳江)有限公司;其它化學試劑均為國產分析純。
1.3引物設計與合成 根據GenBank旋毛蟲5′-nucleotidase基因序列(登錄號AY127571.1),設計PCR引物:F:5′-GGATCCTTACAGTTAACACTAATTCATAC-3′(下劃線處為BamH I酶切位點);R:5′-AAGCTTTCAAACGAAGGTGATGCGAT-3′(下劃線處為Hind III酶切位點)[11]。引物由生工生物工程(上海)股份有限公司合成。
1.4旋毛蟲5′-nucleotidase基因的克隆與鑒定 常規方法收集旋毛蟲肌幼蟲蟲體,根據Trizol試劑盒的方法得到旋毛蟲總RNA。根據RNA PCR Kit (AMV) Ver.3.0試劑盒的方法得到cDNA。以旋毛蟲cDNA為模板,常規PCR擴增獲得plancitoxin-1基因,反應程序如下:95 ℃ 4 min;95 ℃ 1 min,55 ℃ 45 s,72 ℃ 100 s,30個循環;72 ℃延伸10 min,目的基因連接至克隆載體pUC18,然后轉化于感受態細胞DH5α中,PCR和酶切鑒定后進行序列測定。
1.5同源性分析 收集20余種不同物種的5′-nucleotidase類似物氨基酸序列,搜集90余種不同血清型的5′-nucleotidase及其類似物氨基酸序列。MEGA7.0用于分析旋毛蟲5′-nucleotidase蛋白與其他90多個不同血清型的5′-nucleotidase家族蛋白的相似性。
1.6在線網站分析5′-nucleotidase蛋白理化性質http://web.expasy.org/protparam/分析蛋白分子量大小、理論等電點和氨基酸組成。http://people.mbi.ucla.edu/sumchan/caltor.html和http://biotech.ou.edu/分別用于分析稀有密碼子和重組蛋白的可溶性。http://web.expasy.org/protscale/分析蛋白的親水性與疏水性。
1.7在線網站預測5′-nucleotidase蛋白結構 https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi預測保守區域。在線軟件TMHMM program、NetNGlyc、SignalP、NetOGlyc和NetPho分別預測跨膜區、N-糖基化位點、信號肽、O-糖基化位點和磷酸化位點。https://www.predictprotein.org/#分析二硫鍵數量。http://tools.immuneepitope.org/bcell/和http://www.cbs.dtu.dk/services/NetCTL/預測線性B細胞抗原表位和T細胞結合位點。https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.plpage= /NPSA/npsa_server.html和https://swissmodel.expasy.org/分析預測二級結構和三級結構。
1.8原核表達載體的構建與鑒定 將正確的重組質粒pUC18-5′-nucleotidase經BamH I和Hind III雙酶切后連接至表達載體pET-32a構建原核表達載體pET-32a-5′-nucleotidase,然后轉化至大腸桿菌Rosetta。
1.9重組菌的蛋白表達與純化 終濃度為1 mmol/L的IPTG對大腸桿菌Rosetta(pET-32a-5′-nucleotidase)進行誘導表達,采用鎳柱親和層析蛋白純化試劑盒純化重組蛋白,然后進行SDS-PAGE分析。
2 結 果
2.1旋毛蟲5′-nucleotidase基因的克隆與鑒定 PCR結果顯示擴增到了約1 653 bp的條帶(圖1A),與預期的5′-nucleotidase大小一致。限制性內切酶BamHⅠ和Hind Ⅲ對重組質粒(pUC18-5′-nucleotidase)雙酶切鑒定,結果顯示出現約2 686 bp的載體條帶和約1 653 bp的目的條帶(圖1B)。測序結果與GenBank中AY127571.1的5′-nucleotidase基因的同源性為100%。
2.25′-nucleotidase蛋白的同源性分析 5′-nucleotidase的氨基酸序列與其他物種的5′-nucleotidase蛋白及其類似物的同源性比較低,與已報道的斑馬擬麗魚、根瘤菌、刺尾蝎屬、柱頭蟲、赤擬谷盜等5′-nucleotidase蛋白類似物的同源性集中于29.76%~34.44%,與純綠蜱屬具有39.36%的同源性,遺傳進化關系上被分在一個進化支(圖2)。整體上看,旋毛蟲5′-nucleotidase與純綠蜱屬親緣關系較近。但是5′-nucleotidase基因與GenBank中已報道的斑馬擬麗魚、水螅、刺尾蝎屬、柱頭蟲、赤擬谷盜等的核苷酸同源性集中在65%~72%,與果蠅屬的核苷酸同源性為79%。

圖2 旋毛蟲5′-nucleotidase與其他物種5′-nucleotidase蛋白的遺傳進化樹分析 Fig.2 Phylogenetic analysis of 5′-nucleotidase from T.spiralis and other previously reported
旋毛蟲5′-nucleotidase的氨基酸序列與旋毛蟲的其他血清型XP-003380309.1和AAM97494.1的同源性分別達到100%和96%。旋毛蟲5′-nucleotidase基因的核苷酸序列與旋毛蟲的其他血清型XP-003380309.1和AAM97494.1的核苷酸序列的同源性也分別達到100%和95%。5′-nucleotidase與KRY37020.1、XP-003380308.1、KRY26807.1、KRY26803.1等分在一個進化樹大分支上。
2.35′-nucleotidase蛋白理化性質的分析 在線軟件分析顯示5′-nucleotidase的氨基酸數為550,分子式為C2800H4358N742O803S23,理論分子質量和等電點(pI)為62 kD和6.13,119個氨基酸殘基,帶負電荷殘基總數(Asp+Glu)為63個;正電荷殘基總數(Arg+Lys)為56個。非極性氨基酸占44.4%,極性不帶電荷氨基酸占31.3%,極性帶負電荷氨基酸占11.4%,極性帶正電荷氨基酸占12.9%。其消光系數(M-1cm-1=280 nm)為77 280,不穩定指數(Ⅱ)為33.45(<40),屬于穩定類蛋白質,在體外哺乳動物網織紅細胞的半衰期是30 h。疏水指數為93.80。該序列含有56個稀有密碼子,其中有5處連續出現稀有密碼子,在大腸桿菌中呈可溶性表達。該蛋白在11位氨基酸分值最高(2.467),有最強的疏水性;在72位氨基酸分值最低(-2.833),有最強的親水性。
2.45′-nucleotidase蛋白結構的分析 保守結構域分析顯示,5′-nucleotidase蛋白的保守結構域在24-304和332-512位氨基酸之間。5′-nucleotidase在N404VT、N461LS和N522FT共有3個N-糖基化位點。在G47和G535共有2個O-糖基化位點。5′-nucleotidase共存在20個磷酸化位點,分別為9個Ser、6個Thr和5個Tyr,潛力值均大于0.5。另外,該蛋白前21個氨基酸為信號肽,有跨膜區域,是跨膜蛋白。而且該蛋白質含有28個B細胞線性結合位點和13個T細胞結合位點。二級結構預測結果顯示,該蛋白的二級結構主要由α-螺旋和無規則卷曲構成,其中α-螺旋占43.27%(238個),伸展鏈占22.73%(125個),β-折疊占7.82%(43個),無規則卷曲占26.18%(144個)。5′-nucleotidase沒有二硫鍵(圖3)。三級結構預測發現,5′-nucleotidase蛋白序列與PDB數據庫中5eqv.1.A模板序列相似性為31.19%(圖4)。

圖3 5′-nucleotidase蛋白二級結構分析Fig.3 Predicted secondary structure of 5′-nucleotidase protein
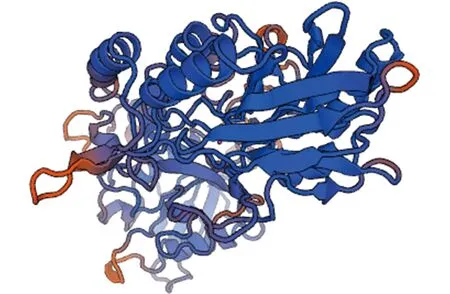
圖4 5′-nucleotidase三維結構同源模型Fig.4 Three-dimensinal model of 5′-nucleotidase
2.5pET-32a-5′-nucleotidase重組質粒的構建與鑒定 用限制性內切酶BamHⅠ和HindⅢ對重組質粒pET-32a-5′-nucleotidase進行雙酶切鑒定,結果顯示出現約6 000 bp的載體條帶和約1 653 bp的目的條帶,與預期結果相符,說明原核表達載體構建成功(圖5)。
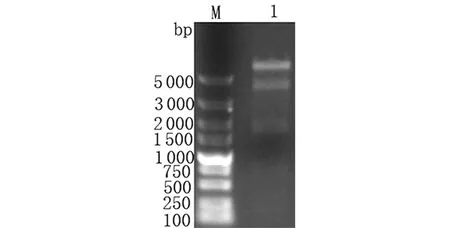
M: DL5000 DNA Marker; 1: Products from pET-32a-5′-nucleotidase digested with BamHⅠ+HindⅢ圖5 pET-32a-5′-nucleotidase的酶切鑒定Fig.5 Identification of double enzyme for pET-32a-5′-nucleotidase
2.6pET-32a-5′-nucleotidase的誘導表達分析 SDS-PAGE分析結果顯示,在約74 kD處出現目的條帶,而且發現該蛋白主要存在于菌體超聲后的上清中,說明該蛋白是可溶性蛋白,將超聲后的蛋白經鎳柱親和層析純化后獲得純化的蛋白,經SDS-PAGE結果顯示可見較純的目的條帶(圖6)。
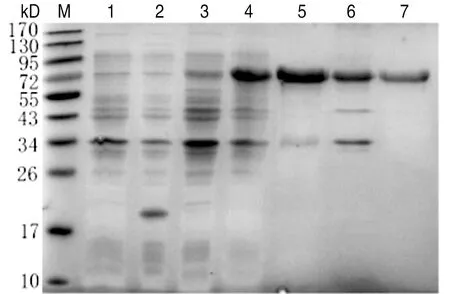
M: Protein Marker; 1: Rosetta (pET-32a) without IPTG induction; 2: Rosetta (pET-32a) with IPTG induction; 3: Rosetta (pET-32a-5′-nucleotidase) without IPTG induction; 4: Rosetta (pET-32a-5′-nucleotidase) with IPTG induction; 5: Rosetta (pET-32a-5′-nucleotidase) precipitate of bacteria with IPTG induction; 6: Rosetta (pET-32a-5′-nucleotidase) supernatant of bacteria with IPTG induction; 7: Purified protein圖6 蛋白原核表達產物的SDS-PAGE分析Fig.6 SDS-PAGE analysis of prokaryotic expression products
3 討 論
旋毛蟲病臨床診斷方面最大的困擾是其臨床表現無特異性,患者患病期間發熱、腹瀉等癥狀時有發生,重癥患者可引發心肌炎、肺炎及腦炎等[12]。目前,動物屠宰前旋毛蟲的檢測也被認為是阻斷人類旋毛蟲感染的有效方法之一,世界動物衛生組織(OIE)嚴格規定對進出口屠宰動物必須進行旋毛蟲病檢驗[13]。旋毛蟲引發機體感染后,腸道區域嗜酸性粒細胞等大量增加,在病灶區聚集并表現出浸潤現象,但腸黏膜并未出現炎性反應[14]。5′-nucleotidase是一種作用于腺苷(次黃苷)-5′-磷酸的核酸酶,首次在心臟和骨骼的肌肉中發現,它能催化核糖與脫氧核糖部分的核苷酸分子5′-C端的磷酸鹽酯化水解[15]。Cuttell等對侵入機體的旋毛蟲的分泌蛋白進行了PCR定量檢測,發現5′-nucleotidase參與分解核苷酸[16],但是目前對于旋毛蟲5′-nucleotidase基因特征及功能的相關研究尚未見報道。
本研究利用多種生物信息學在線軟件對旋毛蟲5′-nucleotidase蛋白結構及其理化性質進行了預測和分析。旋毛蟲5′-nucleotidase基因在同一物種屬內差異較小,在不同物種之間的差異性比較大。該蛋白含有28個B細胞線性結合位點和13個T細胞結合位點。糖基化位點預測結果顯示,旋毛蟲5′-nucleotidase蛋白含有3個N-糖基化位點和2個O-糖基化位點,這些糖基化位點的存在對蛋白質的功能的調節起著重要的作用。信號肽預測結果顯示,旋毛蟲5′-nucleotidase蛋白含有信號肽,屬于分泌性蛋白。二級結構分析結果顯示,旋毛蟲5′-nucleotidase蛋白的二級結構存在大量的α-螺旋和無規則卷曲,這表明此蛋白質屬于穩定類蛋白質。對旋毛蟲5′-nucleotidase蛋白質序列模序進行在線預測,發現旋毛蟲5′-nucleotidase蛋白含20個潛在磷酸化修飾位點。旋毛蟲5′-nucleotidase蛋白磷酸化位點的存在與細胞內信號傳導和蛋白定位等過程關系密切,但旋毛蟲5′-nucleotidase蛋白的磷酸化位點是否與細胞內信號傳導及蛋白定位等過程有關目前尚未確切研究。
本研究成功克隆了旋毛蟲5′-nucleotidase基因,并對其序列特征進行了分析,同時構建了旋毛蟲5′-nucleotidase的原核表達質粒,在大腸桿菌Rosetta中呈可溶性表達。為深入探究旋毛蟲5′-nucleotidase蛋白的功能及在旋毛蟲感染宿主中的作用機制奠定基礎。

