超臨界機組給水加氧處理對流動加速腐蝕影響的研究
肖卓楠, 白冬曉, 徐 鴻, 陳偉鵬, 李 科
(1.華北電力大學 能源動力與機械工程學院,北京 102206;2.內蒙古科技大學 能源與環境學院,內蒙古包頭 014010)
據統計數據表明,國際上許多核電站和大型電廠都出現了流動加速腐蝕(FAC)現象,且發生FAC的管道約占電站管道的33%,在所有的管道失效形式中名列第一位[1]。FAC是由于電廠管道基體及表面的疏松氧化膜被單相或兩相的流動工質溶解而造成的管道內表面逐漸減薄的一種現象,FAC主要發生在電廠的給水系統管道中,表現為管道結垢速率加快、閥門堵塞、鍋爐壓差增大和金屬基體減薄,嚴重時會引起管道爆裂事故,高溫工質泄露,機組非計劃停運,造成巨大的經濟損失。因此,抑制汽水管道內表面FAC現象的發生對電力行業的發展至關重要。
目前,采用化學水控制可以有效減緩甚至抑制管道FAC現象的發生[2],電廠給水加氧處理是管道腐蝕與防護的重要環節。然而在加氧處理工況下化學水因素控制不當時,對鍋爐受熱面、汽輪機通流部分和精處理裝置都存在負面影響,目前給水加氧技術并不成熟,為了抑制管道FAC的發生,使機組安全、穩定運行,需要嚴格控制給水加氧的條件。筆者根據電廠實際運行中的電化學因素對可溶性Fe組分的影響以及電化學因素之間的相互影響,確定了超臨界機組給水加氧處理工況下合適的工藝控制條件,優化了給水加氧技術,可為超臨界機組實行給水加氧處理提供依據。
1 流動加速腐蝕的電化學腐蝕過程
FAC是由電化學腐蝕過程與腐蝕產物的擴散、傳質和沉積等物理沖刷腐蝕過程共同作用產生的金屬損耗現象[3]。
電化學反應過程是形成電廠管道FAC的主要過程,該過程中會發生一系列微觀的電化學反應與化學反應,包括金屬基體Fe的電離、金屬基體表面氧化膜的形成與化學溶解。首先金屬基體表面的磁性氧化膜疏松、多孔,金屬基體與水溶液接觸,金屬基體Fe與水溶液形成了原電池,Fe發生電離,失去電子生成Fe2+,部分Fe2+與少量金屬基體Fe在水溶液氧化劑的作用下發生化學反應形成磁性Fe3O4氧化膜。Fe3O4氧化膜具有滲透性和微溶性,在水中會發生化學溶解,使得氧化膜的厚度不斷變薄、間隙度增大,對管道金屬基體的保護作用減弱,同時增強了金屬基體Fe的電離,使管壁減薄,FAC速率加快[4]。
圖1為FAC的電化學反應示意圖,主要的電化學反應或化學反應有:

(1)

(2)

(3)

(4)

(5)
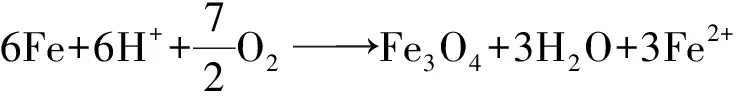
(6)

(7)
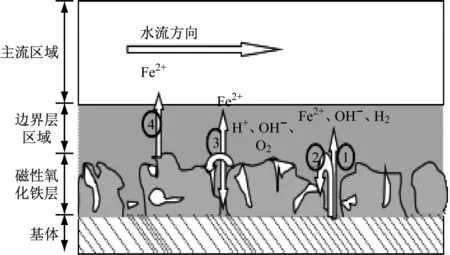
圖1 FAC機理示意圖
2 預防流動加速腐蝕的化學水處理方式
為了減緩或抑制FAC現象,電廠都采用了比較經濟、有效的化學水處理方式,化學水處理的方式有還原性全揮發處理(AVT(R))、弱氧化性全揮發處理(AVT(O))和給水加氧處理(OT)。向給水中加氨和聯氨的處理方式稱為還原性全揮發處理,只加氨不加聯氨的給水處理方式稱為弱氧化性全揮發處理,向給水中加入氧的處理方式稱為給水加氧處理。而給水加氧加氨的聯合處理(CWT)是對FAC抑制作用最全面、有效的一種OT處理方式。目前大型超(超)臨界機組都進行了給水加氧加氨的聯合處理。
2.1 給水加氧處理的原理
給水加氧技術的原理是在給水水質高度純凈(氫電導率小于0.15 μs/cm,目標值為0.10 μs/cm)的條件下增加給水的溶解氧質量濃度[5](以下簡稱溶解氧含量),提高汽水的pH值,進而在熱力設備的金屬表面產生金屬鈍化作用,使金屬表面形成雙層氧化膜,內伸層是緊貼金屬基體表面的磁性Fe3O4氧化膜,外延層為致密的保護層Fe2O3與水合氧化鐵FeOOH氧化膜。氧化膜的分布如圖2所示。致密的氧化膜阻礙了電化學反應的進行,減少了Fe2+的擴散,降低了FAC速率。
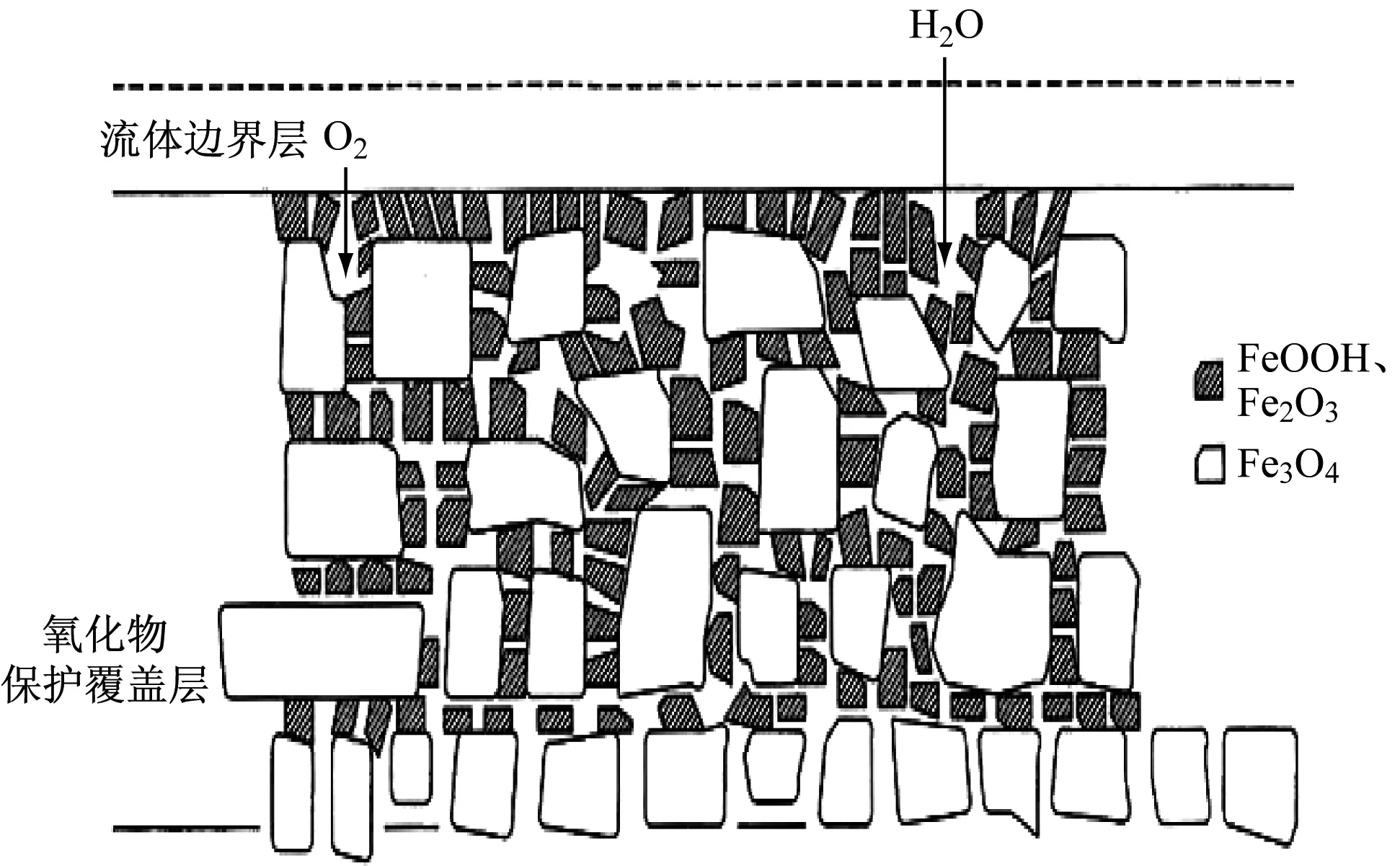
圖2 加氧處理工況下氧化膜結構圖
2.2 給水加氧處理的優勢
管道發生FAC時的主要腐蝕產物為Fe2+,然而電廠運行時監測的可溶性Fe組分是水中的全鐵含量,無法實現對Fe2+的實時監測,因此Fe質量濃度高低反映了電廠管道的腐蝕程度,可溶性Fe組分的變化是評價化學水處理效果最直觀的指標。
以內蒙古岱海發電有限責任公司的1號機組和河北國華滄東發電有限責任公司的3號機組為研究對象,根據1號機組汽水品質監督記錄表,繪制了圖3所示的亞臨界機組給水系統Fe質量濃度變化圖。根據3號機組汽水系統查定報告,繪制了圖4所示的超臨界機組給水系統Fe質量濃度變化圖。
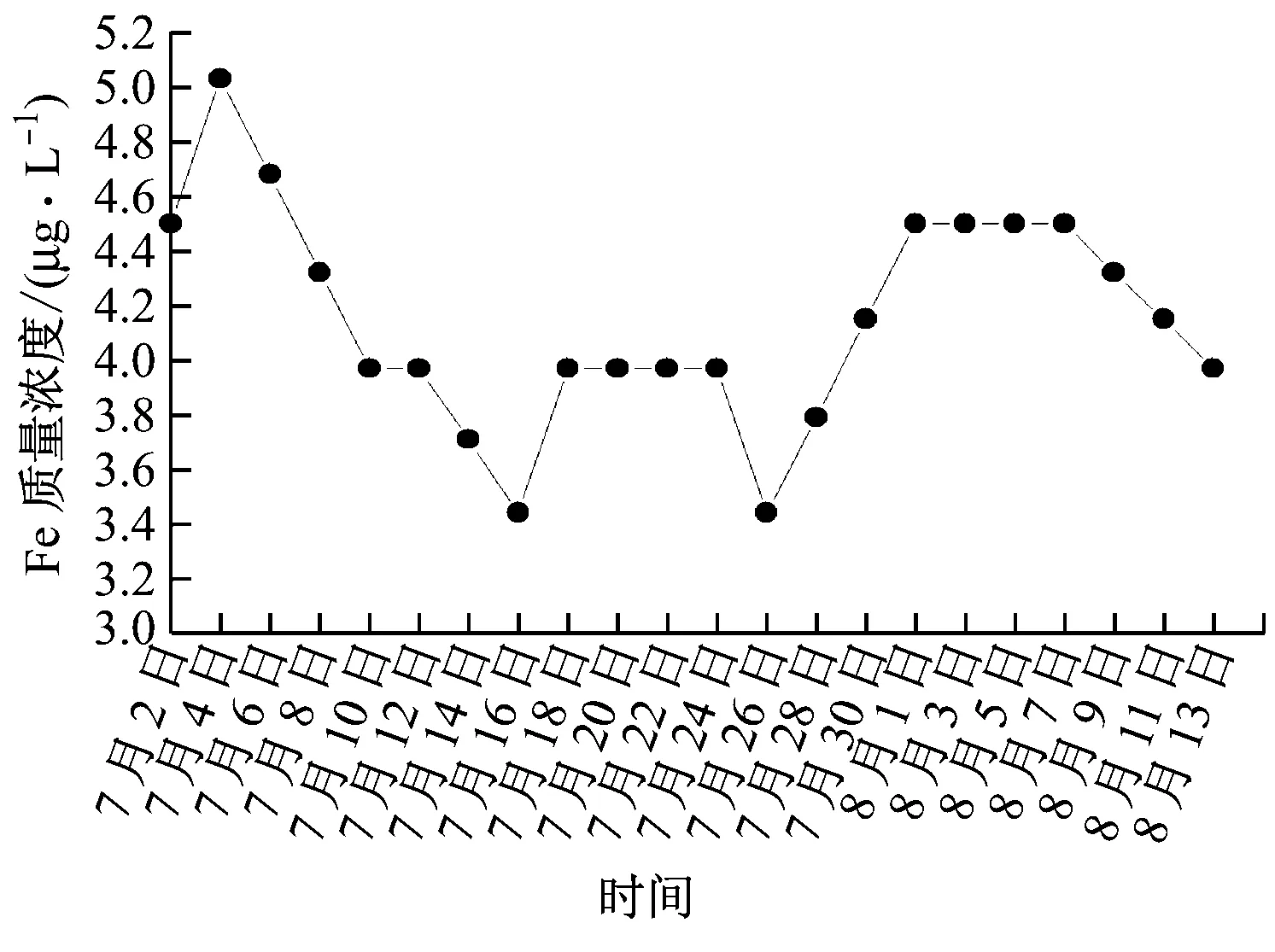
圖3 亞臨界機組給水系統Fe質量濃度變化圖
1號機組是600 MW亞臨界機組,采用汽包爐。該機組近期一直采用的是弱氧化性全揮發處理方式,只通過熱力除氧(即保證除氧器運行正常)但不再加除氧劑進行化學輔助除氧,使Fe的電極電位處于Fe2O3與Fe3O4的混合區[6],氧化性較弱。由圖3可以看出,電廠實時監測的給水管道中的Fe質量濃度普遍較高,平均值達到4.15 μg/L,說明其給水管道FAC速率較大,容易發生FAC現象。
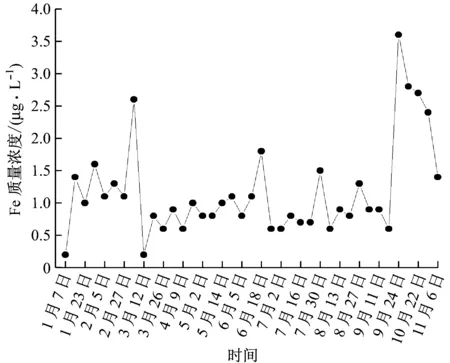
圖4 超臨界機組給水系統Fe質量濃度變化圖
3號機組是660 MW超臨界機組,采用直流鍋爐。該機組先采用的是給水加氧加氨的聯合處理方式,使管內壁生成致密的、溶解度小的赤鐵礦物質氧化膜,并將疏松的Fe3O4銹層表面均勻覆蓋起來[7],由圖4可以看出,電廠實時監測的整個水處理過程中Fe質量濃度較低,只達到1 μg/L左右,給水管道FAC速率小,幾乎不發生FAC現象。
9月24號至10月18號因機組啟停進行了加氧投退,機組啟動后先進行給水還原性全揮發處理,此時的Fe質量濃度呈上升趨勢,最大值達到3.6 μg/L,是加氧處理時給水中Fe質量濃度的3~4倍,腐蝕更嚴重。為了抑制管道發生FAC,當給水水質達到加氧要求后,進行給水加氧處理,省煤器入口的溶解氧含量維持在30~150 μg/L,此時Fe質量濃度不斷下降,FAC速率降低。
結合圖3和圖4可知,由于600 MW亞臨界機組與660 MW超臨界機組采用了不同的化學水處理方式,Fe質量濃度也不同,亞臨界機組給水系統Fe質量濃度明顯大于超臨界機組給水系統Fe質量濃度,說明給水加氧處理能夠降低給水中的Fe質量濃度和FAC速率,有效地抑制了管道的FAC現象。弱氧化性全揮發處理方式的抑制作用較弱,腐蝕防護效果較差。
綜上所述,給水加氧處理方式對FAC的抑制效果明顯優于還原性全揮發處理方式和弱氧化性全揮發處理方式,電廠采用給水加氧技術更具有優越性。
3 流動加速腐蝕的電化學影響因素
由FAC的機理分析可知,FAC是一個非常復雜的物理和電化學過程,因此影響碳鋼管道腐蝕的主要因素可以分為物理因素和電化學因素,物理因素是指影響Fe2+擴散、傳質等物理過程的因素,如流速和流動狀態等。電化學因素是指影響FAC電化學反應過程的因素,如H+、O2濃度及陰離子雜質都參與了電化學反應過程。由2臺機組的調研數據可知,pH值、溶解氧含量和氫電導率都會影響FAC速率[8]。
3.1 溶解氧含量對給水系統FAC的影響
根據調研與采集到的3號機組的數據,繪制給水管道中溶解氧含量與Fe質量濃度的關系圖(見圖5)。
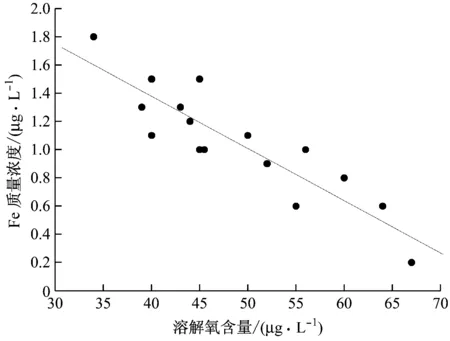
圖5 超臨界機組給水中溶解氧含量與Fe質量濃度關系圖
3號機組省煤器入口的溶解氧含量是按照DL/T 805.4—2016 《火電廠汽水化學導則》中的直流鍋爐給水加氧處理標準進行的,溶解氧含量控制在30~70 μg/L,由圖5可知,在溶解氧含量控制范圍內,隨著溶解氧含量的增大,給水中Fe質量濃度降低,管道和氧化膜表面溶解了較少的Fe2+,說明FAC速率逐漸降低。當溶解氧含量為60~70 μg/L時,Fe質量濃度降到1 μg/L以下,給水管道的FAC現象受到抑制,因此當溶解氧含量控制在60~70 μg/L時,管道幾乎不發生FAC現象。
3.2 pH值對給水系統FAC的影響
3號機組進行給水加氧處理時pH值控制在8.8~9.1,給水管道中檢測到的Fe質量濃度會隨著pH值的變化而變化。給水pH值與Fe質量濃度的關系見圖6。
對于pH值的控制,超臨界機組在進行給水加氧處理時也加入氨氣NH3進行pH值調節,加入氨氣的濃度越大,pH值就越大,同時隨著pH值的增大,Fe質量濃度呈下降趨勢。表明給水加氧處理工況下pH值控制在8.8~9.1時,pH值越大,對抑制管道發生FAC現象越有利,FAC速率越低。
雖然汽車金融在我國取得了長足的發展,但是與歐美等發達國家相比,還相對落后。由于受我國傳統消費觀念的限制,大部分人在購買汽車的時候,不會選擇貸款。據統計在歐美地區4S店金融滲透率已達到80%以上,遠超我國40%的比例,可見汽車金融在我國的發展還有巨大的上升空間。
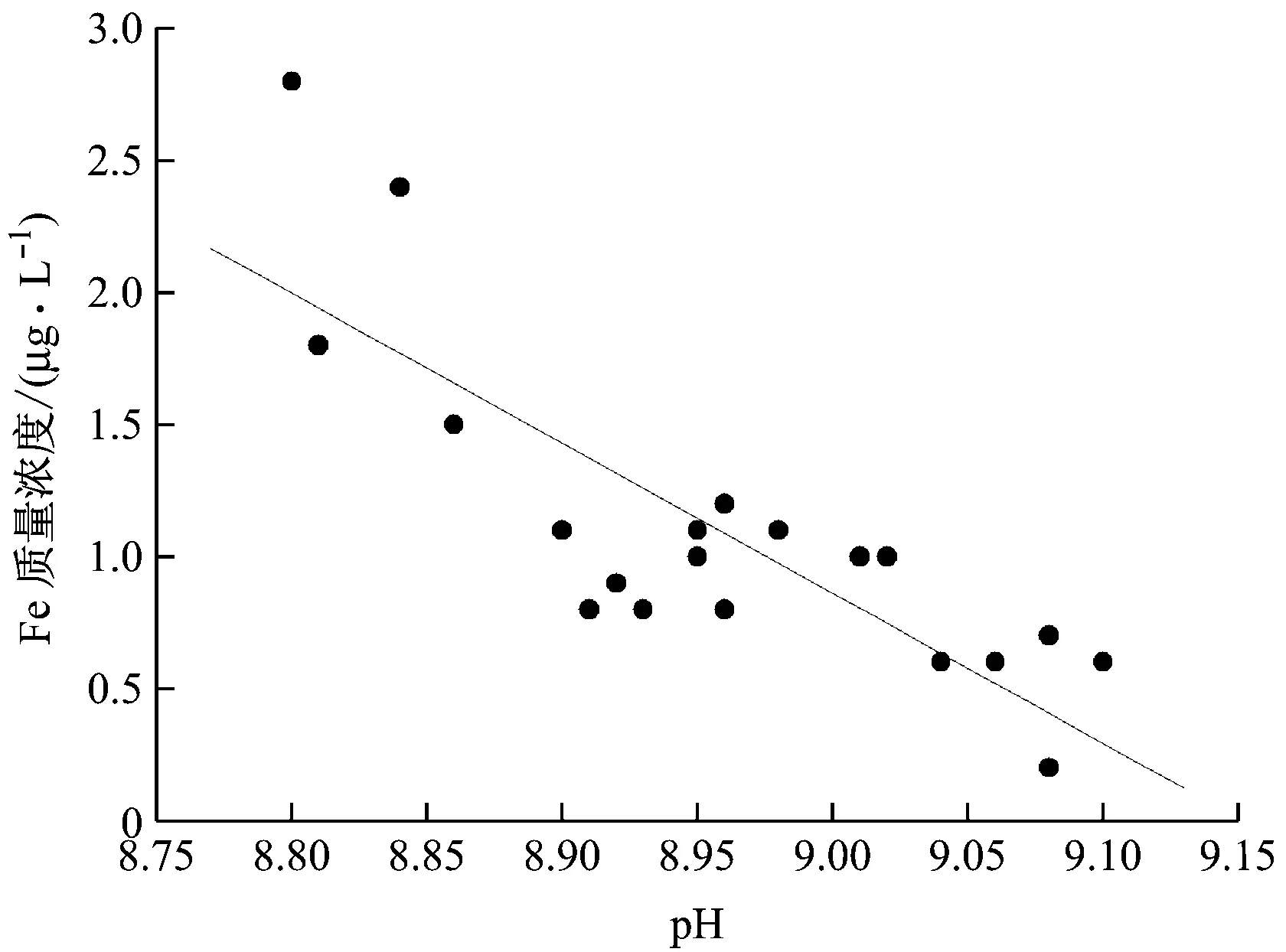
圖6 超臨界機組給水pH值與Fe質量濃度的關系
由圖6可知,由于3號機組進行了加氧處理,增大pH值對Fe質量濃度的影響較小,當pH值在8.8~9.1時, Fe質量濃度出現微小變化,整體Fe質量濃度較低。說明在有氧的給水中,碳鋼的FAC速率受pH值的影響較小,溶解氧含量成為控制FAC的主要因素,給水中Fe質量濃度在pH值為8.9時最低,碳鋼的FAC速率緩慢,并且不再隨著pH值的增大而有所改變。
3.3 氫電導率對給水系統FAC的影響
氫電導率是表征給水水質情況的物理量,其大小直接反映了水中陰離子雜質的數量,氫電導率測量是指被測水樣經過氫型陽離子交換樹脂,將陽離子去除,水樣中僅留下陰離子(Cl-、SO42-、HCO32-)和相應的氫離子,而水中的氫氧根離子則與氫離子中和被消耗掉,不參與反應。假設某種離子占主導,則可以根據氫電導率估算這種離子的最大濃度[9],以及整個有害陰離子的控制水平。
給水氫電導率越大,說明在管道中有大量的陰離子存在,某些陰離子會在有氧條件下與金屬基體電離出來的Fe2+發生如下反應:
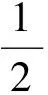
(8)
陰離子雜質破壞了正常磁性Fe3O4氧化膜的生成,也消耗了水中的溶解氧,產生其他可溶性含Fe雜質,對管道產生不利影響。
根據3號機組的汽水系統檢測數據,得到給水氫電導率對Fe質量濃度的影響(見圖7)。
溶液中一些陰離子(如Cl-)能夠與各個界面的Fe2+反應,但在降低Fe2+含量的同時也生成了其他可溶性含鐵物質,且減小了氧化膜的厚度,反而促進了金屬基體表面Fe的電離,因此給水氫電導率也是重要的監測對象,在進行加氧的化學水處理時需要對其進行嚴格的控制。由圖7可知,當氫電導率大于0.08 μs/cm時,給水中Fe質量濃度升高至2~3 μg/L。所以隨著氫電導率的增大,給水中的Fe質量濃度越大,在加氧處理時,要得到較低的FAC速率,在控制加氧量的同時,還需要保持給水較小的氫電導率,其值保持在0.06~0.08 μs/cm最佳。
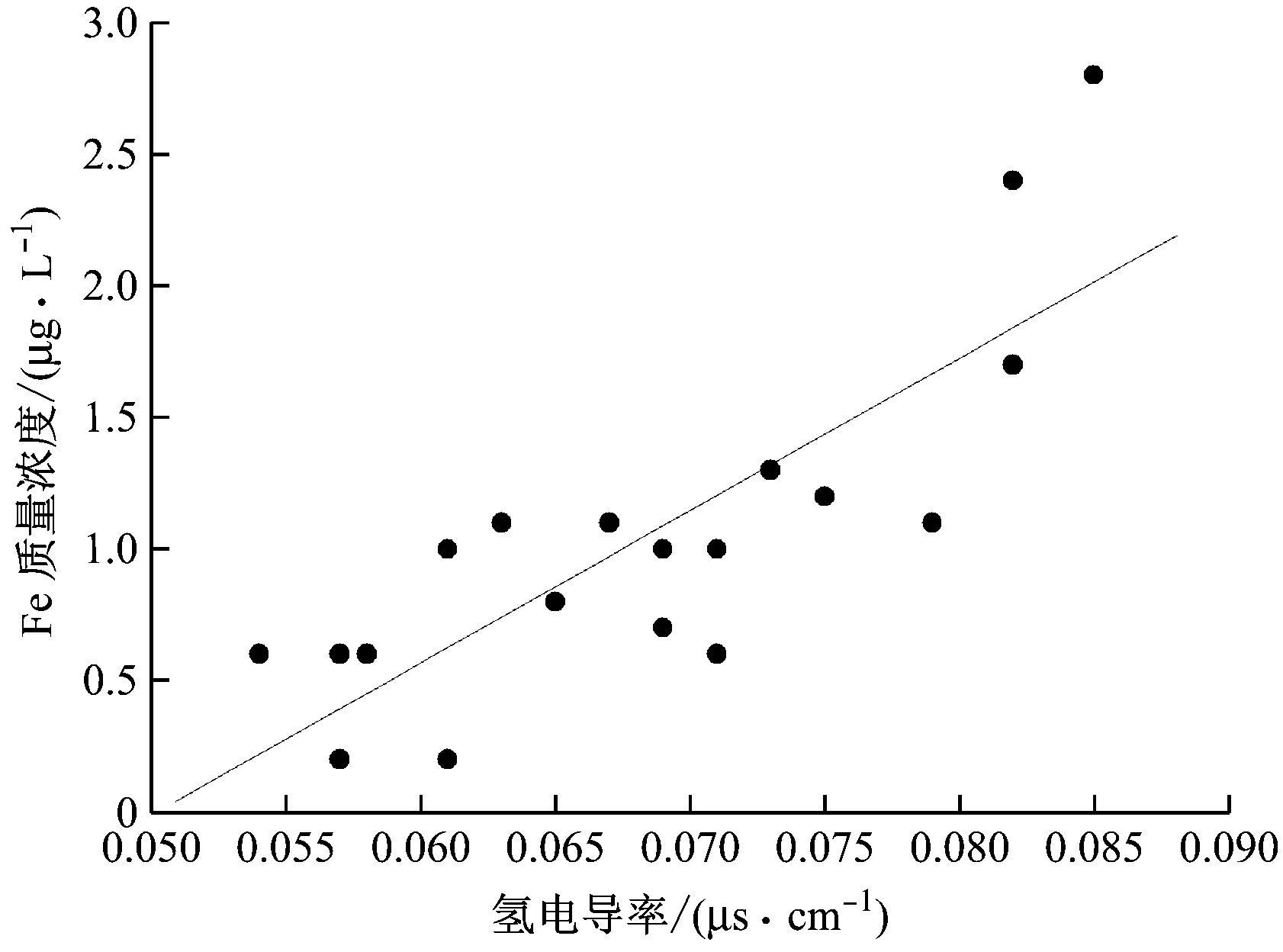
圖7 超臨界機組給水氫電導率對Fe質量濃度的影響
4 電化學因素之間的相互影響
4.1 pH值對臨界溶解氧含量的影響
臨界溶解氧含量是指能剛好將磁性氧化膜Fe3O4溶解與金屬基體腐蝕產生的Fe2+全部轉化為Fe3+的主流區溶解氧含量,是能夠有效抑制管道FAC的最小溶解氧含量。加氧量與給水溶解氧含量相對應,加氧量越多,溶解氧含量越高,最佳加氧量是給水溶解氧含量達到臨界值時的加氧量。而且只要能有效抑制管道FAC,投入的氧氣量越少越好。
根據國內外學者已建立的確定臨界溶解氧含量的數學模型,在合理的假設(即水流均勻穩定地沿管道方向流動)下,得出臨界溶解氧含量Ccr,O2的計算公式[10]:
(9)
式中:DFe、DO2分別為Fe和溶解氧的擴散系數,由相應工質的熱物性表查得;SFe為Fe的熱力學溶解度,pH值對溶解度的影響很大。
表1給出了省煤器入口溫度為T=530 K時,不同給水pH值下的臨界溶解氧含量計算值。

表1 不同pH值下的臨界溶解氧含量
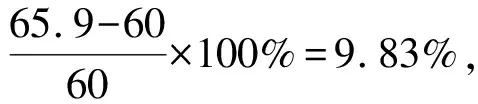
4.2 溶解氧含量對氫電導率的影響
給水中進行加氧處理能夠使易溶解的部分Fe3O4氧化膜轉化為穩定的Fe2O3氧化膜,但原先Fe3O4氧化膜中存在含碳化合物,微孔中有陰離子存在,氧化膜進行轉換、發生物相變化時,釋放出的含碳化合物也可能被氧氣氧化,形成了有機酸和CO2,微孔中也有大量的陰離子擠出,從而導致氫電導率增大。
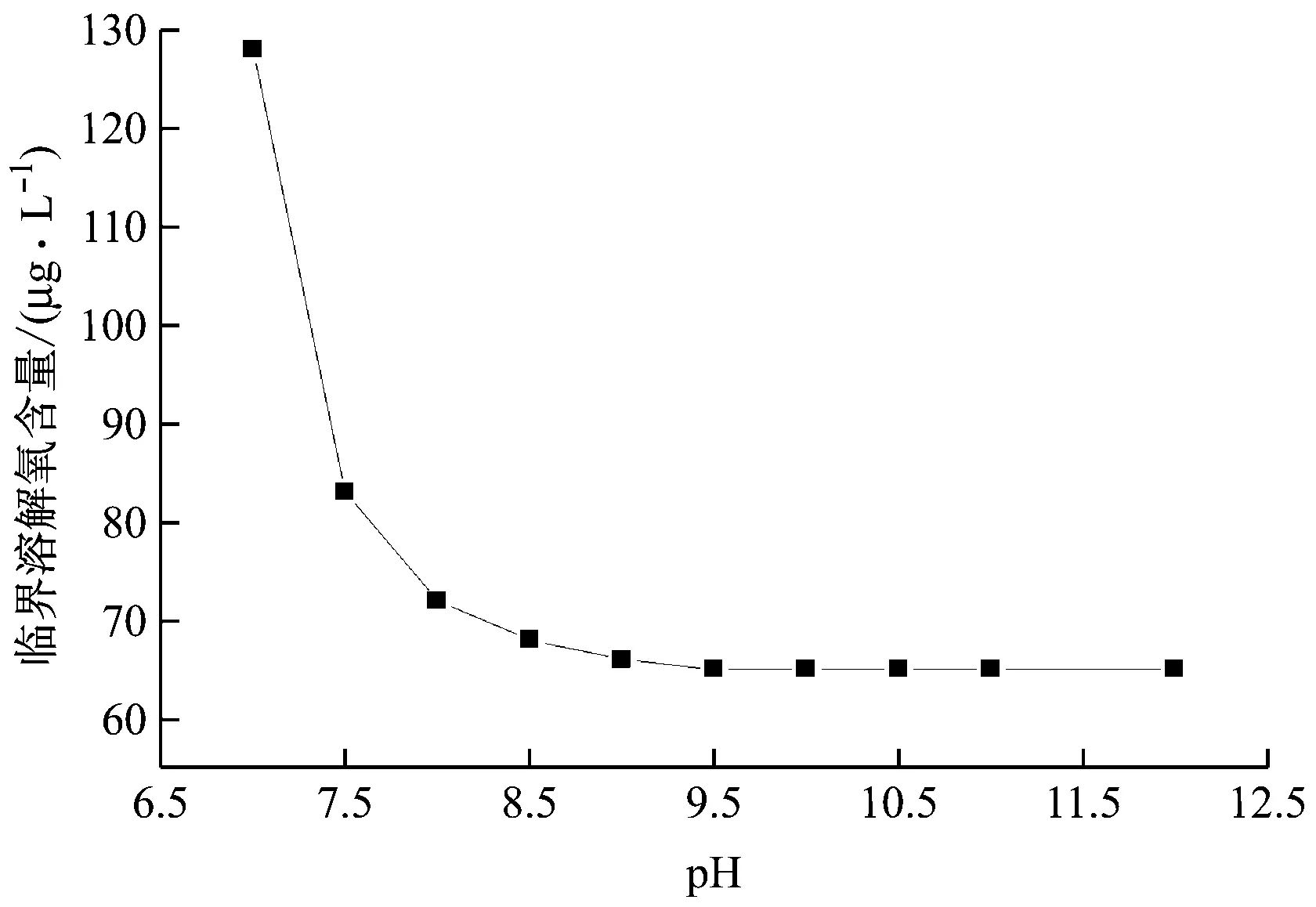
圖8 pH值對臨界溶解氧含量的影響
溶解氧含量的提高能夠抑制管道FAC現象,但給水氫電導率也會隨著溶解氧含量的減小而逐漸增大,過高的溶解氧含量(大于60 μg/L)對應的氫電導率較大,如圖9所示。按照3號機組的氫電導率變化趨勢,其變化斜率為0.000 45。此時當溶解氧含量達到100 μg/L時,氫電導率為0.10 μs/cm,而采用給水加氧處理時氫電導率的目標值為0.10 μs/cm,為了使氫電導率控制在目標值之內(小于0.10 μs/cm),給水溶解氧含量的上限應為70 μg/L,因此超臨界機組采用給水加氧處理時的溶解氧含量應該控制在60~70 μg/L。
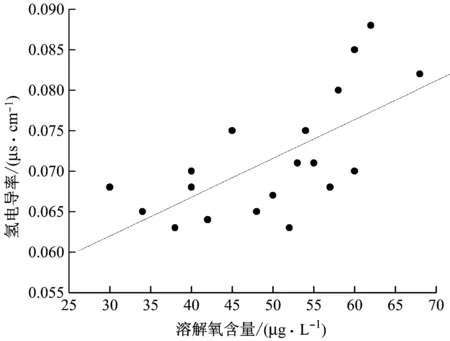
圖9 溶解氧含量對氫電導率的影響
5 結 論
(1)給水加氧處理方式能夠降低FAC速率,有效地抑制管道FAC現象,給水加氧處理工況下的防腐效果優于全揮發處理工況。
(2)給水管道中發生FAC是一個復雜的過程,溶解氧含量、pH值和氫電導率都會影響FAC速率,在工況允許的條件下增大溶解氧含量和pH值、減小氫電導率將降低FAC速率。
(3)電化學因素如溶解氧含量、pH值和氫電導率都存在一個最佳范圍,超臨界機組給水加氧處理工況下pH值應控制在8.8~9.1,氫電導率應控制在0.06~0.08 μs/cm,溶解氧含量應控制在60~70 μg/L。
(4)臨界溶解氧含量與pH值有關,隨著pH值的增大,臨界溶解氧含量逐漸減小。由公式計算得到的臨界溶解氧含量與電廠運行時低給水中Fe質量濃度的溶解氧含量吻合較好,誤差只有9.83%。因此可由公式計算不同pH值下的臨界溶解氧含量,再根據臨界溶解氧含量指導電廠給水泵入口的加氧量。

