腌魚過程中組胺及產組胺菌研究
陳踴南,葉日英,陳俏純,陳慧珍,羅敏敏,陳欣
(廣東海洋大學 食品科技學院,廣東 湛江 524088)
腌魚由于具有獨特的風味而倍受人們青睞,且加工方法簡單、成本低廉,在魚類加工業中占有較大比重,是遠洋捕撈及個體較小的魚多采用的加工方式。魚在腌制過程中,部分蛋白質被分解為游離氨基酸,細菌使其產生脫羧反應生成生物胺。組胺是組氨酸脫羧基反應生成的無色無味、不揮發的有機胺,具有毒性,食用組胺含量較高的腌魚會使人出現急性中毒癥狀或引起慢性病變,曾出現多起由人食用腌魚而產生的組胺中毒事故。國際糧農組織(FAO)和世界衛生組織(WHO)于2012年7月23—27日在羅馬召開專家會議,討論魚和魚產品中組胺和其他生物胺引發的公共健康風險問題,確定組胺的無明顯損害作用水平值(NOAEL)為50 mg。由于金線魚腌制品較多,本研究選用金線魚作為原料進行腌制試驗,在不同的時間點取樣檢測組胺含量。細菌是形成組胺的重要因素,因此在成品腌魚中分離出產組胺細菌,并對其進行產組胺能力檢測和菌屬鑒定,以便今后采取有效措施抑制產組胺細菌的生長,控制腌制魚的組胺含量。
1 材料與方法
1.1 材料
冰鮮金線魚和食鹽均購于湛江市超市。
磷酸組胺標準品(純度≥99%)、D-組氨酸標準品(純度≥98%)、L-組氨酸標準品(純度≥98%)均購于南京奧多福尼生物科技有限公司;其余試劑購于北京陸橋生物技術有限公司。
TD5臺式多管架低速離心機,長沙英泰儀器有限公司;G1314F紫外檢測器,杭州瑞析科技有限公司;TC-24/H(b)型基因擴增儀,杭州博日科技有限公司;DYY-6C型電泳儀,北京市六一儀器廠;VITEK2Compact微生物全自動分析儀,法國梅里埃公司。
1.2 樣品制備
用濾紙吸干金線魚外表的水,稱重,加入30%的食鹽,按層魚層鹽的方法將魚腌制于不銹鋼盆中, 室溫腌制3 d后置于太陽下晾曬,在第1、2、3、4、5、7、10 d取樣檢測。
1.3 組胺含量檢測
參考《GB 5009.208—2016 食品安全國家標準 食品中生物胺的測定》方法,用組胺磷酸鹽標品配制標準使用液,制作標準曲線。準確稱取5 g腌魚于50 mL離心管中,加入TCA水溶液(100 g·L-1)15 mL,均質1 min, 50 ℃超聲波處理30 min,3 000 r·min-1離心10 min后取上清液,水洗沉淀物2次過濾。合并濾液,吸取2 mL濾液置于分液漏斗,加入2~3滴NaOH 溶液(250 g·L-1)使濾液呈堿后,加入3 mL正戊醇,震蕩5 min,分別添加正戊醇3次,靜置15 min提取上層清液,定容至10 mL。準確吸取2 mL正戊醇萃取液于分液漏斗,添加3 mL鹽酸,震蕩5 min,連續添加3次鹽酸溶液并震蕩后靜置15 min,收集下層的鹽酸萃取液并定容至10 mL,搖勻后以零管為參比,用紫外檢測器檢測萃取液的吸光度,代入組胺標準曲線方程求出萃取液的組胺含量并計算腌魚的組胺含量。
1.4 產組胺細菌分離
根據細菌產組胺使培養基堿性增強的原理,利用溴甲酚紫培養基的呈色反應方法進行篩選[1]。由于樣品含有多種氨基酸,細菌利用各類氨基酸產生的生物胺都會使培養基堿性增強,必須排除組胺外的其他生物胺的干擾,試驗中采用二步篩選法進行產組胺細菌分離。
第一步分離產生物胺的細菌:取25 g腌魚成品進行碎處理,加入225 mL無菌水,并進行梯度稀釋。對最后3個稀釋度分別用移液槍移取1 mL稀釋液于滅菌平皿,倒入下層培養基(蛋白胨1 g、牛肉膏1 g、酵母膏1 g、葡萄糖0.1 g、瓊脂3.6 g、吐溫80 0.2 g、磷酸吡哆醛0.01 g、NaCl 0.5 g、MgSO40.08 g、K2HPO40.4 g、D-組氨酸10 g,L-組氨酸1 g、蒸餾水200 mL)10 mL左右輕輕混勻,凝固后于30 ℃培養24~48 h,觀察菌落狀態并計算菌落總數,然后在表面注入5 mL上層培養基(1.6%溴甲酚紫-乙醇1 mL、瓊脂20 g、蒸餾水1 L)覆蓋全部菌落,靜置5~10 min后觀察菌落顏色變化,變紫色或紫藍色的菌落則為形成生物胺的菌株,不變色或呈其他色澤的菌落則不形成生物胺。第二步篩選產組胺的細菌:用接種環小心挑取產生物胺的菌落接種于D、L-組氨酸瓊脂培養基(D-組氨酸10 g,L-組氨酸10 g,NaCl 5 g、磷酸吡哆醛0.01 g,瓊脂15 g,蒸餾水1 L, 調pH 6.0)平板,于30 ℃培養24~48 h至菌落長出充分長成,然后注入上層培養基5 mL左右覆蓋菌落,5~10 min變紫或紫藍色的菌落則為產組胺細菌。
1.5 細菌產組胺能力檢測
將分離細菌接種于產組胺能力檢測培養基(D/L-組氨酸10 g,大豆蛋白胨17 g,葡萄糖2.5 g,丙酮酸鈉10 g,NaCl 3 g,磷酸氫二鉀2.5 g,蒸餾水1 L,調pH 6.0),置于30 ℃恒溫培養48 h后按1.3所述的方法檢測組胺含量,產組胺含量高的菌株則為產組胺關鍵細菌。
1.6 產組胺關鍵細菌的形態學鑒定及生化鑒定
將產組胺關鍵細菌進行革蘭氏染色鏡檢,并觀察細菌菌落特征,同時用全自動細菌鑒定儀作生化反應鑒定。
1.7 產組胺細菌的基因序列鑒定
采用16S rDNA序列鑒定法。參考文獻方法[2],將產組胺細菌制成菌懸液,用細菌通用引物進行PCR擴增,序列測定由生工生物工程(上海)股份有限公司廣州分公司完成,將所得序列與NCBI數據庫中已知細菌序列進行比對和分析。
2 結果與分析
2.1 金線魚腌制過程組胺含量
將組胺標準液于波長480 nm處檢測吸光值并制作標準曲線,采用Origin8.5對組胺標準曲線進行線性分析,所得標準曲線的擬合方程式為y=0.006x+1.821 8,R2=0.999 4。
組胺含量及細菌總數結果如圖1所示,組胺含量與細菌總數的變化規律相似,在腌制第3天出現峰值,第4天開始下降,第7天之后降低至相對穩定狀態。這可能是由于原料魚從冷藏條件到室溫條件的變化促使魚體內細菌快速生長繁殖的緣故。隨著腌制時間的延長,食鹽的滲透作用使魚體的鹽濃度逐漸增大,水分逐漸流失減少,由此導致部分細菌受到抑制,導致第7~10天細菌總數降至最少。蔣倩倩等[3-4]認為,腌魚的組胺含量在腌制前期上升,而在腌制后期下降,是由于其他微生物與產組胺細菌存在競爭和拮抗作用,從而使產組胺細菌生長受到抑制,或者部分組胺被降解的緣故。
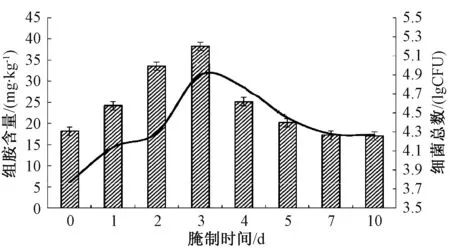
圖1 腌制魚過程中組胺含量及細菌總數變化
2.2 細菌產組胺能力及關鍵細菌
篩選細菌得到7株產組胺菌, 產組胺能力如圖2所示,其中菌株T4和T6的產組胺量明顯大于其余5株細菌,由此確定T4和T6是產組胺關鍵細菌。

圖2 7株細菌培養48 h產組胺量
2.3 產組胺關鍵細菌的形態學特征與生化特性
細菌自動分析儀分析結果顯示,T4與馬胃葡萄球菌(Staphylococcusequorum)最接近, 相似度為96%,T6與蜂房芽孢桿菌(Paenibacillusalvei)最接近,相似度為98%。鏡檢結果顯示,T4細胞為圓形,革蘭氏陽性,無芽孢,無運動;菌落較小,圓形,邊緣整齊,米白色,表面光滑,不透明。T6細胞為桿狀, 革蘭氏陽性,有芽孢,會運動;菌落較小,圓形,邊緣有缺刻,乳白色,表面粗糙無光澤,不透明。形態學檢測及生化檢測的結果顯示,T4、T6分別與蜂房芽孢桿菌和馬胃葡萄球菌和蜂房芽孢桿菌高度相似(表1)。

表1 2株產組胺關鍵細菌部分生化特征
注:-為陰性,+為陽性。
2.4 關鍵細菌的基因序列鑒定結果
將T4和T6的基因序列提交至NCBI, 提交號為2444712, 將所得基因序列與NCBI數據庫的已知細菌序列進行比對,結果T4與馬胃葡萄球菌(Staphylococcusequorum)、T6與蜂房芽孢桿菌(Paenibacillusalvei)相似度均達到100%。根據16S rDNA序列檢測結果構建T4和T6的基因發育樹如圖3、4所示。
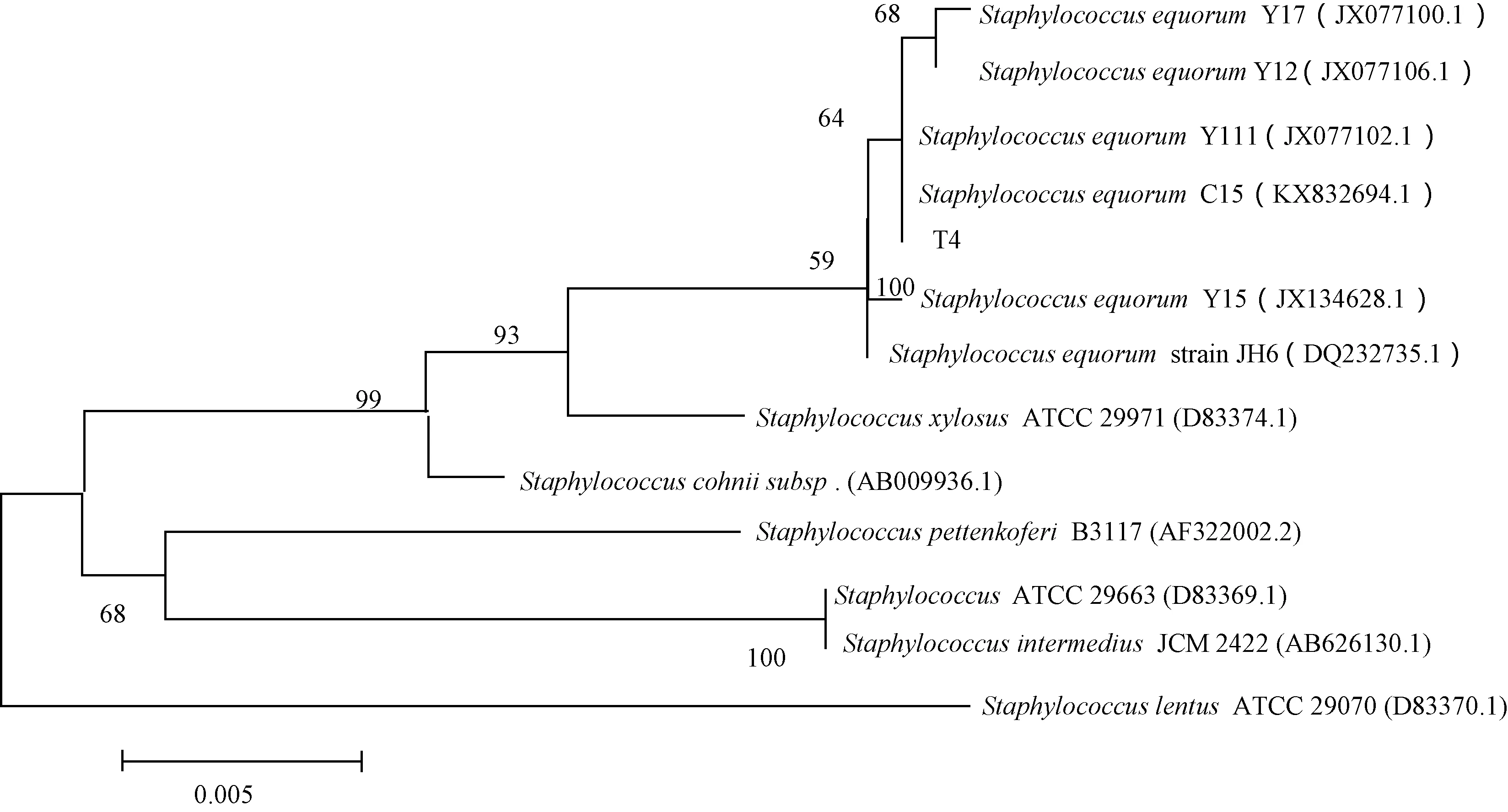
圖3 T4菌株基于16S rDNA基因的系統發育樹
3 討論
在腌制金線魚過程中,組胺含量呈現近似正態分布的變化規律。腌制初始階段,組胺含量呈現逐漸上升趨勢,腌制第3天左右達到峰值,第4 天出現下降,直至第7~10天組胺含量降低至相對穩定水平。分離細菌的結果顯示,細菌總數的變化也與組胺變化規律相似,其中產組胺細菌有7株,產組胺能力相參較強的細菌是馬胃葡萄球菌和蜂房芽孢桿菌。
楊健[5]在鮐魚產組胺微生物生物學特性研究中表明,低溫可以抑制產組胺細菌的生長并能抑制其產生組胺,與本研究結果一致。吳素娟等[6]人認為,隨著干制時間的推移,魚肉水分含量和水分活度不斷降低,到腌制后期,水分活度限制了產組胺細菌的生長,導致組胺含量逐漸降低,這與本實驗在第4~10天的干制階段發現組胺含量下降的結果類似。另外,曾令彬等[7]發現,腌魚中主要的微生物群是微球菌、葡萄球菌、乳酸菌和酵母菌等,部分微生物除了產組胺外,還會產生其他生物胺或其他呈味物質[8],由此產生腌魚理化性質和質構的變化。陳玉峰等[9]建議在生產過程中采用低溫干燥的辦法抑制脫羧酶活性和產組胺細菌的生長,從而有效控制腌制魚中組胺的生成。基于這些研究報道,結合本研究結果,為了健康和安全地食用腌制魚,盡量選擇鹽漬后干制至第7天之后的腌魚進行食用,或者采取特定的技術方法抑制產組胺關鍵細菌,降低腌制魚中組胺的生成量。

圖4 T6菌株基于16S rDNA基因的系統發育樹

