利用光譜技術分析加熱溫度對肌紅蛋白結構的影響
, ,,,
(南京農業大學,肉品加工與質量控制教育部重點實驗室,農業部肉品加工重點實驗室,江蘇省肉類生產加工與質量控制協同創新中心,江蘇南京 210095)
肌紅蛋白是動物細胞內的色素蛋白,由一條多肽鏈與一個血紅素輔基構成,其含量與狀態是影響肉色的重要因素,對于肉品外觀評定具有重要意義[1-3]。處于還原態的肌紅蛋白為紫紅色;當它與氧結合后,生成鮮紅色的氧合肌紅蛋白,是新鮮肉的標志;肌紅蛋白和氧合肌紅蛋白均可被進一步氧化成為褐色的高鐵肌紅蛋白,使肉色變暗,此時血紅素中心的鐵離子被氧化為正三價態[4]。
大部分的肉制品都需要經過加熱之后才會被食用,加熱處理會改變肉蛋白質的理化與結構特性,進而對肉制品的品質產生影響。肌紅蛋白作為主要的肌漿蛋白之一,熱處理會使其發生變性,嚴重影響肉色等品質特征,并且導致其對消化酶的敏感性發生變化,進一步影響到肉及肉制品的營養價值。Joseph等[5]研究表明,肉中肌紅蛋白隨加熱時間延長變性程度不斷增加;Berisha等[6]發現,肌紅蛋白在100 ℃加熱時,蛋白的二、三級結構發生劇烈變化;王琳可[7]發現不同溫度下加熱雞肉,肉中三種形式的肌紅蛋白所占比例不同,且會出現一個使肌紅蛋白狀態發生轉變的關鍵溫度。黃明等[8]研究表明,豬肉色澤隨加熱溫度增加而增加;黃甜和李升升等[9-10]研究表明,加熱后雞肉和牛肉亮度值L*和紅度值a*會發生變化,同時熱處理會使肉品質下降。
目前,對于肌紅蛋白的研究主要集中在對肉品呈色機理的探討和肉品色澤的評定。而應用模擬體系,對加工過程中的物理因素導致肌紅蛋白結構變化進而影響肉品質的研究尚不深入。本研究利用多種光譜技術,重點研究加熱處理對純肌紅蛋白結構的影響,以期為實際熱加工引起的蛋白質結構和營養價值的變化提供理論基礎,為肉類加工與合理消費提供一定的科學依據。
1 材料與方法
1.1 材料與儀器
馬骨骼肌肌紅蛋白 美國Sigma Aldrich公司;鹽酸、磷酸氫二鈉、磷酸二氫鉀、8-苯胺-1-萘磺酸(ANS)等 均為分析純。
TW 20水浴鍋 德國Julabo公司;Fiveeasy臺式pH計 瑞士Mettler Toledo公司;J-1500圓二色譜儀 日本JASCO公司;UV-2450紫外分光光度計 日本島津公司;RF-5301熒光分光光度計 日本島津公司。
1.2 實驗方法
1.2.1 肌紅蛋白溶液的制備及處理 配制10 mmol/L磷酸鹽緩沖液(含10 mmol/L Na2HPO4與10 mmol/L NaH2PO4,pH7.0)。將肌紅蛋白溶解于上述磷酸鹽緩沖液,配制為0.5、2 mg/mL的蛋白溶液。將配制好的肌紅蛋白溶液分別置于60、70和80 ℃水浴中加熱20 min,然后將樣品從水浴鍋中取出并迅速浸入冰中,待溶液中心溫度恢復至室溫后,進行下述測定。
1.2.2 紫外-可見吸收光譜 取3 mL肌紅蛋白溶液(0.5 mg/mL),置于石英比色皿中,以10 mmol/L 磷酸鹽緩沖液為參比,測定并記錄250~650 nm的紫外-可見吸收光譜。
1.2.3 內源熒光光譜 取3 mL肌紅蛋白溶液(0.5 mg/mL),置于1 cm石英比色皿中,以280 nm為激發波長,在熒光分光光度計上記錄300~400 nm波長范圍內的熒光發射光譜。
1.2.4 同步熒光光譜 取3 mL肌紅蛋白溶液(0.5 mg/mL),置于1 cm石英比色皿中,改變發射波長λem與激發波長λex之間的波長差Δλ,λem=λex+Δλ[11]。固定Δλ分別為30和60 nm,同時對激發和發射波長進行掃描,并記錄相應波長范圍內的同步熒光光譜。
1.2.5 圓二色光譜 移取200 μL處理后肌紅蛋白溶液(0.5 mg/mL)于0.1 cm的石英樣品池,測定190~250 nm波長范圍的光譜[12]。設置測量參數為:掃描速率200 nm/min,帶寬1 nm,分辨率0.5 nm,響應時間1 s,掃描次數3次,取平均值。
1.2.6 表面疏水性的測定 肌紅蛋白的表面疏水性測定參考Schma等[13]的ANS探針方法,并略做改動。取20 μL的ANS溶液(10 mmol/L,pH7.0的0.01 mol/L磷酸鹽緩沖液配制)與2 mL肌紅蛋白溶液混勻(2 mg/mL),室溫避光0.5 h后,以375 nm為激發波長,記錄465 nm處熒光的強度變化。
1.3 數據分析
每個處理組設置五個重復,進行上述各項指標的測定并進行相關參數分析,用SAS 8.0對測定的數據進行標準差的分析計算。
2 結果與分析
2.1 紫外-可見吸收光譜
蛋白質中的芳香氨基酸殘基側鏈和肽鍵對光的吸收會產生紫外光譜[14]。蛋白質的構象變化會導致紫外吸收的光譜變化,因此蛋白質構象信息可由紫外吸收光譜的變化反映。如圖1,對肌紅蛋白溶液進行250~650 nm的全波長掃描發現其紫外-可見吸收光譜特征符合高鐵肌紅蛋白光譜特征,可見實驗所購肌紅蛋白幾乎全部為高鐵肌紅蛋白形式。

圖1 加熱溫度對肌紅蛋白紫外-可見吸收光譜的影響Fig.1 Effect of heating temperature on UV-VIS spectroscopy of myoglobin注:a為Soret帶;b為Q帶;c為LMCT帶。
當掃描波段處于紫外光區時,所有處理組肌紅蛋白特征吸收峰均在280 nm附近,這是由肽鏈上色氨酸和酪氨酸的苯雜環發生了π-π*躍遷[15]。由表1可見,樣品的紫外吸收強度隨溫度升高而呈降低趨勢。表明隨著溫度升高,肌紅蛋白變性程度增加,蛋白逐漸發生沉降損失,造成280 nm處吸光值顯著降低(p<0.05)。
高鐵肌紅蛋白血紅素輔基中的鐵原子是六配體,它與四個吡咯環的氮原子相連,同時其第五配位與多肽鏈的His-93殘基結合、第六配位與一個水分子結合后,分別在409 nm(Soret帶)、504 nm(Q帶)以及630 nm(LMCT帶)出現特征譜峰[16]。如圖1可見,當掃描波段位于可見光區時,吸收圖譜出現了3處特征峰。卟啉環共軛體系的π-π*躍遷導致Soret帶和Q帶產生吸收峰,可據此分別判斷鐵卟啉結構的變化以及鐵原子與多肽鏈的結合情況。表1為加熱溫度對紫外-可見吸收光譜特征峰的影響。由表1可知,60 ℃和70 ℃加熱時,409 nm處吸收強度變化不顯著(p>0.05),而80 ℃加熱后該處吸光值顯著低于對照組(p<0.05),表明加熱溫度達80 ℃會導致鐵卟啉結構的破壞。504 nm處的特征峰強度均隨著加熱溫度升高呈降低趨勢。且60 ℃加熱時504 nm處吸收強度即顯著低于對照組(p<0.05),可能是加熱導致了中心鐵原子和遠端組氨酸之間的結合減弱,表明該結構對加熱較為敏感。
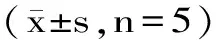
表1 加熱溫度對紫外-可見吸收光譜特征峰的影響Table 1 Effects of heating temperature on spectral characteristic peaksof UV-VIS
2.2 內源熒光光譜
肌紅蛋白的內源熒光主要來源于色氨酸(Trp)和酪氨酸(Tyr),可靈敏反映環境對蛋白的影響,被廣泛應用于蛋白質結構的研究[17]。如圖2,肌紅蛋白的內源熒光最大發射峰在360 nm附近。表2為加熱溫度對同步熒光光譜特征峰的影響。由表2可見,僅80 ℃加熱使熒光強度顯著高于對照組(p<0.05),而60、70 ℃加熱后熒光強度變化不顯著(p>0.05)。可能是因為,加熱溫度低于80 ℃加熱時,肌紅蛋白的變性程度較小或仍未可逆變性,蛋白結構變化較小,因而熒光強度變化不顯著(p>0.05)。溫度達80 ℃時,蛋白變性使多肽鏈展開,疏水基團暴露程度增高,使得熒光強度顯著增高(p<0.05)。
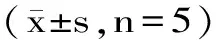
表2 加熱溫度對同步熒光光譜特征峰的影響Table 2 Effects of heating temperature on the characteristic peaks of synchronous fluorescence
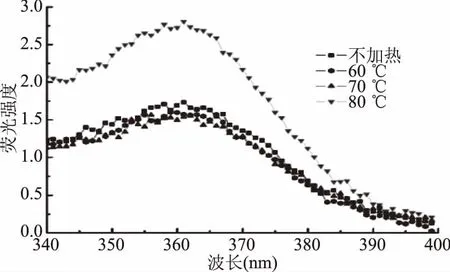
圖2 加熱溫度對肌紅蛋白內源熒光光譜的影響Fig.2 Effect of heating temperature on intrinsic fluorescence spectra of myoglobin
2.3 同步熒光光譜
芳香族氨基酸引起肌紅蛋白280~400 nm處的熒光,當Δλ=30 nm時,同步熒光光譜僅表現酪氨酸殘基的熒光特性;當Δλ=60 nm時,僅表現色氨酸殘基的熒光特性。酪氨酸與色氨酸熒光最大發射波長處的熒光變化見表2。
圖3a顯示,Δλ=30 nm時,最大熒光發射峰出現在329 nm附近。60 ℃加熱時,酪氨酸熒光光譜未見明顯改變;70 ℃時,酪氨酸最大發射峰強度顯著降低(p<0.05);而80 ℃時顯著增加(p<0.05)。推測該現象與肌紅蛋白變性過程中發生的血紅素解離與多肽鏈展開有關。溫度較低時,血紅素解離造成部分酪氨酸殘基的損失,而多肽鏈尚未展開,導致酪氨酸熒光強度下降;溫度較高時,多肽鏈迅速展開,血紅素口袋打開,使酪氨酸熒光強度增大。
圖3b顯示,Δλ=60 nm時,最大熒光發射峰在353 nm附近。80 ℃加熱時,熒光強度顯著高于其他處理組(p<0.05),可能是因為其多肽鏈變性程度增加,血紅素口袋逐漸打開,色氨酸殘基暴露程度隨之增加。
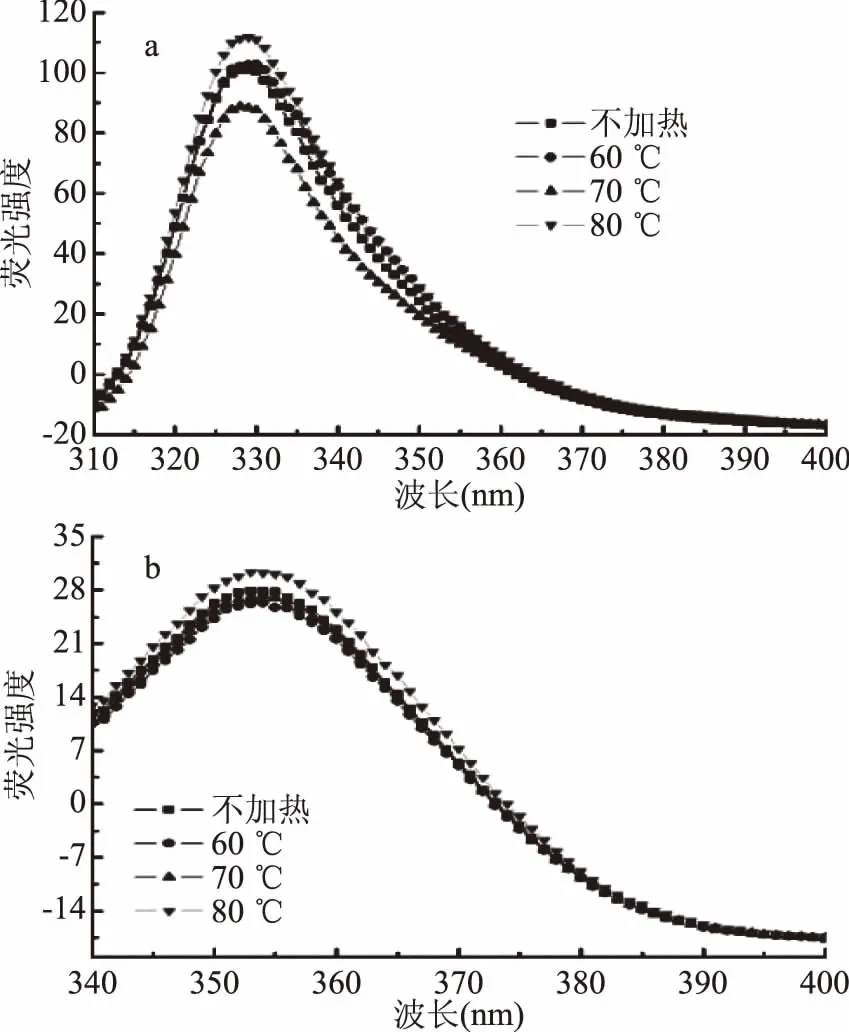
圖3 加熱溫度對肌紅蛋白同步熒光光譜的影響Fig.3 Effect of heating temperature on Synchronous fluorescence spectra of myoglobin 注:a為酪氨酸殘基,Δλ=30 nm; b為色氨酸殘基,Δλ=60 nm。
同步熒光結果表明,色氨酸殘基比酪氨酸殘基對加熱處理更為敏感,在60 ℃加熱時色氨酸殘基熒光強度即發生顯著變化(p<0.05)。這可能與兩種氨基酸殘基的位置分布有關,酪氨酸為極性基團,而色氨酸為疏水性較強的非極性基團[18]。因此酪氨酸殘基分布在肌紅蛋白表面,色氨酸殘基則處于血紅素口袋中。由于酪氨酸殘基本來就在蛋白表面,因此在較低溫度加熱時,其暴露程度與對照組無顯著差異(p<0.05),而血紅素的暴露及脫落變化則較為顯著,即外界加熱對色氨酸殘基的影響更大。
2.4 圓二色譜
圓二色譜是一種測定溶液中蛋白質二級結構的靈敏技術[19]。蛋白質二級結構的規律取決于肽鍵的有序排列,其排列方向決定了能級躍遷的分裂情況,因此蛋白質的二級結構發生改變,其CD譜峰隨之變化[20]。
如圖4,肌紅蛋白的圓二色光譜在192 nm附近出現一個正吸收峰,209和223 nm附近出現兩個負吸收峰,這是典型的α螺旋結構特征CD峰,表明α-螺旋為該蛋白二級結構主要成分[21]。加熱后,CD特征峰強度發生略微改變,但肩峰的位置和形狀都沒有發生明顯改變,表明加熱雖然改變了蛋白二級結構組成,但α-螺旋結構仍占主導地位。肌紅蛋白二級結構各成分含量見圖5。隨著加熱溫度的升高,α-螺旋呈先增后減趨勢,在60 ℃加熱時增加,而加熱溫度高于70 ℃時,α-螺旋含量逐漸降低,肌紅蛋白結構的無序化程度增高。Moriyama等[22]指出,當加熱溫度低于75 ℃并且加熱后恢復至室溫時,肌紅蛋白的α-螺旋含量可基本恢復至初始值,即低于75 ℃的加熱為可逆加熱;但當加熱溫度高于75 ℃時,二級結構的變化則不可逆轉,α-螺旋含量顯著降低。這與本研究結果相似,但在本研究中溫度高于70 ℃加熱時,二級結構含量出現顯著變化(p<0.05),表明70 ℃時已發生不可逆加熱,可能是與之前研究的蛋白生物來源不同導致的差異。
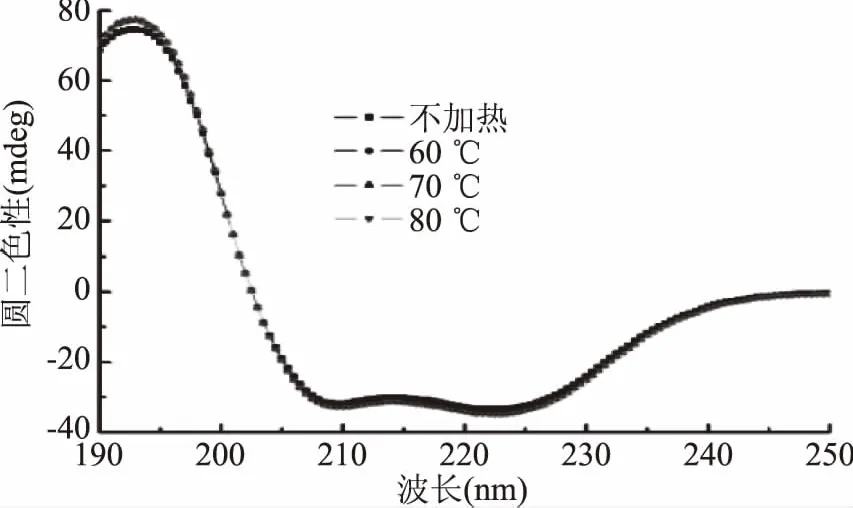
圖4 加熱溫度對肌紅蛋白圓二色光譜的影響Fig.4 Effect of heating temperature on CD spectra of myoglobin
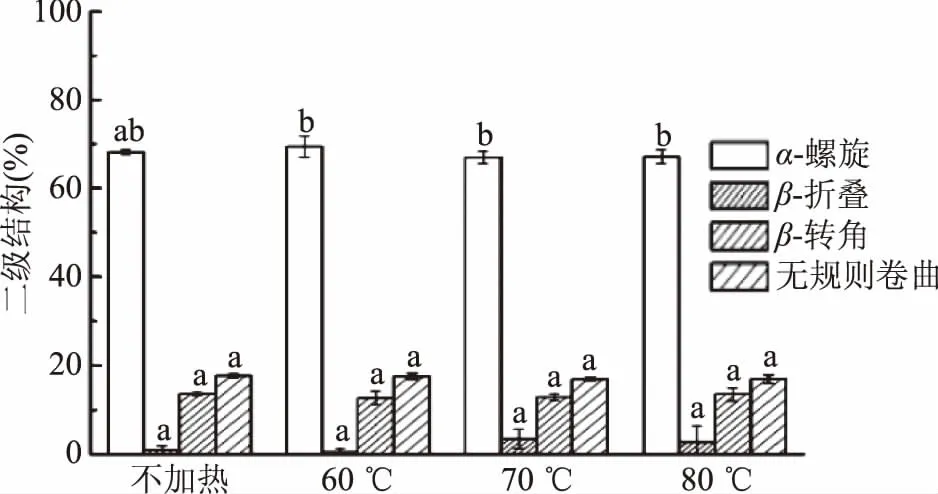
圖5 加熱溫度對肌紅蛋白二級結構影響Fig.5 Effect of heating temperature on the secondary structure of myoglobin 注:不同字母表示加熱溫度不同時差異顯著(p<0.05);圖6同。
2.5 表面疏水性
疏水相互作用力是維持蛋白三級結構中最重要的穩定力。以ANS作為熒光探針,可反映蛋白的三級結構變化情況[23]。通常來說,加熱會導致疏水氨基酸殘基的暴露,使蛋白質的疏水性增加。以最大吸收波長475 nm處熒光強度表征不同加熱程度處理的肌紅蛋白的疏水性,結果見圖6。加熱后肌紅蛋白表面疏水性均顯著高于對照組(p<0.05),但不同溫度處理組的結果無顯著性差異(p>0.05)。表明加熱后肌紅蛋白的三級結構展開,從而利于ANS與蛋白疏水部位結合。70 ℃時表面疏水性略有下降,與酪氨酸熒光的結果一致,表明70 ℃加熱時肌紅蛋白血紅素沉積的阻礙作用較為明顯。

圖6 加熱溫度對肌紅蛋白表面疏水性的影響Fig.6 Effect of heating temperature on surface hydrophobicity of myoglobin
3 結論
本研究中,隨著加熱溫度的增高,肌紅蛋白紫外可見光譜特征峰吸收強度降低,血紅素鐵原子與多肽鏈結合力減弱,血紅素逐漸解離沉積,蛋白變性損失;熒光光譜特征峰強度和表面疏水性增高,多肽鏈逐漸展開,極性基團暴露,三級結構發生明顯改變;α-螺旋含量降低,蛋白二級結構的無序化程度增高。肌紅蛋白雖然具有一定的耐熱性,但高溫加熱仍會導致非血紅素鐵的釋放和蛋白結構的無序化,加熱溫度不超過70 ℃時,肌紅蛋白主要發生三級結構的局部變化,但高于70 ℃的加熱會嚴重擾亂肌紅蛋白二、三結構,且變性過程不可逆。加熱導致的蛋白二級結構變化還將進一步影響蛋白質的體外消化情況[24]。實際加工中的熱處理操作應把握好肌紅蛋白結構發生轉變的關鍵溫度和加熱時間,避免過度加熱。

