15株乳酸菌的表面性質(zhì)及其黏附能力
,,,,,
(東北農(nóng)業(yè)大學,乳品科學教育部重點實驗室,黑龍江哈爾濱 150030)
乳酸菌是可以發(fā)酵碳水化合物產(chǎn)生大量乳酸的細菌統(tǒng)稱,具有調(diào)節(jié)機體免疫、促進腸道內(nèi)微生物菌群的生態(tài)平衡、改善腸道菌群結(jié)構等多種益生功能[1-2]。目前研究表明,乳酸菌對腸道上皮細胞的特異性黏附作用有助于其在腸道定植、增強乳酸菌與腸道細胞之間的信號交流、抑制病原菌在腸道的定植和提高機體的免疫力。而乳酸菌在腸道中定植的前提是其必須黏附于宿主細胞表面[3-4]。所以,目前普遍把乳酸菌黏附性作為評價其能否成為益生菌的首要標準[5-7]。Tuo等[7]研究表明乳酸菌的自凝聚能力和疏水性與菌株的黏附能力存在一定的正相關性。尤其菌體表面疏水性是影響乳酸菌黏附性的內(nèi)在因素,近幾年來被廣泛地作為評價乳酸菌黏附性能的重要指標。
細菌黏附與其細胞壁的組成成分密切相關。早在1985年,Camp等[8]在研究雙歧桿菌黏附時發(fā)現(xiàn),脂磷壁酸(Lipoteichoic acid,LTA)參與了乳桿菌黏附腸上皮細胞的過程。目前已發(fā)現(xiàn),乳酸桿菌細胞表面的表層蛋白(Surface layer protein,SLP)、胞外多糖(Exopolysaccharide,EPS)、脂多糖(Lipopolysaccharide,LPS)以及肽聚糖(Whole peptidoglycan,WPG)等成分在乳酸菌的黏附過程中起到了一定的作用,因而這些成份也被稱作黏附素[9-10]。而乳酸菌表層蛋白是目前研究最多,也是乳酸菌中比較普遍的一類黏附素。這些黏附素可以與腸道上皮細胞表面的受體發(fā)生特異性結(jié)合,隨之引發(fā)一系列復雜的生理變化[11]。但是對于乳酸菌的黏附機制尚不明確。
本實驗以實驗室鑒定保藏完好的15株乳酸菌為研究對象,以具有良好黏附性能和益生功能的嗜酸乳桿菌NCFM作為對照,采用體外細胞培養(yǎng)和表面性質(zhì)檢測相結(jié)合的方法,對益生菌株黏附性質(zhì)進行研究,篩選出高黏附乳酸菌菌株。再通過化學和酶處理乳酸菌細胞壁表面成分,經(jīng)過cFDA-SE熒光標記后,測定黏附性質(zhì)的變化,分析參與黏附的成分,確定主要黏附素。以期能對嗜酸乳桿菌KLDS1.0901的黏附機制進行初步探究。
1 材料與方法
1.1 材料與儀器
14株受試乳酸菌(見表1) 均為乳品科學教育部重點實驗室保藏菌種,都分離自中國內(nèi)蒙古地區(qū)傳統(tǒng)發(fā)酵乳制品[12-14];嗜酸乳桿菌NCFM(參照菌株) 由東北農(nóng)業(yè)大學姜毓君教授贈送;人體結(jié)腸腺癌細胞系Caco-2細胞株 購自中國科學院上海細胞庫;MRS培養(yǎng)基 采用參考文獻[12]的方法制備;M17肉湯培養(yǎng)基 北京天根生物技術有限公司;高糖DMEM培養(yǎng)基 美國HyClone公司;cFDA-SE 碧云天;青霉素-鏈霉素雙抗、胰蛋白酶-EDTA 美國Gibco公司;MULTICELL胎牛血清 UK公司。
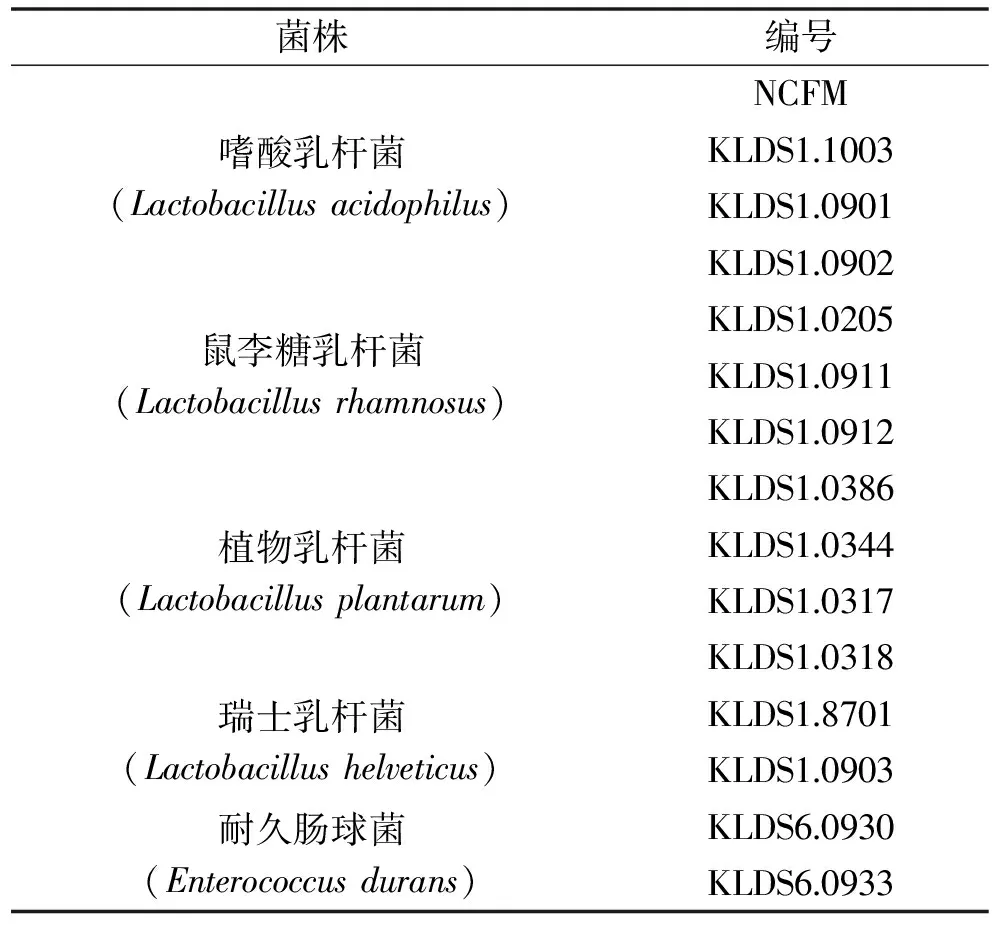
表1 15株受試乳酸菌Table 1 15 strains of tested lactic acid bacterias
HVE-50型高壓滅菌鍋 日本HIRAYAMA公司;ZHWY-100B型臺式振蕩器 上海智誠分析儀器制造有限公司;DB-3B型電子天平 沈陽龍騰電子有限公司;VD-1320型潔凈工作臺 北京東聯(lián)哈爾儀器制造有限公司;GL-21M型高速冷凍離心機 上海市離心機械研究所有限公司;DHP-9272型電熱恒溫培養(yǎng)箱 上海一恒科技有限公司;Heal Force型細胞培養(yǎng)箱 力康醫(yī)療生物科技控股有限公司;DMLB型光學顯微鏡 德國徠卡顯微鏡與系統(tǒng)公司;SectrumLab54型紫外分光光度計 上海棱光技術有限公司;F4500熒光分光光度計 日本日立公司;Aira II流氏細胞儀 美國BD公司。
1.2 實驗方法
1.2.1 乳酸菌的培養(yǎng) 將活化好的乳酸菌按體積分數(shù)為2%的接種量接種于MRS液體培養(yǎng)基中,37 ℃培養(yǎng)20 h,離心收集菌體(8000×g,4 ℃,10 min),用無菌PBS溶液(pH=7.2)洗滌2次后,將菌體重懸于PBS中,將菌懸液的A600調(diào)整至所需要的濃度。
1.2.2 表面疏水性測定 通過二甲苯萃取測定菌株的疏水性[15]。用PBS調(diào)整待測菌懸液的吸光度為OD600=0.25±0.05。取3 mL待用菌懸液,向其中加入等體積的二甲苯,漩渦振蕩3 min后,在室溫下孵化1 h(此時形成兩相體系)。吸取水相,并測定其600 nm處的吸光度(A)。A0為萃取前待測菌懸液的吸光度。重復進行3次獨立實驗,取平均值。
疏水率(%)=[(A0-A)/A0]×100
1.2.3 自凝聚能力測定 乳酸菌的自凝聚實驗采用任大勇[16]的方法并略作修改。按照1.2.1中的方法制備乳酸菌懸液。取2 mL菌液漩渦振蕩10 s,測其吸光度(A0),再在37 ℃下靜置2 h后,小心吸取其上清液1 mL,并測其吸光度(At)。自聚能力計算公式為:
自凝聚率(%)=[(A0-At)/A0]×100
1.2.4 Caco-2細胞黏附實驗
1.2.4.1 細胞培養(yǎng) 從液氮罐中取出Caco-2細胞凍存管,迅速于37 ℃水浴鍋反復搖動以迅速融化細胞,無菌條件下吸盡管中液體至10 mL無菌離心管中,加3 mL高糖DMEM培養(yǎng)基,在4 ℃條件下,1000 r/min離心5 min,棄上清;加入5 mL高糖DMEM培養(yǎng)基(補充10%的熱滅活胎牛血清和1%雙抗(青霉素濃度100 U/mL、鏈霉素100 μg/mL,經(jīng)0.22 μm濾膜過濾除菌,并于4 ℃冰箱貯存?zhèn)溆肹16]),用移液槍輕輕吹打混勻后轉(zhuǎn)移至50 mL細胞培養(yǎng)瓶中,放入5% CO2培養(yǎng)箱中37 ℃培養(yǎng);隔天更換新鮮高糖DMEM培養(yǎng)基;待細胞生長狀態(tài)良好(貼壁生長為單層且培養(yǎng)瓶底部80%左右被細胞覆蓋),用1 mL 0.25%胰蛋白酶-EDTA進行消化傳代。傳代四五次后,即可進行黏附試驗。
1.2.4.2 乳酸菌懸液制備 同1.2.1中乳酸菌經(jīng)無菌PBS洗滌兩次后,再將離心收集的菌體,重懸于不含雙抗的高糖DMEM培養(yǎng)基中,并調(diào)整菌懸液的濃度為108CFU/mL。
1.2.4.3 乳酸菌對Caco-2細胞的黏附能力 乳酸菌對Caco-2細胞的黏附試驗采用Nueno-Palop等[17]的方法,并稍作改動。將Caco-2細胞以105細胞/孔的濃度從培養(yǎng)瓶傳代接種至12孔板中,孔中培養(yǎng)液需每隔一天更換一次,待細胞貼壁完全后,繼續(xù)培養(yǎng)10 d,細胞處于極化狀態(tài)時方可進行實驗。在進行試驗的前一天,向孔板中加入不含雙抗的高糖DMEM培養(yǎng)基。添加乳酸菌之前,用無菌PBS洗滌孔板中單層Caco-2細胞兩次,再向每個孔中加入500 μL濃度為108CFU/mL(V0)的乳酸菌;將12孔板轉(zhuǎn)移至5% CO2培養(yǎng)箱中,37 ℃培養(yǎng)2 h后;用PBS溶液洗滌12孔板中每孔的單層細胞層3次以上,以洗脫沒有黏附的細菌和代謝分泌物。然后向每個孔中加入250 μL 0.25%胰蛋白酶-EDTA孵育10 min;再加入250 μL血清終止消化;收集每個孔內(nèi)溶液,并分別進行10倍梯度稀釋,采用平板菌落計數(shù)法檢測培養(yǎng)后菌株的活菌數(shù)(V1)。黏附率(%)計算方法如下:
黏附率(%)=(V1/V0)×100
1.2.4.4 乳酸菌對Caco-2黏附觀察 將Caco-2細胞以105/孔接種于含有載玻片的六孔板中,其他試驗步驟同1.2.4.3中的處理。乳酸菌與細胞在37 ℃ 5% CO2培養(yǎng)箱中共同孵育2 h后,用無菌PBS緩沖液洗滌三次;取出載玻片,用0.4%的多聚甲醛固定30 min,自然晾干后,進行革蘭氏染色,光學顯微鏡下觀察乳酸菌的黏附情況。
1.2.5 乳酸菌的熒光標記 用二甲基亞砜(DMSO)溶液配制1 mmol/L cFDA-SE儲備液[18]。用0.22 μm濾膜過濾除菌后,避光儲存在-20 ℃中備用。將菌體重新懸于PBS溶液中,配制活菌體濃度為108CFU/mL,再向懸浮的乳酸菌中加入cFDA-SE儲備液,至最終濃度為20 μmol/L,37 ℃避光靜置15 min,離心(8000 r/min,4 ℃,10 min),再用PBS洗滌三次,除去多余的熒光染料。再將菌體重懸于無菌PBS溶液中。用流式細胞儀檢測分析cFDA-SE標記情況(激發(fā)波長為488 nm)。
1.2.6 化學和酶處理對乳酸菌黏附性的影響
1.2.6.1 氯化鋰處理 乳酸菌經(jīng)PBS洗滌2次后,離心(8000×g,4 ℃,10 min)收集菌體,加入1 mL的5 mol/L 氯化鋰溶液,用移液槍吹打均勻,于37 ℃搖床(200 r/min)孵育1 h。
1.2.6.2 飽和苯酚處理 將乳酸菌菌體懸浮于1 mL飽和苯酚溶液中,65 ℃作用30 min,之后在室溫下漩渦混合30 min。
1.2.6.3 高碘酸鈉處理 將乳酸菌菌體懸浮在1 mL 0.05 mol/L高碘酸鈉溶液中,37 ℃孵育30 min。
1.2.6.4 胃蛋白酶處理 將胃蛋白酶溶解于0.05 mol/L甘氨酸-HCl 緩沖液(pH2.2)中,制成400 U/mL的溶液,然后0.22 μm濾膜過濾除菌。將乳酸菌菌體懸浮于1 mL胃蛋白酶溶液中,37 ℃作用30 min。
1.2.6.5 胰蛋白酶處理 將胰蛋白酶溶解于0.2 mol/mL的PBS(pH8.0)中,制成400 U/mL的溶液,然后0.22 μm濾膜過濾除菌。將菌體懸浮于胰蛋白酶溶液中,37 ℃作用30 min。
1.2.6.6 熱處理 將菌體重懸于PBS溶液,于100 ℃水浴鍋中加熱5 min。
將以上不同處理過的菌體離心(8000 r/min,4 ℃,10 min),重新懸于PBS溶液,調(diào)整其濃度為108CFU/mL,熒光標記后進行黏附實驗,以未進行任何處理的乳酸菌作為對照。考慮到化學和酶處理對熒光標記的影響,以黏附實驗后的熒光強度比上相同處理乳酸菌的熒光強度值為黏附率。
1.3 數(shù)據(jù)處理
實驗結(jié)果均以平均數(shù)±標準差來表示,采用Origin 8.0 對實驗數(shù)據(jù)進行做圖及擬合處理。運用SPSS 20.0 軟件進行獨立樣本T檢驗和單因素方差分析。
2 結(jié)果與分析
2.1 乳酸菌的疏水性
由圖1可知,15株乳酸菌中,耐久腸球菌KLDS6.0933的表面疏水性為30.00%,遠高于其他14株受試乳酸菌。嗜酸乳桿菌KLDS1.1003和KLDS1.0901的疏水性次之,分別為12.66%、13.88%。實驗結(jié)果也表明:同一種乳酸菌不具有相似的疏水性。這與Tuo等[7]的實驗結(jié)果一致。嗜酸乳桿菌KLDS1.0902的疏水性僅為1.07%,顯著低于(p<0.05)KLDS1.1003和KLDS1.0901;鼠李糖乳桿菌KLDS1.0205的疏水性為5.79%,高于KLDS1.0911和KLDS1.0912。同樣,對于受試的4株植物乳桿菌,KLDS1.0344和KLDS1.0318的疏水性要顯著高于KLDS1.0386、KLDS1.0317(p<0.05)。
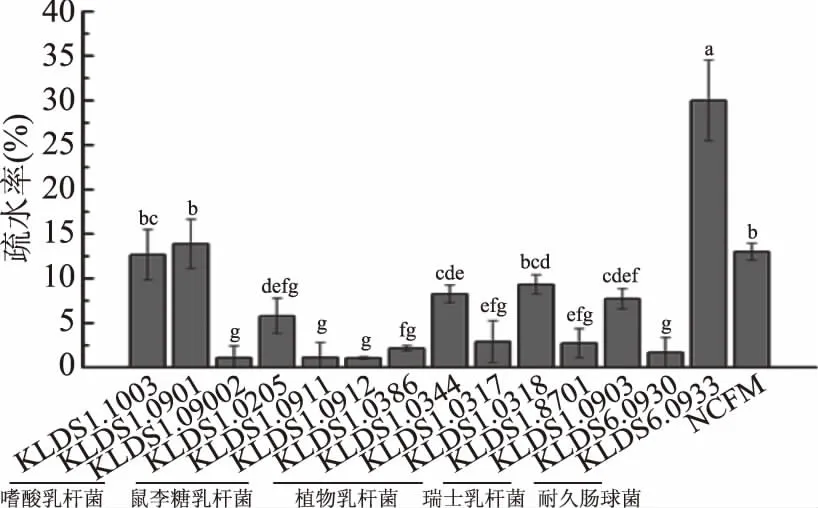
圖1 15株乳酸菌的表面疏水性Fig.1 Cell surface hydrophobicity of 15 strains of lactic acid bacterias注:小寫字母不同表示差異顯著(p<0.05);圖2、圖3、圖7同。
2.2 乳酸菌的自凝聚能力
菌株的自凝聚能力結(jié)果見圖2。對于相同菌種,不同菌株間的自凝聚能力沒有相似性。15株乳酸菌均具有自凝聚能力,但部分菌株之間的自凝聚能力差異顯著(p<0.05)。植物乳桿菌KLDS1.0386、KLDS1.0317以及耐久腸球菌KLDS6.0933自凝聚能力最強,分別為87.25%、87.98%和88.07%,顯著高于其他菌株(p<0.05)。自凝聚集能力最差的是瑞士乳桿菌KLDS1.0903,凝集率僅為51.28%。
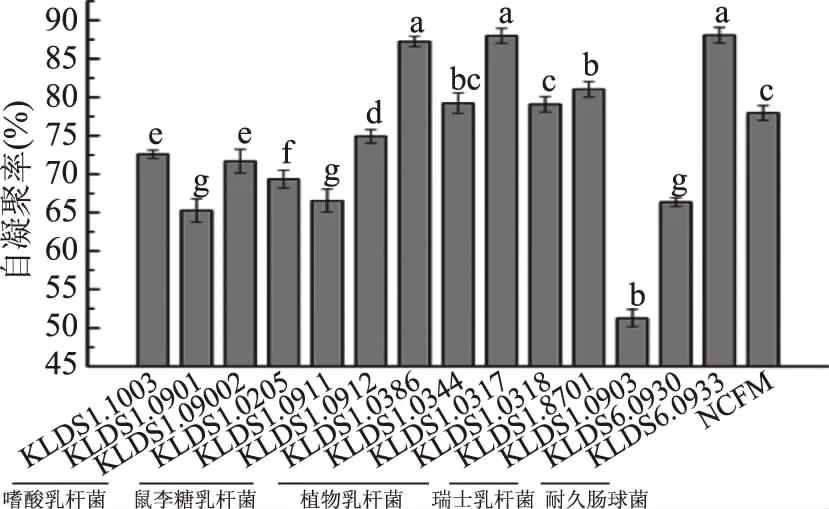
圖2 15株乳酸菌的自凝聚能力Fig.2 Auto-agglutination ability of 15 lactic acid bacterias
2.3 乳酸菌對Caco-2細胞黏附能力分析
乳酸菌與Caco-2細胞共培養(yǎng)2 h后,去除未黏附的乳酸菌,將黏附的乳酸菌按倍數(shù)稀釋后,涂布在乳酸菌相對應的固體培養(yǎng)基培養(yǎng)計數(shù),實驗結(jié)果見圖3。15株乳酸菌的黏附率從0.13%~12.73%不等。嗜酸乳桿菌NCFM對Caco-2細胞的黏附率為11.23%。嗜酸乳桿菌KLDS1.0901和植物乳桿菌KLDS1.0318的黏附性分別為12.73%和12.695%,略高于嗜酸乳桿菌NCFM,并顯著高于其他受試菌株(p<0.05)。耐久腸球菌KLDS6.0930和植物乳桿菌KLDS1.0903次之,分別為9.13%和8.50%。三株受試的鼠李糖乳桿菌黏附能力均非常低,都不足2%。

圖3 15株乳酸菌對Caco-2細胞的黏附分析Fig.3 Adhesion capacity to Caco-2 of 15 lactic acid bacterias
2.4 乳酸菌對Caco-2黏附觀察
結(jié)合2.3中的結(jié)果,選取黏附性良好的嗜酸乳桿菌KLDS1.0901、植物乳桿菌KLDS1.0318和嗜酸乳桿菌NCFM,以及黏附性差的鼠李糖乳桿菌KLDS1.0205與分化完成的單層Caco-2細胞共同孵育2 h后,進行革蘭氏染色,用顯微鏡觀察黏附情況。如下圖4所示,可以直觀的看出KLDS1.0901、KLDS1.0318和NCFM密集的圍繞在Caco-2細胞的周圍,而黏附的KLDS1.0205的數(shù)量明顯變少。這與2.3中的結(jié)果相符。
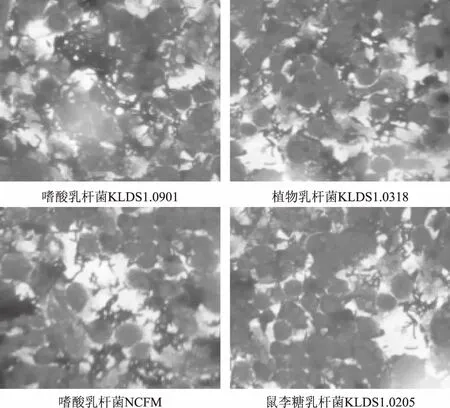
圖4 乳酸菌黏附Caco-2細胞的顯微鏡照片(1000×)Fig.4 Microscopic photograph of lactic acid bacteria adhering to Caco-2 cells(1000×)
2.5 乳酸菌的熒光標記
如下圖5所示,cFDA-SE熒光染料對嗜酸乳桿菌KLDS1.0901標記率高達99.8%,可用于后續(xù)的實驗。
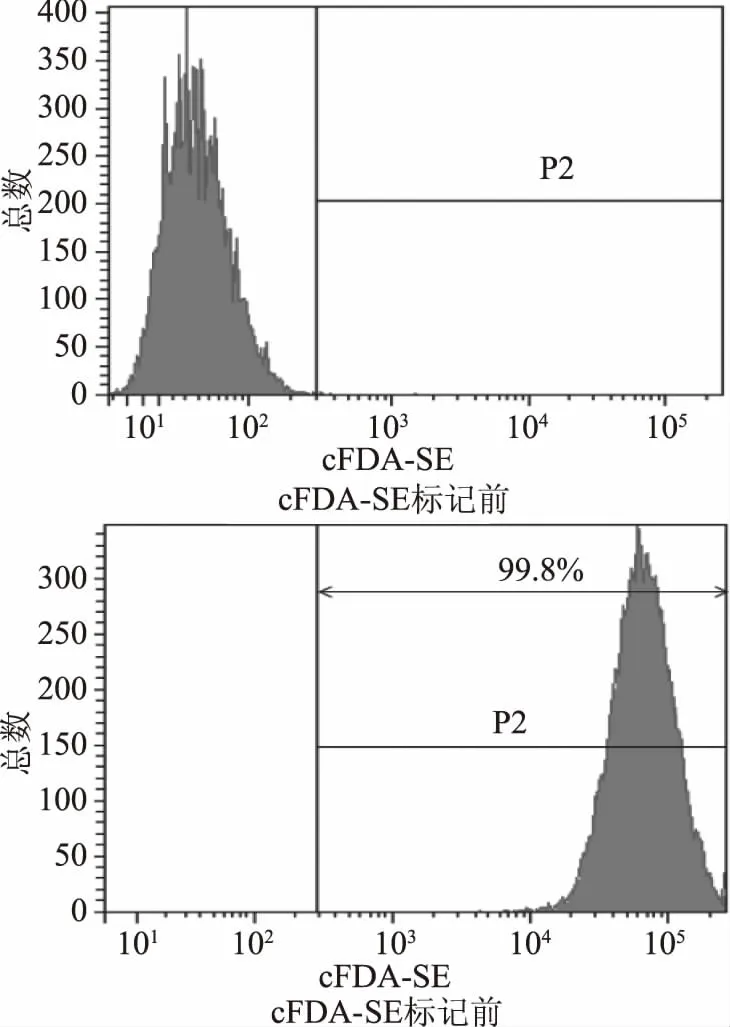
圖5 cFDA-SE對KLDS1.0901的熒光標記率Fig.5 Fluorescent labeling of KLDS1.0901 cells using cFDA-SE
2.6 化學和酶處理對黏附的影響
化學和酶處理對KLDS1.0901黏附能力影響如圖6所示。KLDS1.0901對高碘酸鈉、苯酚、氯化鋰、熱處理均具有敏感性,KLDS1.0901經(jīng)這些物質(zhì)處理后黏附率顯著降低(p<0.05)。相比于空白對照組(18.95%),KLDS1.0901經(jīng)過氯化鋰處理后,黏附率降到8.59%。說明菌體細胞表層蛋白可能是影響其黏附Caco-2細胞的主要黏附素。與空白組相比,胰蛋白酶和胃蛋白酶處理也能降低KDS1.0901的黏附率(p<0.05),但二者之間的差異不顯著(p>0.05)。所以KLDS1.0901黏附Caco-2細胞可能是以表層蛋白為主的多種黏附素共同作用的結(jié)果。

圖6 化學和酶處理對KLDS1.0901黏附能力的影響Fig.6 Effects of chemical and enzymatic treatments on adhesion of KLDS1.0901 to Caco-2 cells注:1:空白對照;2:高碘酸鈉;3:苯酚;4:氯化鋰;5:胃蛋白酶;6:胰蛋白酶;7:熱處理。
3 討論
乳酸菌可通過抑制病原體的侵襲,改善腸道上皮屏障功能,調(diào)節(jié)宿主免疫系統(tǒng)等來發(fā)揮有益作用。而乳酸菌在胃腸道中的黏附和定植是其在人體內(nèi)表現(xiàn)益生功效的先決條件[19]。對乳酸菌菌株的自凝聚能力、疏水性和對腸上皮細胞系(Caco-2和HT-29細胞)的黏附能力的評估,已經(jīng)被作為篩選具有益生菌潛力的菌株的體外方法。在研究乳酸菌與腸道黏附的過程中,常使用Caco-2和HT-29細胞模型進行體外實驗[20],但是這些方法耗時長且昂貴。大量的研究結(jié)果表明,細菌的黏附能力與菌體表面性質(zhì)存在較大的相關性[21-22]。近幾年,自凝聚集能力和疏水性被廣泛地用于評價細菌黏附性。李清等[23]]測定10株不同來源的植物乳桿菌的表面疏水性以及體外黏附Caco-2細胞的能力,發(fā)現(xiàn)對細胞的黏附能力與表面疏水性存在著顯著的相關性。然而,也有研究發(fā)現(xiàn),認為兩者之間沒有相關性[24]。
因此本實驗采用表面性質(zhì)檢測和體外細胞培養(yǎng)相結(jié)合的方法,測定了15株乳酸菌的表面疏水性和自凝聚能力,并采用平板計數(shù)和顯微鏡觀察的方法研究乳酸菌對Caco-2細胞黏附狀態(tài)和數(shù)量的差異。結(jié)果表明15株乳酸菌的疏水性和自凝聚能力與其黏附性并沒有對應關系,疏水性和自凝聚能力高的菌株,其黏附能力并不一定高,如耐久腸球菌KLDS6.0933的疏水性高達30%,其黏附能力卻很低。但是嗜酸乳桿菌KLDS1.0901的疏水性僅為13.88%,其黏附性能卻是受試菌株中最高的。這與Tuo等[7]的研究結(jié)果相似。并且嗜酸乳桿菌KLDS1.0901和植物乳桿菌KLDS1.8701的黏附能力略高于商業(yè)嗜酸乳桿菌NCFM的黏附能力,具有益生菌的潛力,可做進一步的深入研究。15株乳酸菌對細胞的黏附能力不僅存在菌種差異性,也存在菌株差異性。Murphy[25]研究結(jié)果也證實了不同菌種之間的黏附性差異很大,即使菌種相同,在菌株水平上,黏附能力也具有差異性。由此可見,黏附能力與乳酸菌的自身性質(zhì)存在著必然聯(lián)系。
乳酸菌在腸道中定植的前提是其必須黏附于宿主細胞表面。黏附不僅涉及與表面性質(zhì)有關的非特異性黏附,還包括與黏附素有關的特異性黏附[26]。目前已發(fā)現(xiàn)的黏附素包括脂磷壁酸、表層蛋白、菌毛、肽聚糖以及脂多糖等。這些黏附素可以與腸道細胞表面的受體進行特異性結(jié)合。對乳酸菌黏附素進行研究有利于闡述乳酸菌的黏附機制。化學或酶處理被普遍地用于研究乳酸菌的黏附素[27]。本實驗中高碘酸鈉處理可以顯著的降低KLDS1.0901的黏附性,說明一些糖類物質(zhì)參與了黏附過程。苯酚處理可以破壞細胞表面的脂磷壁酸和非纖維狀蛋白,所以脂磷壁酸和蛋白均有可能參與到KLDS1.0901對Caco-2細胞的黏附中。氯化鋰處理可顯著降低黏附率,表明以非共價結(jié)合的方式存在于細胞表面的表層蛋白,可能是影響?zhàn)じ叫Ч闹饕じ剿亍N傅鞍酌负鸵鹊鞍酌柑幚黼m然也能降低黏附率,但二者的作用效果并無顯著差異,說明KLDS1.0901的黏附素對二者的敏感度相似。熱處理可強烈破壞細胞壁的完整結(jié)構,說明細胞表面的黏附素對熱敏感或者熱處理可以使其從細胞表面脫落,導致了KLDS1.0901黏附能力極低。綜合以上分析,表明KLDS1.0901對Caco-2細胞的黏附可能是多種黏附素共同作用的結(jié)果[29]。
以后的研究將進一步確定與黏附有關的物質(zhì)及黏附機制。此外,具有高黏附能力的乳酸菌有利于調(diào)節(jié)腸道微生態(tài)環(huán)境以及啟動免疫應答,為功能性食品的開發(fā)提供可能。實驗結(jié)果表明,嗜酸乳桿菌KLDS1.0901和植物乳桿菌KLDS1.8701具有良好的黏附能力,其表面黏附物質(zhì)的屬性及在黏附中發(fā)揮作用的具體機制有待進一步研究。
4 結(jié)論
本研究表明嗜酸乳桿菌KLDS1.0901和植物乳桿菌KLDS1.8701的黏附能力略高于商業(yè)嗜酸乳桿菌NCFM的黏附能力,具有益生菌的潛力,可進一步深入研究其黏附于腸道后對宿主產(chǎn)生的益生效應。化學和酶處理KLDS1.0901,尤其是氯化鋰和熱處理能顯著降低KLDS1.0901的黏附性,表明以表層蛋白為主的多種黏附素可能參與了KLDS1.0901對Caco-2細胞的黏附。實驗表明嗜酸乳桿菌KLDS1.0901是1株具有良好黏附能力的益生菌,且可能含有豐富的表層蛋白,其黏附的其他性質(zhì)和詳細的黏附作用機制有待今后進一步研究。

