環境脅迫下食竇魏斯氏菌的耐受性評價
,,, ,
(重慶第二師范學院重慶市功能性食品協同創新中心,重慶市功能性食品工程技術研究中心,功能性食品研發重慶市工程實驗室,生物與化學工程學院,重慶 400067)
食竇魏斯氏菌(Weissellacibaria)是魏斯氏菌屬(Weissella)的一個種,呈革蘭氏陽性、過氧化氫酶陰性,屬于乳酸菌屬的一個分支。目前,GeneBank數據庫中魏斯氏菌屬已命名的種有19個,其分布極為廣泛,從新鮮蔬菜、泡菜、小麥酸面團、胡蘿卜汁肉制品、胃腸道和口腔中均可獲得[1-4]。此外,研究發現魏斯氏菌及其代謝產物在食品、醫藥等諸多行業中具有潛在應用價值。Li等[5]從泰國發酵魚產品中分離出的Weissellacibaria110產生的weissellicin 110細菌素,可作為肉制品及乳制品的防腐劑;Lee等[6]以前期從人體糞便中分離出的3株融合魏斯氏菌(Weissellaconfusa)和5株食竇魏斯氏菌為研究對象,評價實驗菌株的潛在益生特性,結果表明融合魏斯氏菌和食竇魏斯氏菌對pH3.0和0.3%膽鹽具有一定的耐受性,且對Coca-2細胞的粘附能力較好,均高于LactobacillusrhamnosusGG對Coca-2細胞的粘附能力。在致病性Escherichiacoli誘導的腹瀉小鼠中,Jurnalis等[7]研究表明,灌胃Weisellaparamesenteroides能夠有效減少腹瀉小鼠的腹瀉頻率、降低腹瀉小鼠糞便中TNF-α的水平、增加腹瀉小鼠腸道中的乳酸菌數量和減少其厭氧細菌與大腸桿菌的數量。Lim等[8]研究WeissellacibariaWIKIM28改善2,4-二硝基氯誘導的過敏性皮炎,結果表明,灌胃WeissellacibariaWIKIM28不僅可以減少過敏性皮炎皮膚損傷、表皮增厚和血清免疫球蛋白E水平,還能減少外周淋巴結細胞Th2細胞因子IL-4、IL-5和 IL-13的水平;此外,灌胃WeissellacibariaWIKIM28還能促進腸系膜淋巴結中CD4+CD25+Foxp3+調節T細胞的分化和增強IL-10的分泌,對小鼠過敏性皮炎具有較好的預防作用,對預防人類過敏性皮炎具有潛在的應用價值。
益生菌是指攝入一定量后對機體具有益生作用的一類活性微生物,然而,由于益生菌在貯藏、運輸、制劑化或工業化生產中常受到多種環境因素的影響,使其活性減弱或生理特性受到影響;加之菌體進入機體內會受到胃腸道中的胃酸與膽鹽的影響,因此并不是所有的微生物都可作為益生菌[9]。在益生菌的篩選中通常需要通過一定的評價標準進行篩選。首先,微生物進入機體內會受到胃腸道低酸和膽鹽的作用,導致其活性受到抑制或殺死,影響其益生作用的發揮[10-11]。因此,微生物對低酸環境和膽鹽的耐受能力常作為篩選益生菌的重要指標。其次,在益生菌的功能及其性質研究中,菌株在腸道內的定植能力、對致病菌的抑制作用、對抗生素的耐受性,以及對溫度和滲透壓的耐受力也常作為篩選的指標。Ojekunle等[12]通過體外實驗結果表明,WeissellacibariaWD2在模擬人工胃液中具有較高的存活率,并對低酸和膽鹽具有很好的耐受性;Elavarasi等[13]在評價乳酸菌的潛在益生特性中發現,分離自山羊奶的Weissellacibaria(KTSMBNL 28)的抗菌活性較好,能夠有效的抑制腸道致病菌的活性,且對人工胃液、膽鹽、青霉素、萬古霉素和萘啶酸具有一定的耐受性,溶血實驗結果也表明,該菌株具有非溶血性,從而確保其運用的安全性。此外,Lee等[16]在研究人體糞便中8株魏斯氏菌的益生特性中發現,7株魏斯氏菌在15和45 ℃下均能很好的生長,所有菌株在含有6.5% NaCl的MRS中也能夠很好生長。
本研究以新鮮竹筍表面分離到的16株食竇魏斯氏菌為對象,研究低酸環境、人工胃液、膽鹽、溫度和NaCl脅迫下食竇魏斯氏菌的生長情況,初步評價出具有良好耐受性的食竇魏斯氏菌,為進一步研究食竇魏斯氏菌的益生功能及應用提供理論依據。
1 材料與方法
1.1 材料與儀器
16株食竇魏斯氏菌(HSG 01~HSG 16) 分離自重慶市萬盛區黑山谷新鮮竹筍的表面,保藏于重慶市功能性食品協同創新中心;MRS肉湯 生化試劑,美國BD公司;瓊脂、膽鹽、胃蛋白酶 生化試劑,北京索萊寶生物科技有限公司;硫代乙醇酸鈉 生化試劑,山東西亞化學工業有限公司;氯化鈉、鹽酸 生化試劑,成都市科龍化工試劑廠;D2000 DNA Marker、2×Taq PCR MasterMix、細菌基因組DNA提取試劑盒(DP302) 天根生化科技(北京)有限公司。引物27F(5′-AGAG TTTGATCCTGGCTCA-3′)、1495R(5′-CTACGGC TACCTTGTTACGA-3′) 由生工生物工程(上海)股份有限公司合成。
SW-CJ-2F潔凈工作臺 蘇州安泰空氣技術有限公司;BY-G20醫用離心機 北京北洋醫療器械有限公司;SY-2230恒溫水浴搖床 美國精驥有限公司;MSC-100恒溫振蕩器 杭州奧盛儀器有限公司;OLYMPUS-BX43生物顯微鏡 日本奧林巴斯公司;LDZM-80KCS-Ⅱ立式壓力蒸汽滅菌鍋 上海申安;A200梯度PCR儀 杭州朗基科學儀器有限公司;Tanon-2500全自動數碼凝膠圖像分析系統 上海天能公司;BIOMA TE 35紫外可見分光光度計 賽默飛世爾科技有限公司。
1.2 實驗方法
1.2.1 菌株的活化與鏡檢 將保藏于20%甘油中的16株實驗菌株從-20 ℃冰箱中取出,室溫放置解凍后,分別取100 μL接種于5 mL MRS液體培養基中,水浴恒溫振蕩器37 ℃、100 r/min培養24 h,如此連續活化2代后。取菌液1 mL于4000 r/min 離心10 min,用接種環挑取少量沉淀均勻的涂于載玻片上,經革蘭氏染色[14]、鏡檢后,確定菌株是否為純種,備用。
1.2.2 菌株的種屬分析 細菌基因組DNA(模板)的提取按照試劑盒說明書方法進行。
PCR反應體系為25 μL:模板1 μL,引物27F、1495R各1 μL,2×Taq PCR MasterMix 12.5 μL,加無菌超純水補足至25 μL。PCR反應條件:94 ℃ 5 min;94 ℃ 40 s,55 ℃ 40 s,72 ℃ 1 min,共30個循環;72 ℃ 10 min[15]。反應結束后,取5 μL PCR產物用1.5% 瓊脂糖凝膠電泳進行檢測,檢測合格樣品送成都擎科梓熙生物技術有限公司測序,測序所得序列通過NCBI中的BLAST程序進行同源性比對分析。
從GeneBank中調取魏斯氏菌屬的6個種的序列作為參考序列,用MEGA 5.0軟件中的Alignment程序進行多序列匹配比對,并采用Kimura 2-parameter模式計算遺傳距離,Neighbor-Joining構建實驗菌株的16S rDNA序列的系統發育樹,Bootstrap為1000[16-18]。
1.2.3 菌懸液的制備 實驗菌株37 ℃、100 r/min培養18 h后,取10 mL培養液于4 ℃、4000 r/min離心10 min,收集菌體沉淀,用無菌生理鹽水洗滌2次,并調節其OD600 nm為1.0,備用[19]。
1.2.4 酸脅迫下生長效率的測定 取菌懸液按2%接種量加入pH4.0的MRS肉湯中(1 mol/L HCl調節pH)[20],實驗中以2%接種但未調節pH的MRS肉湯作對照,未接種且未調節pH的MRS肉湯作空白。37 ℃、100 r/min培養24 h后,測定培養液的OD600 nm值,按公式(1)計算實驗菌株酸脅迫下的生長效率。
生長效率(%)=(不同pH培養液的OD600 nm-空白OD600 nm)/(對照OD600 nm-空白OD600 nm)×100
式(1)
1.2.5 溫度脅迫下生長效率的測定 取菌懸液按2%接種量(v/v)加入MRS肉湯中(不調節pH,約為6.2),分別于4、15、37、45 ℃下,100 r/min培養24 h,并測定相應MRS肉湯的OD600 nm值。實驗中以37 ℃下MRS肉湯作對照,以未接種的MRS肉湯作空白[21]。按公式(2)計算實驗菌株對溫度脅迫下的生長效率。
生長效率(%)=(不同溫度下培養液的OD600 nm-空白OD600 nm)/(37 ℃下培養液的OD600 nm-空白OD600 nm)×100
式(2)
1.2.6 NaCl脅迫下生長效率的測定 取菌懸液按2%接種量(v/v)加入含4%、6%和8% NaCl的MRS培養基中,以接種但不含NaCl的MRS培養基作對照,以未接種且不含NaCl的MRS培養基作空白[21]。37 ℃、100 r/min培養24 h后,測定培養液的OD600nm值,按公式(3)計算實驗菌株鹽脅迫下的生長效率。
生長效率(%)=(不同NaCl濃度下培養液的OD600 nm-空白OD600 nm)/(不含NaCl培養液的OD600 nm-空白OD600 nm)×100
式(3)
1.2.7 人工胃液脅迫下存活率的測定 基于酸脅迫實驗,同時參考溫度和滲透壓脅迫實驗的結果,選出具有良好耐受力的菌株進行實驗。取菌懸液1 mL與9 mL pH3.0人工胃液混勻,于37 ℃、100 r/min培養3 h,并采用平板計數分別記錄處理人工胃液處理0、3 h的活菌數[22],按公式(4)計算實驗菌株在pH3.0人工胃液中的存活率。

式(4)
1.2.8 膽鹽脅迫下生長效率的測定 基于酸脅迫實驗,同時參考溫度和滲透壓脅迫實驗的結果,選出具有良好耐受力的菌株進行實驗。取菌懸液按2%接種量分別加入含0.1%、0.2%和0.3%膽鹽的MRS-THIO培養基(指含有0.2%巰基乙酸鈉的MRS肉湯)中,實驗中以2%接種但不含膽鹽的MRS-THIO培養基作對照,以不接種且不含膽鹽的MRS-THIO培養基作空白[23]。37 ℃、100 r/min培養24 h后,測定培養液的OD600nm值,按公式(5)計算實驗菌株在不同膽鹽濃度脅迫下的生長效率。
生長效率(%)=(不同膽鹽濃度下培養液的OD600 nm-空白OD600 nm)/(對照OD600 nm-空白OD600 nm)×100
式(5)
1.3 數據處理
2 結果與分析
2.1 活化菌株鏡檢結果
實驗菌株活化后在MRS平板上的菌落形態均一,菌落邊緣整齊,中間凸起,表面光滑,呈黃色不透明狀(圖1a)。經革蘭氏染色后,菌株細胞呈藍紫色,為革蘭氏陽性。此結果表明菌株仍為純種,可用于后續實驗(圖1b)。
圖1 菌株HSG 02菌落形態(a)及革蘭氏染色結果(b)(1000×)Fig.1 Colonial morphology(a)and gram staining results(b)of HSG 02(1000×)
2.2 菌株16S rDNA序列分析
圖2為實驗部分菌株16S rDNA序列經PCR擴增后的瓊脂糖凝膠電泳檢測結果,由圖可知,擴增條帶的位置介于1000~2000 bp,與預計目的條帶位置(1500 bp)相符;此外,PCR 擴增后的條帶清晰明亮,無拖尾,且陰性對照無條帶,說明 PCR擴增成功,擴增產物可用于后期測序。
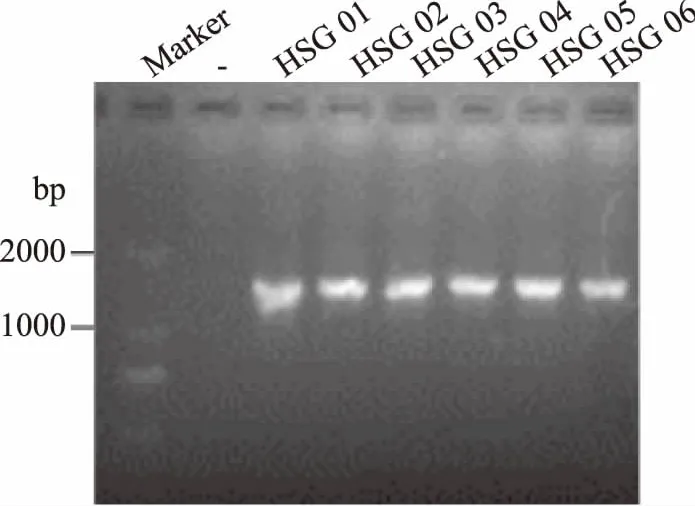
圖2 部分菌株16S rDNA序列的PCR擴增結果Fig.2 PCR amplification results of parts strains 16S rDNA sequences
擴增產物經測序檢測后,將所得序列基于NCBI中的BLAST程序進行同源性比對分析,結果表明16株菌株均為食竇魏斯氏菌(Weissellacibaria)。
2.3 系統發育樹分析
系統發育樹中,各分支下的菌株親緣關系近,差異小;各分支長度的差異代表進化程度的高低。如圖3可知,實驗菌株均與食竇魏斯氏菌以99%的自舉支持率聚在一起,此結果與16S rDNA序列分析結果相一致。此外,與選取的參考菌株相比,食竇魏斯氏菌與融合魏斯氏菌的親緣關系較近;而其它4種魏斯氏菌則單獨聚在另一分支,與食竇魏斯氏菌的親緣關系較遠。

圖3 實驗菌株16S rDNA序列的系統發育樹Fig.3 Phylogenetic tree based on the selected strains 16S rDNA sequences
2.4 酸脅迫下的生長效率
益生菌具有一定耐酸能力是其進入腸道發揮益生作用的前提。實驗中基于pH4.0 MRS肉湯初步篩選具有耐受低酸環境的食竇魏斯氏菌。由圖4可知,各實驗菌株對低酸環境的耐受性明顯不同,其中HSG 04和HSG 07在酸脅迫下的生長效率較低,分別為15.37%和17.21%,說明其對低酸環境的耐受性較差;而HSG 08和HSG 09均具有較高的生長效率,分別為82.77% 和71.68%,說明二者對低酸環境的耐受性較好。目前,對實驗菌株耐受酸性環境的機制尚不明確,主要的可能機制包括質子泵機制、大分子保護和修復、堿生成、細胞密度及生物膜等[24]。如Lorca等[25]研究表明,L.acidophilusCRL639酸脅迫耐受的主要機制是膜F0F1-ATPase的作用,并不依賴于合成新的蛋白質(F0F1-ATPase,又稱H+-ATP酶或質子移位膜ATP酶,是一種多亞基酶);而De等[26]在研究L.sanfranciscensisCB1的酸脅迫反應中發現,相對于未進行酸脅迫處理的菌株,酸耐受菌株中有15種蛋白質合成增加。此外,相關研究結果也表明,精氨酸脫亞氨基酶途徑在很多乳酸菌的酸耐受性中發揮重要作用,其原因在于精氨酸通過一系列反應后被分解為NH3,從而降低環境中的pH,從而起到保護菌體的作用,如菌株LactococcuslactisMG1363[27]。
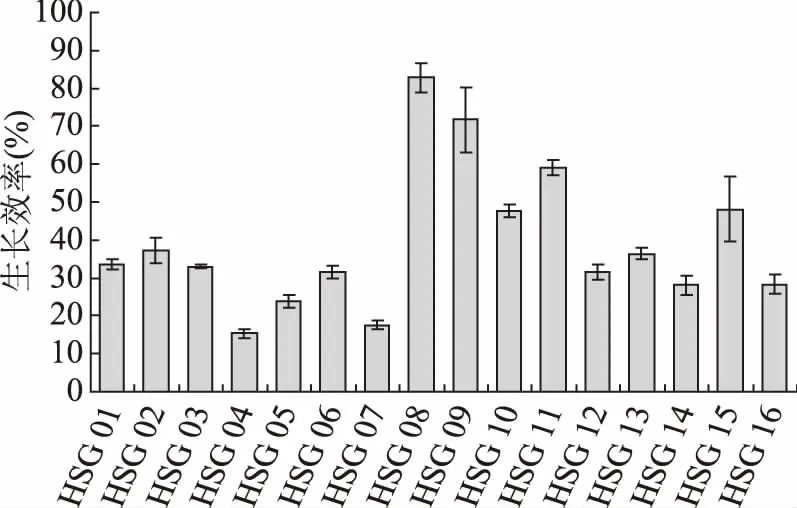
圖4 酸脅迫下菌株的生長效率Fig.4 Growth efficiency of the selected strains under acid stress
2.5 溫度脅迫下的生長效率
微生物的生長與其環境溫度密切相關,通常乳酸菌在37 ℃時,生長狀況較好,但是高于或低于此溫度均對其生長不利。尤其在運輸、儲藏或制劑化的過程中受到的溫度脅迫嚴重影響了菌體的結構、活性及其產量,使益生菌的應用受到限制[28-29]。因此,本實驗通過設定不同溫度來研究食竇魏斯氏菌在不同溫度脅迫下的生長狀況。由圖5可知,與培養溫度為37 ℃時的生長效率相比,4 ℃時各菌株的生長效率均較低,說明各菌株在4 ℃時,其生長效率均能得到很好的抑制;當培養溫度升至15 ℃時,各菌株生長效率較4 ℃時的生長效率出現不同程度的升高,但HSG 01、HSG 02、HSG 08、HSG 09、HSG 10、HSG 11、HSG 13和HSG 16的生長效率明顯低于自身菌株37 ℃時的生長效率;當培養溫度升至45 ℃時,部分菌株的生長效率較37 ℃時的生長效率低,而HSG 02、HSG 06、HSG 08、HSG 09、HSG 10、HSG 11、HSG 13和HSG 16的生長效率均高于37 ℃時的生長效率,說明這些菌株對高溫具有一定程度的耐受力。綜上所述,菌體對不同溫度脅迫時的應激反應存在明顯差異,受到溫度脅迫時,菌體適應環境溫度變化的能力也各不相同。研究發現,菌株對高溫脅迫或冷脅迫耐受力的不同與菌體自身分子伴侶的活性、細胞膜的流動性及核糖體和RNA的穩定性密切相關。高溫脅迫下產生的相關伴侶蛋白或蛋白酶可作用于損傷的蛋白質,從而提高菌體自身耐受高溫的能力,而在冷脅迫中產生的相關蛋白(冷誘導蛋白)則可改變菌體自身細胞膜的流動性,DNA的超螺旋、轉錄和翻譯,從而影響菌體的耐受力,改變程度的差異則導致最終耐受力的不同。因此,通過對菌株不同溫度脅迫下生長效率的評價,可為后期生產中篩選具有耐受冷熱環境變化的菌株提供理論依據[30-31]。

圖5 溫度脅迫下菌株的生長效率Fig.5 Growth efficiency of the selected strains under temperature stress
2.6 NaCl脅迫下的生長效率
益生菌在工業應用中的滲透壓脅迫主要以鹽脅迫為主,然而食品中添加適量的鹽雖然可以降低食品的水分活度,起到預防食品腐敗變質,延長其保質期的目的,同時也會造成滲透壓的改變,而滲透壓的改變能夠導致菌體細胞體積變化和胞內代謝發生紊亂,嚴重則導致細胞死亡[32]。因此,篩選具有耐受高滲環境的菌株對其后期功能性質的發揮具有重要意義。由圖6可知,在不同濃度NaCl下,實驗菌株間的生長效率明顯不同;隨著鹽濃度的增加,菌株的生長效率均呈下降趨勢。其中,HSG10對鹽的耐受性最佳,在8%鹽濃度下仍能保持較高的生長效率(87.18%);而HSG03、HSG06和HSG07在4% NaCl脅迫時,其生長效率相對較低,分別為61.20%、57.00%和59.46%,表明其對鹽脅迫的耐受性差。研究表明,各菌株對NaCl脅迫表現出不同的耐受力,與誘導抗滲透蛋白的表達和積累可混溶溶質(K+、谷氨酸、脯氨酸、甘氨酸和甜菜堿)等物質有關。這些物質可以防止由于外部高滲透壓而引起的細胞內水分的損失,確保細胞內外的溶脹平衡,且不會干擾細胞的生理過程[33]。因此,篩選具有耐受一定濃度NaCl脅迫的菌株,為后期具有良好益生特性菌株的研究與應用具有重要意義。

圖6 鹽脅迫下菌株的生長效率Fig.6 Growth efficiency of the selected strains under salt stress
2.7 人工胃液中的存活率
人體胃液的pH約為3,當機體空腹或攝入酸性食物時,其pH會有所下降;而當攝入堿性食物時,pH會有所上升;此外,食物在胃中的消化時間通常為1~3 h[34]。因此,在益生菌篩選實驗中,通常用pH3.0人工胃液處理菌株3 h來模擬體內胃液消化情況,從而篩選出具有良好耐受胃酸消化能力的菌株。本實驗基于酸脅迫、滲透壓脅迫和溫度脅迫實驗結果,選取生長效率相對較高的5株食竇魏斯氏菌(HSG 08、HSG 09、HSG 10、HSG 11、HSG 15)進行人工胃液實驗,實驗結果如圖7。 由圖可知,5株食竇魏斯氏菌經人工胃液處理后,其存活率均不同,存活率由高到低依次為HSG 08>HSG 09>HSG 11>HSG 15>HSG 10,HSG 08的存活率最高為70.55%,而HSG 10的存活率最低為18.80%。人工胃液處理即模擬人體胃腸道低酸環境篩選菌株,人工胃液中存活率的不同與菌體自身耐受低酸環境能力的差異密切相關,其主要的可能機制也包括質子泵機制、大分子保護和修復、堿生成、細胞密度及生物膜等[24]。

圖7 人工胃液中菌株的存活率Fig.7 Survival rates of the selected stains in simulated gastric fluid
2.8 膽鹽脅迫下的生長效率
人體腸道中的膽鹽濃度介于0.03%~0.3%之間動態波動,研究表明,腸道中的膽鹽對益生菌的生長具有抑制或殺死作用[24]。因此,評價菌株對膽鹽的耐受能力也是篩選益生菌的重要指標。本實驗基于酸脅迫、滲透壓脅迫和溫度脅迫實驗選取的5株食竇魏斯氏菌(HSG 08、HSG 09、HSG 10、HSG 11、HSG 15)進行膽鹽脅迫實驗,實驗結果如圖8所示。5株食竇魏斯氏菌經不同濃度膽鹽處理后,其生長效率各不相同。在0.1%膽鹽脅迫下,5株食竇魏斯氏菌的生長效率均較高,其生長效率由高到低依次為HSG 08>HSG 09>HSG 11>HSG 15>HSG 10,其中HSG 08的生長效率最高為72.06%,隨著膽鹽濃度的增加,5株食竇魏斯氏菌的生長效率均明顯下降。研究表明,高濃度膽鹽脅迫會導致菌株細胞膜通透性發生改變、膜內蛋白發生解離,從而使細胞內物質流出,最終導致細胞死亡[35]。

圖8 膽鹽中菌株的生長效率Fig.8 Growth efficiency of the selected strains in bile salt
3 結論
食竇魏斯氏菌由于其對機體健康的多種益生作用及其在發酵食品的風味形成及發酵進程中的重要作用而受到廣泛關注。本實驗通過酸、溫度和NaCl脅迫實驗研究16株食竇魏斯氏菌在不同脅迫下的生長效率,結果表明HSG 08、HSG 09、HSG 10、HSG 11和HSG 15在酸脅迫下的生長效率均高于45%,其中HSG 10的生長效率最低為47.61%,HSG 08的生長效率最高為82.77%。在45 ℃溫度脅迫下,HSG 02、HSG 06、HSG 08、HSG 09、HSG 10、HSG 11、HSG 13和HSG 16的生長效率均高于37 ℃下的生長效率,說明這8菌株均具有一定耐受高溫的能力,而在15 ℃下,HSG 01、HSG 02、HSG 08、HSG 09、HSG 10、HSG 11、HSG 13和HSG 16的生長效率明顯降低,說明這8株菌在15 ℃下其活性在一定程度上得到有效的抑制。NaCl脅迫實驗結果表明,隨著其濃度的增加,各菌株的耐受性均逐漸減弱;在4% NaCl脅迫下,HSG 06的生長效率最低為57.00%,而HSG 01、HSG 02、HSG 08、HSG 10、HSG 12、HSG 13、HSG 14、HSG 15和HSG 16的生長效率均高于80%,其中HSG 15的生長效率最高達93.91%。人工胃液和膽鹽耐受力實驗結果表明,HSG 08經人工胃液處理后,其存活率最高為70.55%,而HSG 10的存活率最低為18.80%;而膽鹽實驗結果表明,隨著膽鹽濃度的增加,實驗菌株的生長效率明顯降低,在0.1%膽鹽下,HSG 08的生長效率最高為72.06%,HSG 10的生長效率最小為56.57%。綜上所述,HSG 08對不同環境脅迫均表現出很好的耐受力,因此可用于下一步益生特性菌株的研究。

