2型糖尿病血糖波動(dòng)水平與脂蛋白a和血尿酸的關(guān)系
邢春燕, 姚新明, 高家林, 翟清, 孟祥健
(皖南醫(yī)學(xué)院弋磯山醫(yī)院內(nèi)分泌科, 安徽 蕪湖 241001)
近年來,隨著人口老齡化加劇,糖尿病發(fā)病率逐年上升,我國(guó)糖尿病的發(fā)病人數(shù)已位居全球首位[1];隨之而來的是糖尿病腎病的發(fā)病率迅速增長(zhǎng),20%~40%的糖尿病患者發(fā)展為糖尿病腎病[2]。糖尿病腎病患者早期表現(xiàn)為腎臟增大、腎小球?yàn)V過功能亢進(jìn)、微量蛋白尿,但不易被察覺,容易漏診。隨著病情進(jìn)展,患者腎小球?yàn)V過率持續(xù)下降,最終發(fā)展成為尿毒癥,甚至引起死亡。即使部分患者可通過控制血脂、血糖、血壓,實(shí)現(xiàn)控制腎臟血供、減少微量蛋白尿或達(dá)到蛋白轉(zhuǎn)陰目的,但對(duì)于進(jìn)展至臨床蛋白尿階段的患者,病變逆轉(zhuǎn)幾無可能[3]。研究顯示,慢性持續(xù)性高血糖和慢性波動(dòng)性高血糖是導(dǎo)致糖尿病慢性血管并發(fā)癥的主要因素;且波動(dòng)性高血糖在慢性血管并發(fā)癥發(fā)生和發(fā)展過程中的作用更大[3]。因此,嚴(yán)格控制血糖對(duì)糖尿病腎病防治及控制具有重要意義。糖尿病腎病患者的脂代謝異常,脂蛋白a顯著升高,會(huì)進(jìn)一步加重腎功能損害;血尿酸作為糖尿病腎病的獨(dú)立危險(xiǎn)因素,較白蛋白能更好地預(yù)測(cè)腎臟損害。因此,本研究應(yīng)用動(dòng)態(tài)血糖監(jiān)測(cè)系統(tǒng)評(píng)估血糖波動(dòng),探討血糖波動(dòng)與脂蛋白a和血尿酸的關(guān)系,以期為糖尿病腎病的防治提供參考。
1 對(duì)象與方法
1.1 臨床資料
選取2016年1月至2017年12月間在我院住院的2型糖尿病伴蛋白尿[尿微量白蛋白(U-mALB)≥25 mg/L]患者50例作為觀察組,另選取U-mALB<25 mg/L的2型糖尿病患者50例作為對(duì)照組。排除標(biāo)準(zhǔn):其他任何原因引起的蛋白尿;無發(fā)熱、創(chuàng)傷、手術(shù)等應(yīng)激情況;無急性心腦血管疾患、酮癥酸中毒等。兩組患者性別比例、年齡間差異均無統(tǒng)計(jì)學(xué)意義(均P>0.05)。見表1。
1.2 治療方法
所有患者明確診斷后,依據(jù)《中國(guó)2型糖尿病防治指南(2013年版)》[4]中的方法控制血糖、血壓和血脂。
1.3 血液生化指標(biāo)檢測(cè)
兩組受試者禁食禁水12 h后,次日清晨采集前臂靜脈血,室溫下3 000 r/min 離心20 min,分離血清,保存于-70 ℃冰箱。采用全自動(dòng)糖化分析儀檢測(cè)糖化血紅蛋白(HbA1c),采用日立7600全自動(dòng)生化儀檢測(cè)三酰甘油、總膽固醇、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、脂蛋白a、血尿酸及U-mALB。
1.4 動(dòng)態(tài)血糖監(jiān)測(cè)
分別于三餐前、三餐后2 h及晚睡前(22:00),采用羅氏快速血糖儀檢測(cè)指尖微量血糖,根據(jù)全天7次血糖計(jì)算出血糖水平標(biāo)準(zhǔn)差(standard deviation of blood glucose, SDBG)、平均血糖波動(dòng)幅度(mean amplitude of glucose excursion, MAGE)、最大血糖波動(dòng)幅度(largest amplitude of glycemic excursions, LAGE)及平均餐后血糖波動(dòng)幅度(mean postprandial blood glucose excursion, MPPGE)。SDBG:血糖測(cè)定值與平均血糖標(biāo)準(zhǔn)差;MAGE:三餐前后血糖波動(dòng)幅度的均數(shù);LAGE:最大和最小血糖之差;MPPGE:三餐后血糖與平均血糖差的均數(shù)。監(jiān)測(cè)期間患者飲食情況與以往基本一致,降糖方案根據(jù)血糖情況調(diào)整。
1.5 統(tǒng)計(jì)學(xué)方法
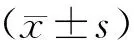
2 結(jié)果
2.1 兩組一般情況對(duì)比
兩組平均病程、2hPG、三酰甘油、總膽固醇、HDL-C、LDL-C、血尿酸、脂蛋白a和U-mALB間的差異均有統(tǒng)計(jì)學(xué)意義(P<0.01)。兩組患者的HbA1c均<9%,且無顯著性差異(P>0.05)。見表1。
2.2 兩組血糖波動(dòng)參數(shù)對(duì)比
觀察組MAGE、LAGE、SDBG、MPPGE均顯著高于對(duì)照組,差異均有統(tǒng)計(jì)學(xué)意義(P<0.01)。見表2。
2.3 脂蛋白a、血尿酸與各參數(shù)相關(guān)性分析
Pearson相關(guān)分析顯示,U-mALB與脂蛋白a、血尿酸均呈顯著正相關(guān)(r分別為0.886,0.943,均P<0.05),總膽固醇、MAGE與脂蛋白a呈顯著正相關(guān)(r分別為0.560,0.965,P均<0.05),SDBG和MAGE與血尿酸水平呈顯著正相關(guān)(r分別為0.641,0.495,P均<0.05)。

表1 兩組一般情況對(duì)比

表2 兩組血糖波動(dòng)參數(shù)比較 mmol/L
2.4 多元逐步回歸分析
以脂蛋白a為因變量,以平均病程、2h PG、三酰甘油、總膽固醇、HDL-C、LDL-C、U-mALB、MAGE、LAGE、SDBG、MPPGE為自變量進(jìn)行多元逐步回歸分析。結(jié)果顯示,總膽固醇、MAGE與脂蛋白a獨(dú)立相關(guān)(Y=-65.647×總膽固醇+36.648×MAGE)。見表3。
以血尿酸為因變量,以平均病程、2h PG、三酰甘油、總膽固醇、HDL-C、LDL-C、U-mALB、MAGE、LAGE、SDBG、MPPGE為自變量進(jìn)行多元逐步回歸分析。結(jié)果顯示,SDBG和MAGE與血尿酸獨(dú)立相關(guān)(Y=4.011×SDBG+3.421×MAGE)。見表4。

表3 影響脂蛋白a的各因素逐步回歸分析結(jié)果

表4 影響血尿酸的各因素逐步回歸分析結(jié)果
3 討論
近年來研究發(fā)現(xiàn),糖尿病患者即使血糖濃度相同,微血管并發(fā)癥的風(fēng)險(xiǎn)也不相同[5]。HbA1c是公認(rèn)的長(zhǎng)期血糖控制的金標(biāo)準(zhǔn),但并不能反映血糖波動(dòng)幅度和頻率[6]。HbA1c控制達(dá)標(biāo)的2型糖尿病患者,血糖波動(dòng)同樣會(huì)導(dǎo)致糖尿病慢性并發(fā)癥的發(fā)生[7],血糖波動(dòng)越大,微血管病變的發(fā)生率越高且預(yù)后越差[8]。
本研究評(píng)估2型糖尿病患者血糖波動(dòng)水平,結(jié)果顯示糖尿病并發(fā)蛋白尿患者與單純糖尿病患者平均病程、2 h PG、三酰甘油、總膽固醇、HDL-C、LDL-C、血尿酸、脂蛋白a和U-mALB的差異均有統(tǒng)計(jì)學(xué)意義;兩組患者的HbA1c均<9%,且無顯著性差異。2型糖尿病伴微蛋白尿患者M(jìn)AGE、LAGE、SDBG、MPPGE均顯著高于單純糖尿病患者,提示蛋白尿患者胰島細(xì)胞功能減退,血糖波動(dòng)幅度增大,出現(xiàn)蛋白尿的概率增大。多元逐步回歸分析顯示,總膽固醇、MAGE與脂蛋白a獨(dú)立相關(guān),SDBG和MAGE與血尿酸獨(dú)立相關(guān);Pearson相關(guān)性分析結(jié)果顯示,U-mALB與脂蛋白a、血尿酸均呈顯著正相關(guān),總膽固醇、MAGE與脂蛋白a呈顯著正相關(guān),SDBG和MAGE與血尿酸水平呈顯著正相關(guān)。
蛋白質(zhì)在長(zhǎng)期高糖環(huán)境中會(huì)發(fā)生糖基化,特別是載脂蛋白。脂蛋白a是發(fā)生糖基化受體識(shí)別的主要蛋白。受糖基化的影響,脂蛋白a中央蛋白質(zhì)會(huì)失去對(duì)卵磷脂膽固醇酰基轉(zhuǎn)移酶的激活作用,脂蛋白a受體識(shí)別發(fā)生功能障礙,使低密度脂蛋白過多攝取,增加肝外膽固醇的返回難度,影響逆向轉(zhuǎn)運(yùn),引起膽固醇代謝紊亂。
尿酸是嘌呤代謝的終產(chǎn)物,有研究認(rèn)為血尿酸較白蛋白能更好地預(yù)測(cè)腎臟損害。 Zoppini等[9]研究發(fā)現(xiàn)血尿酸濃度與糖尿病微血管病變有關(guān),可作為糖尿病腎病的獨(dú)立危險(xiǎn)因素。2型糖尿病患者發(fā)生胰島素抵抗,引起繼發(fā)性高胰島素血癥,一方面影響近端腎小管排鈉,另一方面影響尿酸的排泄[10];而尿酸濃度升高可增加血小板凝聚,誘發(fā)內(nèi)皮功能損害,刺激白細(xì)胞產(chǎn)生細(xì)胞因子,加重腎小管損害及增生[11];而且也可形成尿酸結(jié)石沉積于腎臟,增加微血管血栓危險(xiǎn)性。糖尿病腎病患者多伴有不同程度的脂代謝異常,易引起腎小球基底膜中磷酸脂成分發(fā)生葡萄糖胺糖化,增強(qiáng)腎小球的超濾能力,使尿蛋白的排出增加,血清中白蛋白顯著下降,誘發(fā)肝組織合成更多脂蛋白a,使血清中脂蛋白a濃度顯著增加;增高的脂蛋白a一方面可與血尿酸結(jié)合引起血管炎癥,另一方面脂類物質(zhì)可誘發(fā)腎小球硬化,進(jìn)一步損傷腎功能[12]。因此,2型糖尿病腎病患者應(yīng)注意監(jiān)控尿酸和脂蛋白a濃度,積極進(jìn)行防治,以防進(jìn)一步損害腎功能。
高尿酸和高血脂的糖尿病患者更易患糖尿病腎病,隨著血糖、血壓、血脂等水平的增高及體重增加,2型糖尿病并發(fā)癥的發(fā)生風(fēng)險(xiǎn)、發(fā)展速度以及危害程度也會(huì)顯著增加。因此,針對(duì)2型糖尿病患者應(yīng)采用科學(xué)、合理、基于循證醫(yī)學(xué)的綜合性治療策略,早期評(píng)估血糖波動(dòng)幅度,盡早實(shí)施包括降糖、降壓、調(diào)脂、抗凝等措施的個(gè)體化治療方案,必要時(shí)可采用藥物等輔助治療。HbAlc一般情況控制在7%以下,盡可能接近正常水平(6%),但也應(yīng)避免因過度放寬控制標(biāo)準(zhǔn)而出現(xiàn)急性高血糖等相關(guān)并發(fā)癥。降低患者脂蛋白a和血尿酸水平,減少對(duì)腎臟損害,有效控制血糖波動(dòng),才是糖尿病腎病防治的關(guān)鍵。
 江蘇大學(xué)學(xué)報(bào)(醫(yī)學(xué)版)2018年6期
江蘇大學(xué)學(xué)報(bào)(醫(yī)學(xué)版)2018年6期
- 江蘇大學(xué)學(xué)報(bào)(醫(yī)學(xué)版)的其它文章
- SiewertⅡ/Ⅲ型食管胃結(jié)合部腺癌胸腹兩種手術(shù)路徑患者病理特征比較
- 50例初診急性早幼粒細(xì)胞白血病患者6種PML/RARα異構(gòu)體定量分析
- 江蘇大學(xué)學(xué)報(bào)(醫(yī)學(xué)版)第28卷(2018年)總目次
- 經(jīng)皮冠脈介入治療老年冠心病患者的預(yù)后及其影響因素
- 握力指數(shù)在社區(qū)老年人營(yíng)養(yǎng)不良篩查中的應(yīng)用價(jià)值
- 不同糖代謝狀態(tài)下體重指數(shù)與胰島β細(xì)胞功能的相關(guān)性
