添加微細(xì)鰈魚魚骨泥對金線魚魚糜凝膠品質(zhì)的影響
李學(xué)鵬,劉慈坤,范大明,王金廂,儀淑敏,勵建榮,*,李婷婷,李鈺金,牟偉麗,沈 琳,黃建聯(lián)
(1.渤海大學(xué)食品科學(xué)與工程學(xué)院,遼寧 錦州 121013;2.江南大學(xué)食品學(xué)院,江蘇 無錫 214122;3.大連民族大學(xué)生命科學(xué)學(xué)院,遼寧 大連 116600;4.榮成泰祥食品股份有限公司,山東 榮成 264300;5.蓬萊京魯漁業(yè)有限公司,山東 煙臺 265600;6.大連東霖食品股份有限公司,遼寧 大連 116007;7.遼寧安井食品有限公司,遼寧 鞍山 361003)
近年來,我國水產(chǎn)品加工行業(yè)趨向于多元化發(fā)展,已形成了冷凍調(diào)理制品、魚糜制品、干制品、腌熏制品、罐頭制品、調(diào)味品、休閑食品等加工食品體系。伴隨水產(chǎn)品加工業(yè)的快速發(fā)展而產(chǎn)生的下腳料問題成為困擾行業(yè)的一大難題,下腳料的高值化利用及生物轉(zhuǎn)化已成為企業(yè)未來競爭力的關(guān)鍵[1]。鰈魚是我國主要的海水養(yǎng)殖和加工品種,2016年鰈魚養(yǎng)殖產(chǎn)量達(dá)到了13 380 t,是所有海水魚中養(yǎng)殖增量最大的魚種,比2015年增加了55.26%[2]。鰈魚骨是凍鰈魚片加工過程中產(chǎn)生的主要下腳料,產(chǎn)量很大。由于缺乏相應(yīng)的精深加工技術(shù),魚骨等下腳料常被丟棄或者低價賣給魚粉廠,簡單做成魚粉、肥料和飼料等低附加值產(chǎn)品,不僅造成了嚴(yán)重的資源浪費(fèi)和環(huán)境污染,同時也大大影響了企業(yè)效益。開發(fā)經(jīng)濟(jì)、實(shí)用的魚骨加工技術(shù)及產(chǎn)品成為眾多水產(chǎn)加工企業(yè)的迫切需求。
魚骨中含有大量鈣質(zhì),目前對魚骨的加工利用研究主要集中在通過酶解、螯合工藝制備膠原多肽螯合鈣[3];通過堿醇法制備成鈣片[4];采用高壓蒸煮、酶解、復(fù)配等工藝開發(fā)魚骨膏體調(diào)味料、魚骨酥、魚骨粉等產(chǎn)品[5]。而利用超微粉碎技術(shù)將魚骨制成超微細(xì)魚骨泥,并將其添加到魚糜制品中開發(fā)高鈣魚糜制品的研究仍鮮見報道,尤其是添加魚骨泥對魚糜凝膠品質(zhì)影響的研究尚不多見[6]。魚糜制品是一類低脂肪、高蛋白、低膽固醇的營養(yǎng)健康食品,深受消費(fèi)者喜愛,近年來發(fā)展迅速、需求量快速增長,在世界各國都有著廣闊的市場。將魚骨泥與魚糜制品結(jié)合開發(fā)高鈣系列魚糜制品,不僅能提高魚骨的利用率和附加值,同時可豐富魚糜制品品種。本實(shí)驗(yàn)通過研究添加微細(xì)魚骨泥對魚糜制品凝膠強(qiáng)度、質(zhì)構(gòu)、色澤、微觀結(jié)構(gòu)等品質(zhì)的影響,為高鈣魚糜制品的開發(fā)和魚骨高值化利用提供依據(jù)和支撐。
1 材料與方法
1.1 材料與試劑
鰈魚骨 大連天寶綠色食品股份有限公司;金線魚魚糜 青島錦燦食品有限公司。
磷酸氫二鈉、磷酸二氫鉀、五水硫酸銅、氫氧化鈉、三羥甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)(分析純) 國藥集團(tuán)化學(xué)試劑有限公司;蛋白分子質(zhì)量Marker 大連寶生生物工程公司;十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)所用試劑 上海生物工程有限公司。
1.2 儀器與設(shè)備
RRH-A250型高速萬能粉碎機(jī) 上海緣沃工貿(mào)有限公司;JMS-50型膠體磨 河北廊坊祥通機(jī)械有限公司;QDGX型高精密濕法超微粉碎機(jī) 無錫輕大食品裝備有限公司;SQ2119B型多功能食品加工機(jī) 上海帥佳電子科技有限公司;DELTA 320型pH計(jì)、PL602-L型電子天平梅特勒-托利多儀器(上海)有限公司;HH.6型數(shù)顯恒溫水浴鍋 國華電器有限公司;UV-2100型紫外-可見分光光度計(jì) 日本島津公司;Milli.Q型超純水機(jī)密理博中國有限公司;Forma 702型-80 ℃超低溫冰箱、Biofuge Stratos臺式高速離心機(jī) 美國Thermo Fisher公司;T25 basic型高速分散均質(zhì)機(jī) 德國IKA公司;3CELL型Mini Tetra電泳槽 美國Bio-Rad公司;CR-400型色彩色差計(jì)、S4800場發(fā)射掃描電子顯微鏡(scanning electron microscope,SEM) 日本KONICA MINOLTA公司;TA.XT plus質(zhì)構(gòu)儀 英國Stable Micro Systems公司。
1.3 方法
1.3.1 制備微細(xì)骨泥的工藝流程
鰈魚骨→清洗、切塊→冷凍→粗粉碎(萬能粉碎機(jī))→強(qiáng)力骨泥機(jī)→細(xì)粉碎(膠體磨)→濕法超微粉碎(高精密濕法超微粉碎機(jī))→離心脫水→微細(xì)骨泥。
骨泥粒徑采用流水過篩法進(jìn)行測定。由于骨泥中含有魚肉,易吸水膨脹,因此在過篩前取一定量的骨泥用質(zhì)量分?jǐn)?shù)5% SDS溶液攪拌1 h后5 000 r/min離心10 min,取下層沉淀,將其置于相應(yīng)的泰勒篩上用流水沖洗,當(dāng)物料通過率大于95%時即判定為骨泥粒徑。本實(shí)驗(yàn)用骨泥粒徑為100 目。
1.3.2 魚糜凝膠的制備
取500 g冷凍魚糜室溫下半解凍后切塊,置于斬拌機(jī)斬拌2 min,再加入質(zhì)量分?jǐn)?shù)2%食鹽擂潰3 min,最后分別加入質(zhì)量分?jǐn)?shù)為2.5%、5.0%、7.5%、10.0%、12.5%骨泥(本實(shí)驗(yàn)中添加骨泥質(zhì)量分?jǐn)?shù)均以冷凍魚糜的質(zhì)量為基準(zhǔn))并調(diào)節(jié)水分質(zhì)量分?jǐn)?shù)為80%,繼續(xù)斬拌2 min;整個過程溫度嚴(yán)格控制在10 ℃以下。斬拌結(jié)束后將物料填至25 mm的腸衣中成型,灌腸后采用二段式加熱法(40 ℃、30 min,90 ℃、5 min)進(jìn)行凝膠化和熟化定型,加熱結(jié)束后取出置于冰水中冷卻10 min,放入4 ℃冰箱靜置過夜,待測。
1.3.3 魚糜溶膠pH值測定
取1.3.2節(jié)經(jīng)斬拌的魚糜溶膠,參考GB 5009.237—2016《食品安全國家標(biāo)準(zhǔn) 食品pH值的測定》[7]方法進(jìn)行pH值測定。
1.3.4 溶膠中肌原纖維蛋白Ca2+-ATP酶活力測定
參考陸海霞[8]、Riebory[9]等方法略作修改,測定魚糜溶膠中肌原纖維蛋白Ca2+-ATP酶活力。具體方法如下:魚糜溶膠與Tris-HCl緩沖液(0.6 mol/L KCl、0.02 mol/L Tris-HCl,pH 7)以1:10(m/m)充分勻漿,于4 ℃下浸提1 h,然后在4 ℃、10 000 r/min下離心10 min,所得上清液為肌原纖維蛋白溶液。采用雙縮脲法在波長540 nm處測定吸光度,并換算為蛋白質(zhì)量濃度。
取0.5 mL肌原纖維蛋白溶液(質(zhì)量濃度為3.0 mg/mL),與0.25 mL 20 mmol/L ATP溶液、0.25 mL 0.5 mol/L Tris-HCl溶液(pH 7)、0.5 mL 1 mol/L KCl溶液、3.5 mL去離子水混合,在25 ℃反應(yīng)10 min,加入1.0 mL質(zhì)量分?jǐn)?shù)10%三氯乙酸(trichloroacetic acid,TCA)終止反應(yīng),空白溶液在加入ATP溶液前加入TCA。采用3 500×g離心5 min去除沉淀,取2.0 mL上清液加入8 mL顯色液,于25 mL容量瓶定容。采用鉬藍(lán)比色法測定反應(yīng)中釋放的無機(jī)磷含量。
1.3.5 凝膠強(qiáng)度的測定
將凝膠切成25 mm×20 mm(直徑×高度)的圓柱體,用TA.XT plus質(zhì)構(gòu)儀的球形探頭P/0.5S進(jìn)行穿刺實(shí)驗(yàn),下壓速率設(shè)定為1 mm/s,下壓高度為10 mm,下壓力為5 g。破斷力定義為穿刺曲線上出現(xiàn)的第一個峰;凹陷深度定義為與破斷強(qiáng)度相對應(yīng)的破斷距離;凝膠強(qiáng)度定義為破斷強(qiáng)度與凹陷深度的乘積。
1.3.6 凝膠質(zhì)構(gòu)的測定
樣品前處理同1.3.5節(jié)方法,使用的探頭更換為P/50柱形探頭。測定參數(shù):測試速率恒定為1 mm/s,壓縮形變?yōu)?0%,下壓力為5 g,得到樣品的硬度、彈性、黏聚性、咀嚼性等指標(biāo)。
1.3.7 凝膠色澤的測定
采用CR-400色彩色差計(jì)對樣品的色澤進(jìn)行測定,將樣品切成25 mm×20 mm的圓柱形塊,儀器用標(biāo)準(zhǔn)白板、黑板分別校正后,在室溫下分別測定樣品的上、下、左、右、中5 個區(qū)域,得到凝膠樣品的L*、a*、b*值,其中L*值表示亮度,a*值表示紅綠色,b*值表示黃藍(lán)色,通過公式(1)計(jì)算白度值。

1.3.8 凝膠持水性的測定
采用高速離心法測定凝膠的持水性。將樣品切成10 mm×10 mm小塊稱質(zhì)量,計(jì)為m;用兩層濾紙包裹樣品塊,置于50 mL離心管中,10 000 r/min離心10 min后取出,質(zhì)量記為m1。持水性按公式(2)計(jì)算。
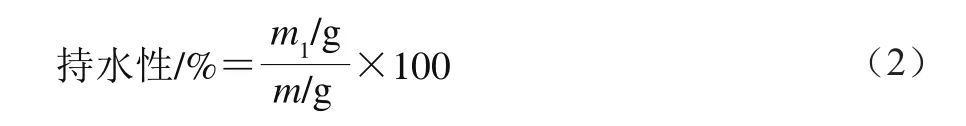
1.3.9 凝膠溶解度的測定
參照Benjakul等[10]的方法略作修改。稱取魚糜凝膠1 g,切碎后加入20 mL 0.02 mol/L的Tris-HCl緩沖液(含8 mol/L尿素、10 g/L SDS、體積分?jǐn)?shù)2% β-巰基乙醇,pH 8.0),用高速分散器勻漿4 min,沸水浴2 min,冷卻至室溫后攪拌30 min,在10 000 r/min條件下離心10 min。吸取上清液10 mL并添加2.5 mL 0.5 g/mL TCA,在4 ℃條件下靜置18 h,在10 000 r/min離心30 min,沉淀物用3 倍體積0.1 g/mL TCA冷溶液洗滌,待沉淀干燥后溶解于30 mL 0.5 mol/L NaOH溶液中。魚糜凝膠直接溶解于30 mL 0.5 mol/L NaOH溶液中,采用雙縮脲法測定蛋白質(zhì)量濃度,測得的蛋白質(zhì)量濃度為總蛋白質(zhì)量濃度,溶解于混合劑中的蛋白質(zhì)量濃度與總蛋白質(zhì)量濃度的比值即為凝膠溶解度。
1.3.10 SDS-PAGE分析
參考Laemmli[11]和Xiong Youling L.[12]等的方法。稱取魚糜凝膠1 g,切碎后加入9 mL 5% SDS溶液,用高速分散均質(zhì)機(jī)均質(zhì)2 min,均勻混合后85 ℃水浴加熱1 h使蛋白質(zhì)充分溶出,冷卻后將勻漿液在10 000 r/min條件下離心10 min,取上清液與樣品緩沖液以體積比1∶1混合,沸水浴5 min。制膠后上樣10 μL,其中濃縮膠質(zhì)量分?jǐn)?shù)為4%,分離膠質(zhì)量分?jǐn)?shù)為12%,在100 V恒壓下進(jìn)行實(shí)驗(yàn)。電泳完成后用質(zhì)量分?jǐn)?shù)0.1%考馬斯亮藍(lán)染色5~10 min,脫色至背景基本無色,使用Quantity One軟件進(jìn)行分析和處理。
1.3.11 凝膠SEM觀察
將待測魚糜凝膠切成小塊,浸泡在體積分?jǐn)?shù)2.5%戊二醛溶液中,在4 ℃下固定24 h,再用0.1 mol/L pH 7.2的磷酸鹽緩沖液漂洗數(shù)次,然后用體積分?jǐn)?shù)50%、70%、90%、100%乙醇溶液逐級脫水各10 min。使用冷凍干燥機(jī)干燥,經(jīng)真空離子濺射儀噴金后,用SEM觀察結(jié)構(gòu)。
1.4 數(shù)據(jù)統(tǒng)計(jì)分析
采用SPSS 19.0和Origin 8.5軟件對數(shù)據(jù)進(jìn)行方差分析、顯著性檢驗(yàn)、相關(guān)性分析和因子分析,多重比較采用Duncan檢驗(yàn),P<0.05表示差異或相關(guān)性顯著。
2 結(jié)果與分析
2.1 骨泥質(zhì)量分?jǐn)?shù)對魚糜溶膠pH值的影響
研究表明,pH值是肌原纖維蛋白凝膠的重要影響因素,其影響途徑主要有兩方面:1)pH值對肌原纖維蛋白二級結(jié)構(gòu)具有顯著的影響。當(dāng)pH值逐漸由肌原纖維蛋白等電點(diǎn)(約5.0~5.2)向中性范圍接近時,蛋白質(zhì)天然二級結(jié)構(gòu)中α-螺旋的含量也越多,凝膠的微觀結(jié)構(gòu)、保水性及凝膠強(qiáng)度與其變化保持一致[13-14],但是β-折疊的含量呈現(xiàn)降低的趨勢。2)pH值會直接影響到肌球蛋白ATP酶的活力。當(dāng)pH值過低時,肌球蛋白ATP酶的某些活性基團(tuán)發(fā)生不可逆轉(zhuǎn)變化,影響肌球蛋白與肌動蛋白之間的結(jié)合能力,從而影響肉制品的凝膠強(qiáng)度[15-16]。另外,研究表明魚糜凝膠制品的最適pH值為6.5~7.5之間的中性區(qū)域[17]。從圖1可以看出,隨著骨泥質(zhì)量分?jǐn)?shù)的增加,魚糜溶膠pH值略有上升,可能與Ca2+含量增加和骨泥本身pH值有關(guān),但均保持在pH6.8~7.0范圍之間,能夠滿足魚糜凝膠制品的適宜加工條件,說明魚骨泥的添加不影響魚糜凝膠形成的基本條件。

圖1 骨泥質(zhì)量分?jǐn)?shù)對魚糜溶膠pH值的影響Fig.1 Effect of fish bone paste addition on pH of surimi sol
2.2 骨泥質(zhì)量分?jǐn)?shù)對魚糜溶膠中肌原纖維蛋白Ca2+-ATP酶活力的影響
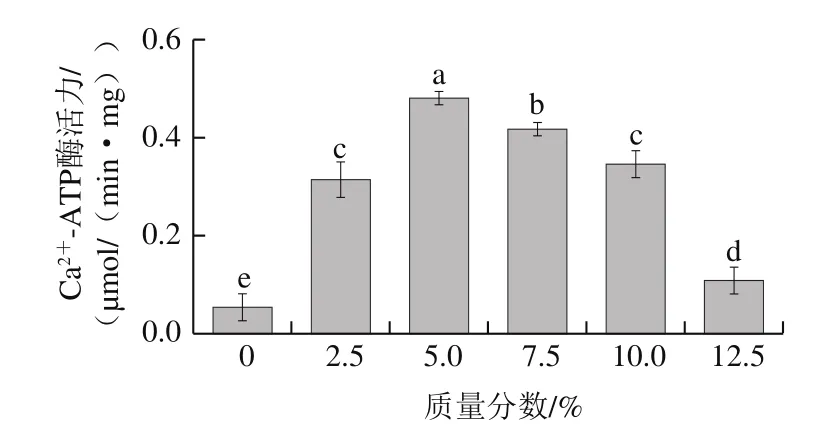
圖2 骨泥質(zhì)量分?jǐn)?shù)對魚糜溶膠中肌原纖維蛋白Ca2+-ATP酶活力的影響Fig.2 Effect of fish bone paste addition on Ca2+-ATPase activity of myofibril protein in surimi sol
ATP酶活力是肌球蛋白的最重要特性之一。肌球蛋白中的ATP酶可以分解ATP釋放能量,并牽引與之相連的肌動蛋白產(chǎn)生一定的位移。魚糜在加熱處理后,肌球蛋白與肌動蛋白結(jié)合形成凝膠[18]。添加適量的Ca2+可以保持肌球蛋白ATP酶的穩(wěn)定性并提高其活力,從而使其與肌動蛋白結(jié)合,形成致密、有序的三維網(wǎng)狀結(jié)構(gòu)。由圖2可知,Ca2+-ATP酶活力隨著骨泥質(zhì)量分?jǐn)?shù)的增加呈現(xiàn)先增加后降低的趨勢(P<0.05)。當(dāng)骨泥質(zhì)量分?jǐn)?shù)為5.0%時,相應(yīng)的Ca2+-ATP酶活力達(dá)到最高值0.481 μmol/(min·mg),與對照組相比提高了7.9 倍。而隨著骨泥的進(jìn)一步添加,Ca2+-ATP酶活力急劇下降,最終達(dá)到0.108 μmol/(min·mg),與對照組相比僅提高了1 倍。當(dāng)骨泥質(zhì)量分?jǐn)?shù)低于5.0%時,Ca2+可以與ATP酶有效結(jié)合,激活A(yù)TP酶,促進(jìn)肌球蛋白與肌動蛋白結(jié)合;但當(dāng)骨泥質(zhì)量分?jǐn)?shù)大于5.0%時,Ca2+含量急劇增加,導(dǎo)致蛋白質(zhì)-鈣-蛋白質(zhì)結(jié)構(gòu)的形成,Ca2+不能有效激活A(yù)TP酶,最后造成了Ca2+-ATP酶活力隨著骨泥質(zhì)量分?jǐn)?shù)的增加呈現(xiàn)先增加后降低的趨勢[19]。
2.3 骨泥質(zhì)量分?jǐn)?shù)對魚糜凝膠強(qiáng)度的影響

圖3 骨泥質(zhì)量分?jǐn)?shù)對魚糜凝膠強(qiáng)度的影響Fig.3 Effect of fish bone paste addition on the strength of surimi gel
由圖3可知,隨著骨泥質(zhì)量分?jǐn)?shù)的增加,魚糜凝膠強(qiáng)度呈現(xiàn)先升高后降低的趨勢。在骨泥質(zhì)量分?jǐn)?shù)為5.0%時,凝膠強(qiáng)度達(dá)到最大值,約為對照組的1.7 倍。當(dāng)添加的骨泥質(zhì)量分?jǐn)?shù)大于5.0%時,魚糜凝膠強(qiáng)度呈現(xiàn)急劇下降趨勢(P<0.05),骨泥質(zhì)量分?jǐn)?shù)為12.5%時凝膠強(qiáng)度小于對照組。分析其主要原因可能為:一方面是隨著骨泥質(zhì)量分?jǐn)?shù)的增加,Ca2+-ATP酶活力下降,肌球蛋白與肌動蛋白不能有效結(jié)合,導(dǎo)致凝膠形成能力下降;另一方面是低濃度Ca2+激活魚糜中內(nèi)源性谷氨酰胺轉(zhuǎn)氨酶(transglutaminase,TGase),促進(jìn)肌原纖維蛋白交聯(lián),而高濃度Ca2+會抑制TGase活力、影響交聯(lián),進(jìn)而使凝膠強(qiáng)度降低[20]。這與Hemung[21]和葉川[19]等的研究結(jié)果基本一致。
2.4 骨泥質(zhì)量分?jǐn)?shù)對魚糜凝膠質(zhì)構(gòu)的影響

表1 骨泥質(zhì)量分?jǐn)?shù)對魚糜凝膠質(zhì)構(gòu)的影響Table1 Effect of fish bone paste addition on texture properties of surimi gel
由表1可知,除硬度、膠著度、咀嚼度3 種指標(biāo)外,其他指標(biāo)均無顯著差異(P>0.05)。對于硬度、膠著度、咀嚼度這3 個指標(biāo)而言,其變化趨勢與凝膠強(qiáng)度基本一致,都呈現(xiàn)先增強(qiáng)后降低的現(xiàn)象。當(dāng)骨泥質(zhì)量分?jǐn)?shù)為5.0%時,魚糜凝膠硬度與對照組相比提高了約31%,而膠著度、咀嚼度兩項(xiàng)指標(biāo)與對照組相比分別提高了約26%和24%。當(dāng)骨泥質(zhì)量分?jǐn)?shù)超過5.0%時,硬度、膠著度、咀嚼度數(shù)值急劇下降,口感變差。
2.5 骨泥質(zhì)量分?jǐn)?shù)對魚糜凝膠色澤的影響
關(guān)于魚糜凝膠色澤變化的原因鮮有報道,除了魚糜及輔料添加帶來的凝膠色澤變化外,有學(xué)者認(rèn)為水的添加能提高L*值、降低b*值,而a*值與水分含量沒有顯著的關(guān)系[22]。另外,不同溫度下所測的亮度也有所不同,凝膠在25 ℃下比5 ℃下的亮度要高[23]。此外有學(xué)者發(fā)現(xiàn),經(jīng)過超高壓處理比加熱處理的凝膠結(jié)構(gòu)更為致密,相應(yīng)的魚糜凝膠的亮度與白度較高[24-25]。由表2可知,對于L*值來說,骨泥的添加可以顯著提高魚糜凝膠的亮度(P<0.05)。但是骨泥質(zhì)量分?jǐn)?shù)為2.5%時,魚糜凝膠的亮度與對照組相比會出現(xiàn)下降的情況。這可能是由于添加的骨泥與魚糜中蛋白質(zhì)之間爭奪水分,使凝膠表面水分減少,亮度下降[6]。而加入質(zhì)量分?jǐn)?shù)5.0%的骨泥形成的凝膠結(jié)構(gòu)較2.5%時更加致密,亮度會有所提高。繼續(xù)添加骨泥會導(dǎo)致魚糜凝膠結(jié)構(gòu)松散,形成較大的孔洞,其內(nèi)部的水分更容易溢出至表面,從而使得魚糜凝膠在短時間內(nèi)亮度提高。而色彩指數(shù)a*值僅在骨泥質(zhì)量分?jǐn)?shù)大于10.0%時發(fā)生明顯的變化。當(dāng)骨泥質(zhì)量分?jǐn)?shù)為5.0%時,其魚糜凝膠色彩指數(shù)b*值最小,但隨著骨泥質(zhì)量分?jǐn)?shù)的增加,b*值緩慢提高。與對照組相比,適量地添加骨泥對魚糜凝膠制品在色澤上并沒有負(fù)面影響,可以滿足消費(fèi)者的感官需求。

表2 骨泥質(zhì)量分?jǐn)?shù)對魚糜凝膠色澤的影響Table2 Effect of fish bone paste addition on color of surimi gel
2.6 骨泥質(zhì)量分?jǐn)?shù)對魚糜凝膠持水性的影響
水分作為魚糜制品中含量最高的化學(xué)組分,其含量、分布狀態(tài)及穩(wěn)定性關(guān)系到產(chǎn)品的食用品質(zhì)(色澤、嫩度、多汁性、風(fēng)味等)和貨架期,所以良好的凝膠持水性不僅能夠降低企業(yè)生產(chǎn)的成本,提高產(chǎn)品出品率,還可以保留更多的風(fēng)味物質(zhì),因此凝膠持水性是魚糜凝膠制品的一項(xiàng)重要指標(biāo)[26]。如圖4所示,隨著骨泥質(zhì)量分?jǐn)?shù)的增加,凝膠持水性呈先上升后下降的趨勢,與魚糜的凝膠強(qiáng)度變化趨勢基本一致。當(dāng)骨泥質(zhì)量分?jǐn)?shù)達(dá)到5.0%時,魚糜凝膠的持水性達(dá)到最大值,與對照組相比提高了約5%(P<0.05)。但繼續(xù)添加骨泥后,凝膠持水性顯著下降(P<0.05);添加質(zhì)量分?jǐn)?shù)10.0%的骨泥時,魚糜凝膠的持水性較對照組降低了約4%。研究表明,凝膠持水性主要與凝膠結(jié)構(gòu)密切相關(guān)。結(jié)合本研究中魚糜凝膠SEM微觀結(jié)構(gòu)觀察結(jié)果可知,當(dāng)骨泥質(zhì)量分?jǐn)?shù)達(dá)到5.0%時,魚糜凝膠形成的三維網(wǎng)狀結(jié)構(gòu)較為致密,可以包埋更多的水分子,凝膠持水性較好。當(dāng)進(jìn)一步添加骨泥后,凝膠結(jié)構(gòu)較為松散。出現(xiàn)這樣的原因可能是骨泥添加過多時,相應(yīng)的魚糜中Ca2+含量增加,影響蛋白質(zhì)之間緊密、有序的交聯(lián);當(dāng)骨泥質(zhì)量分?jǐn)?shù)逐漸提高時,大量的骨泥顆粒也隨之加入到魚糜中,阻礙了蛋白質(zhì)之間的交聯(lián),從而使形成的凝膠結(jié)構(gòu)較為松散,導(dǎo)致凝膠持水性顯著降低[27]。
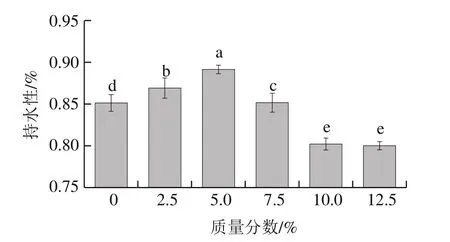
圖4 骨泥質(zhì)量分?jǐn)?shù)對魚糜凝膠持水性的影響Fig.4 Effect of fish bone paste addition on water-holding capacity of surimi gel
2.7 骨泥質(zhì)量分?jǐn)?shù)對魚糜凝膠溶解度的影響
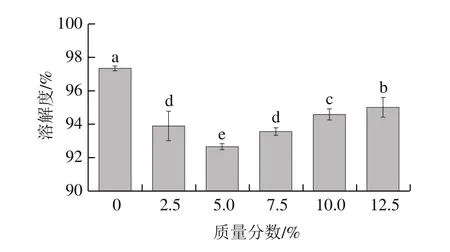
圖5 骨泥質(zhì)量分?jǐn)?shù)對魚糜凝膠溶解度的影響Fig.5 Effect of fish bone paste addition on solubility of surimi gel
Tris-HCl混合溶液(含有尿素、β-巰基乙醇和SDS)可以破壞魚糜凝膠網(wǎng)絡(luò)中除了非二硫共價鍵(主要為ε-(γ-葡萄糖)-賴氨酸(ε-(γ-Glu)-Lys)共價鍵)以外的所有共價鍵,由此測得的凝膠溶解度可以反映出ε-(γ-Glu)-Lys共價鍵含量的高低[28]。ε-(γ-Glu)-Lys共價鍵的存在賦予了魚糜凝膠較高的硬度和彈性。由圖5可以看出,隨骨泥質(zhì)量分?jǐn)?shù)的增加,魚糜凝膠的溶解度呈現(xiàn)先減少后增加的顯著變化趨勢(P<0.05)。當(dāng)骨泥質(zhì)量分?jǐn)?shù)為5.0%時,魚糜凝膠的溶解度出現(xiàn)最小值,約92%,較對照組的溶解度降低了約5%。但進(jìn)一步添加骨泥后,魚糜凝膠溶解度呈現(xiàn)顯著上升趨勢(P<0.05),骨泥質(zhì)量分?jǐn)?shù)增至12.5%時,其凝膠溶解度較對照組只降低了約2%。研究表明,Ca2+濃度對TGase活力具有顯著的影響[29],即低濃度Ca2+激活內(nèi)源性TGase,催化肌球蛋白重鏈(myosin heavy chain,MHC)交聯(lián),有利于魚糜中ε-(γ-Glu)-Lys共價鍵的形成,而高濃度Ca2+卻抑制了TGase的活力,使得魚糜凝膠溶解度增加[30-33]。
2.8 骨泥質(zhì)量分?jǐn)?shù)對魚糜凝膠蛋白組成的影響
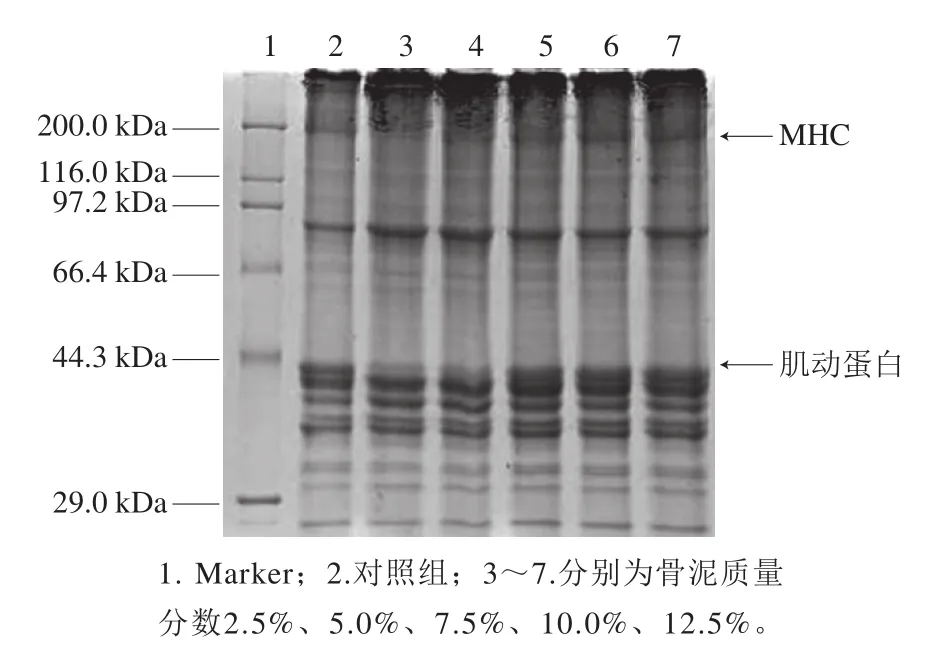
圖6 不同骨泥質(zhì)量分?jǐn)?shù)的魚糜凝膠蛋白SDS-PAGE圖譜Fig.6 SDS-PAGE patterns of proteins in surimi gel with different amounts of fish bone paste
從圖6可知,凝膠中MHC條帶窄疏,這是因?yàn)榧∏虻鞍资切纬婶~糜凝膠的主要蛋白質(zhì),在凝膠中大部分肌球蛋白發(fā)生交聯(lián)形成較大的聚集體,密集分布在分離膠的頂端。同時,與對照組相比,添加質(zhì)量分?jǐn)?shù)2.5%~5.0%魚骨泥的魚糜凝膠中幾乎看不到MHC條帶,說明MHC發(fā)生了充分地交聯(lián),添加質(zhì)量分?jǐn)?shù)2.5%~5.0%魚骨泥促進(jìn)了MHC的交聯(lián)。添加高質(zhì)量分?jǐn)?shù)魚骨泥后,MHC條帶又逐漸變得清晰,說明添加過量魚骨泥會影響MHC的交聯(lián)。造成這種現(xiàn)象的原因可能與魚骨泥中的Ca2+對魚糜中內(nèi)源性TGase激活和抑制有關(guān)[27,29]。
2.9 骨泥質(zhì)量分?jǐn)?shù)對魚糜凝膠微觀結(jié)構(gòu)的影響

圖7 不同骨泥質(zhì)量分?jǐn)?shù)的魚糜凝膠SEM圖Fig.7 SEM of surimi gels with different amounts of fish bone paste
從圖7中可以比較清楚地看到,隨著骨泥質(zhì)量分?jǐn)?shù)的增加,凝膠網(wǎng)狀結(jié)構(gòu)呈現(xiàn)先致密后稀松的變化趨勢。當(dāng)骨泥質(zhì)量分?jǐn)?shù)不大于5.0%時,實(shí)驗(yàn)組的凝膠網(wǎng)狀結(jié)構(gòu)明顯比對照組致密且分布均勻,這與陳海華等[34]用鈣鹽溶液漂洗提高竹莢魚魚糜凝膠強(qiáng)度的結(jié)果相似。但當(dāng)骨泥質(zhì)量分?jǐn)?shù)超過5.0%后,魚糜凝膠表面不平整,內(nèi)部出現(xiàn)較多的空洞,呈雜亂狀,三維網(wǎng)狀結(jié)構(gòu)松散不均勻。骨泥質(zhì)量分?jǐn)?shù)為5.0%的魚糜凝膠表面平整,蛋白質(zhì)之間相互交聯(lián),形成致密均勻的網(wǎng)狀結(jié)構(gòu),優(yōu)于對照組及其他實(shí)驗(yàn)組。該結(jié)果與上述魚糜溶膠中Ca2+-ATP酶活力、凝膠強(qiáng)度、凝膠持水性等結(jié)果具有較高一致性,同時印證了上述分析。
3 結(jié) 論
向魚糜中添加2.5%~12.5%微細(xì)魚骨泥不影響魚糜正常凝膠的pH值。骨泥質(zhì)量分?jǐn)?shù)較低(不超過5.0%)時,魚骨泥中的Ca2+可以激活魚糜溶膠中肌原纖維蛋白的ATP酶,能顯著提升Ca2+-ATP酶活力;質(zhì)量分?jǐn)?shù)較高時使Ca2+-ATP酶活力降低。魚糜凝膠的凝膠強(qiáng)度、質(zhì)構(gòu)、持水性、色澤等指標(biāo)均在添加質(zhì)量分?jǐn)?shù)5.0%魚骨泥時達(dá)到最高值,而凝膠溶解度在添加5.0%魚骨泥時達(dá)到最低值,說明添加質(zhì)量分?jǐn)?shù)5.0%魚骨泥能促進(jìn)魚糜凝膠形成較多的ε-(γ-Glu)-Lys共價鍵和較為牢固的凝膠結(jié)構(gòu)。SDS-PAGE結(jié)果顯示,添加質(zhì)量分?jǐn)?shù)2.5%~5.0%魚骨泥在一定程度上促進(jìn)了MHC的交聯(lián)。SEM觀察結(jié)果顯示,添加質(zhì)量分?jǐn)?shù)2.5%~5.0%魚骨泥可以促進(jìn)魚糜凝膠形成致密均勻的網(wǎng)狀結(jié)構(gòu),過量添加則會破壞凝膠網(wǎng)絡(luò)。綜上,添加一定量的魚骨泥(質(zhì)量分?jǐn)?shù)不超過5.0%)能夠促進(jìn)魚糜形成較好的凝膠結(jié)構(gòu)而不會影響魚糜凝膠品質(zhì)。進(jìn)一步研究可以考慮如何在不影響魚糜制品品質(zhì)的條件下提高骨泥質(zhì)量分?jǐn)?shù),以進(jìn)一步提高魚骨的利用率和產(chǎn)品附加值。

