不同冷藏時間的鱔魚肉經熟化后質構特性變化及其機理
鄭 紅,蘇現波,馬 良,張曉潔,孫 藝,馬明思,蔡路昀,張宇昊,*
(1.西南大學食品科學學院,重慶 400715;2.邯鄲學院生命科學與工程學院,河北 邯鄲 056005;3.渤海大學食品科學與工程學院,遼寧 錦州 121013)
鱔魚(Monopterus albus)營養物質豐富,是典型的高蛋白低脂肪經濟魚類,具有較高的食用價值[1]。據統計,2016年全國鱔魚總產量達38.6萬 t,較2015年增長了5.06%[2]。因其具有味美、滋補、價廉等優點而具有良好的市場前景。目前很多超市都有冷藏調制鱔魚肉制品流通售賣,很多餐飲店也直接買入鱔魚肉冷藏待加工。因此,研究鱔魚貯藏過程中品質變化規律具有重要意義。
魚肉貯藏過程中易發生劣變,進而會影響其熟化后的食用品質。Cao Leipeng等[3]報道冰藏后的草魚在80 ℃加熱10 min后,蒸煮失水率由15.8%(0 d)下降至11.2%(18 d),其變化機制可能與魚肉死后蛋白水解有關。Raman等[4]的研究結果表明在-18 ℃凍藏6 個月,90 ℃加熱1 min后魷魚硬度1和硬度2(分別指兩次壓縮得到的峰值)分別由56.88 N和55.21 N下降至23.63 N和12.65 N,水分質量分數由70.15%下降至58.88%,其冷凍貯藏過程中蛋白聚集、降解等可能是造成魚肉相應變化的重要原因。尹濤等[5]的研究結果顯示,鰱肌肉5 ℃冷藏1、3、5、7 d,再用蒸汽加熱30 min后其揮發性醇類化合物含量較新鮮鰱肌肉分別降低了1.8%、14.1%、43.7%和84.0%,其主要原因可能是生鮮鰱肌肉在冷藏過程中蛋白發生水解,肌肉纖維結構被破壞;因此熟鰱肌肉生成的揮發性成分易揮發釋放,造成其含量損失,從而影響食品風味。本課題組已經證明,鱔魚肉貨架期為4 d,在貨架期的冷藏過程中,鱔魚肉pH值呈先下降后上升的趨勢,肉色由鮮紅變為棕褐色,持水性逐漸下降;這主要是由于冷藏期間鱔魚肉蛋白間主要內部作用力被破壞,使得蛋白結構趨于松散,蛋白質開始降解,最終造成鱔魚肉品質持續下降[6]。針對目前超市出現的冷藏鱔魚調制食品,均標注建議盡快食用,其原因之一在于貯藏時間延長造成鱔魚肉熟化后質構指標變化規律及其機理的相關研究數據缺失。
本研究以新鮮鱔魚為原料,研究貨架期內不同冷藏時間的鱔魚肉經熟化后,其質構特性變化規律,旨在明確冷藏過程中蛋白變化對不同冷藏時間鱔魚肉熟化后質構品質的影響機理,為冷藏調制鱔魚的品質控制及制品研發提供理論參考。
1 材料與方法
1.1 材料與試劑
鱔魚肉采購于北碚區天生菜市場,體長25~35 cm,體質量60~70 g。
過硫酸銨、十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)、三羥甲基氨基甲烷(Tris)、α-巰基乙醇、四甲基乙二胺、考馬斯亮藍R-250 美國Bio Basic公司;質量分數30%丙烯酰胺工作液 北京索萊寶科技有限公司;標準蛋白(分子質量10~200 kDa)美國賽默飛世爾科技公司。其中Tris、考馬斯亮藍R-250、質量分數30%丙烯酰胺為優級純,其他試劑均為分析純。
1.2 儀器與設備
JA3003B電子天平 上海精天電子儀器有限公司;QL 901漩渦混合器 海門市其林貝爾儀器制造有限公司;UV-2450紫外分光光度計 日本島津公司;8002型溫控水浴鍋 北京永光明醫療儀器廠;DGG-9140A電熱恒溫鼓風干燥箱 上海齊欣科學儀器有限公司;Power PacTM基礎電泳儀 美國Bio-Rad公司;G:BOX EF型凝膠成像系統 英國Syngene公司;5810型臺式高速離心機 德國Eppendorf公司;TA-XT2i質構儀 英國Stable Micro Systems公司;DXR激光共焦顯微拉曼光譜儀 美國賽默飛世爾科技公司。
1.3 方法
1.3.1 魚肉處理
鮮活鱔魚去頭、骨和內臟,純水洗凈后,置于(4±1)℃條件下保鮮貯藏。分別在第1、2、3、4、5天取樣,取樣后,將魚肉置于沸水中煮制5 min進行熟化,室溫下自然冷卻,再進行各指標的測定。
1.3.2 指標測定
1.3.2.1 蒸煮失水率的測定
蒸煮失水率參考孫麗等[7]的方法進行測定,稍做修改。將未加熱和加熱冷卻后的鱔魚肉分別絞碎,測定其水分質量分數,即先在50 ℃烘箱中干燥4 h,然后再轉入105 ℃烘箱中干燥至恒質量。蒸煮失水率的計算見下式。

1.3.2.2 質構特性的測定
采用質構儀對鱔魚肉進行2 次TPA模式測試。測定指標包括硬度、彈性、咀嚼性、膠黏性、內聚性和回復性。將鱔魚肉切成長30 mm、寬10 mm的魚片,每個樣品隨機選取6 份魚片進行測量,取平均值。測試條件:探頭TA7;測前速率2 mm/s;測試速率1 mm/s;測后速率2 mm/s;測試距離1.5 mm;觸發力5 g。
1.3.2.3 化學作用力含量的測定
參照Gómez-Guillén等[8]的方法測定化學作用力含量。將鱔魚肉分別絞碎,取2.0 g鱔魚肉分別與10 mL A、B、C、D、E 5 種溶液混合。A為0.05 mol/L NaCl,B為0.6 mol/L NaCl,C為0.6 mol/L NaCl+1.5 mol/L尿素,D為0.6 mol/L NaCl+8 mol/L尿素,E為0.6 mol/L NaCl+8 mol/L尿素+0.5 mol/L β-巰基乙醇。混合后均質,于4 ℃靜置1 h,然后10 000 r/min離心15 min,用Lowry法[9]測定上清液中蛋白質的含量。離子鍵含量以溶解于A與B溶液中蛋白質含量之差來表示;氫鍵含量以溶解于B與C溶液中蛋白質含量之差來表示;疏水性相互作用含量以溶解于C與D溶液中蛋白質含量之差來表示;二硫鍵含量以溶解于D與E溶液中蛋白質含量之差來表示。
1.3.2.4 SDS-聚丙烯酰胺凝膠電泳
SDS-聚丙烯酰胺凝膠電泳(polyacrylamide gel electrophoresis,PAGE)參照楊暉等[10]的方法并略作修改。將鱔魚肉分別絞碎,稱取50 mg溶解于5 mL 10 g/L SDS中,振蕩均勻,5 000 r/min離心10 min后取上清液,按照體積比4∶1與上樣緩沖液(還原和氧化樣品溶解液)進行混合,沸水浴5 min,冷卻后上樣,上樣量為15 μL(Marker上樣量為10 μL)。其中分離膠質量分數為10%,濃縮膠質量分數為5%。15 mA恒流電泳,待樣品跑到分離膠后,電流調至25 mA,電泳時間約30 min。電泳結束后用考馬斯亮藍R-250進行染色,2 h后用脫色液于30 ℃條件下振蕩脫色,每30 min換一次脫色液,直至背景藍色脫凈后用凝膠成像系統拍攝電泳圖譜,再用Gene Tools數據處理軟件進行分析。
1.3.2.5 拉曼光譜分析
使用拉曼光譜儀進行測量。激發波長785 nm;激光出射功率30 mW;顯微物鏡為20 倍長焦距;光柵400 lines/mm;光闌為50 μm針孔;采集曝光時間8.0 s;樣品曝光20次。重復3 次。測試完成后用OMNIC軟件對拉曼光譜數據進行處理。根據苯丙氨酸環在1 003 cm-1附近伸縮振動的光譜強度作為內標進行歸一化處理(此峰強度不隨蛋白質結構的變化發生改變)[11]。肽鍵骨架振動和氨基酸的側鏈光譜條帶指認通過文獻報道進行比對得到。蛋白質二級結構(α-螺旋、β-折疊、β-轉角和無規卷曲)含量用高斯擬合方法進行計算得到。
1.4 數據分析
數據分析處理采用Excel 2013軟件進行數據處理,結果以表示,SPSS 17.0軟件進行Tukey顯著性分析和Pearson相關性分析,Origin 8.0軟件做圖,P<0.05表示差異顯著。
2 結果與分析
2.1 冷藏時間對鱔魚肉蒸煮失水率變化的影響
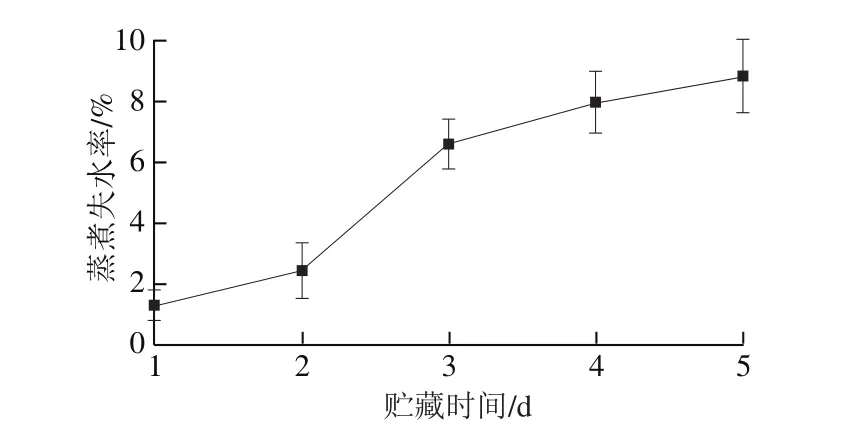
圖1 不同冷藏時間鱔魚肉的蒸煮失水率Fig.1 Change in moisture loss during cooking of Monopterus albus as a function of cold storage time
由圖1可知,隨著冷藏時間的延長,鱔魚肉的蒸煮失水率逐漸增加。鄭紅等[6]的研究結果表明,隨著冷藏時間的延長,生鮮鱔魚肉中蛋白間的主要化學作用力離子鍵和氫鍵逐漸被破壞,蛋白空間結構趨于松散,部分蛋白質降解。因此,在熟化過程中,貯藏時間越長的樣品越容易失水,即隨著貯藏時間的延長,熟化后樣品中蛋白質持水性降低。繆函霖等[12]的結果表明,金槍魚新鮮度越低,蒸煮失水率越高,與本實驗結果基本一致。因為隨著流失的水分從魚體內溶出,鱔魚肉質構可能發生變化[13];因此需對不同冷藏時間的樣品熟化后的質構特性進行研究。
2.2 不同冷藏時間的鱔魚肉經熟化后的質構特性
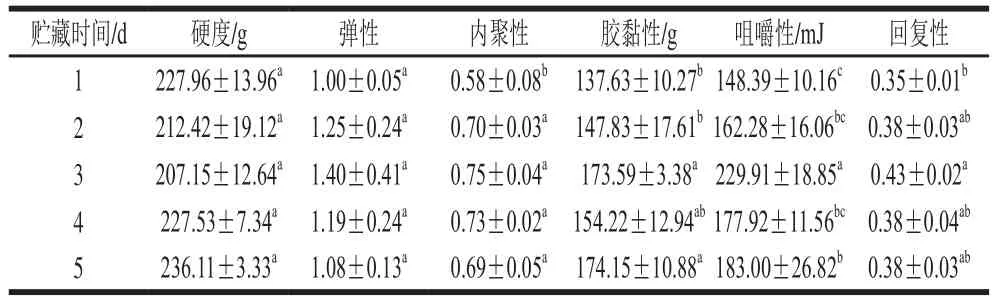
表1 不同冷藏時間的鱔魚肉經熟化后的質構特性Table1 Textural properties of cooked Monopterus albus as a function of cold storage time
由表1可知,冷藏時間對鱔魚肉熟化后相關質構指標有顯著影響(P<0.05)。硬度和彈性分別反映食品保持和恢復形狀的能力[14];與第1天相比,冷藏時間對鱔魚肉熟化后的硬度和彈性無顯著性影響(P>0.05)。內聚性和膠黏性可以部分反映細胞間結合力的大小[15];熟化鱔魚肉的內聚性和膠黏性分別在第2天和第3天顯著提高(P<0.05),貯藏時間的進一步延長對這兩個指標不再有顯著影響(P>0.05),這可能與不同冷藏時間鱔魚肉熟化后蒸煮失水率不斷增加有關,而后期隨著生鮮鱔魚自身蛋白結構的破壞,水分流失對其的影響減弱[16-17]。回復性和咀嚼性直接反映魚肉恢復其形狀的能力,可以部分反映食物口感[18];隨著冷藏時間的延長,鱔魚肉熟化后咀嚼性和回復性呈先升高后降低的趨勢,這可能與熟化后蛋白內部化學作用力變化及構象相關[19-20]。因此需進一步研究蛋白內部化學作用力變化,探討不同冷藏時間鱔魚肉熟化后相關質構指標變化的原因。
2.3 不同冷藏時間的鱔魚肉經熟化后的化學作用力變化
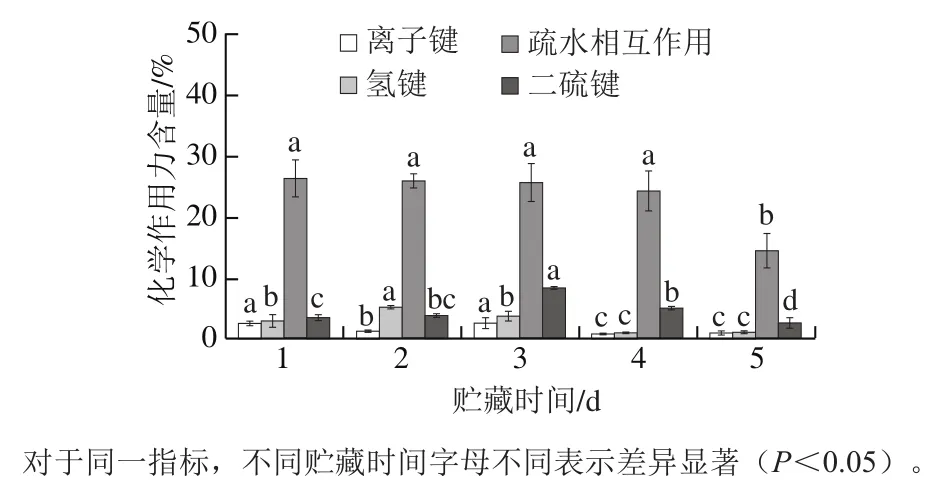
圖2 不同冷藏時間的鱔魚肉經熟化后的化學作用力Fig.2 Chemical forces of cooked Monopterus albus with different storage times
已有研究發現,冷藏期間維持生鮮鱔魚蛋白空間結構的主要作用力離子鍵和氫鍵含量總體呈下降趨勢,疏水相互作用含量呈現逐漸增加趨勢[6]。而加熱熟化會導致離子鍵和氫鍵破壞,蛋白發生較為強烈的疏水作用,使蛋白發生聚集;因此疏水相互作用成為熟化鱔魚肉蛋白間的主要作用力[21]。由圖2可知,疏水相互作用在貯藏4~5 d內顯著降低(P<0.05),這可能是由于貯藏至第5天,生鮮鱔魚肉蛋白降解程度更高,結構松散,導致蒸煮熟化后期形成的疏水相互作用部分被破壞[22]。除疏水作用外,二硫鍵是熟化鱔魚肉另一個較為主要的作用力。與生鮮鱔魚相比,熟化鱔魚肉的二硫鍵含量普遍有所降低,說明鱔魚加熱過程中以破壞二硫鍵為主[6]。隨著冷藏時間的延長,熟化鱔魚肉二硫鍵含量先增加后降低,這可能是貯藏過程中生鮮鱔魚蛋白構象變化引起熟化后巰基的暴露程度不同造成的[23-24]。同時,二硫鍵含量變化與熟化鱔魚肉咀嚼性和回復性變化趨勢一致,因此可推測二硫鍵的變化可能與熟化鱔魚肉質構特性改變有關。
2.4 化學作用力與質構特性之間的相關性分析
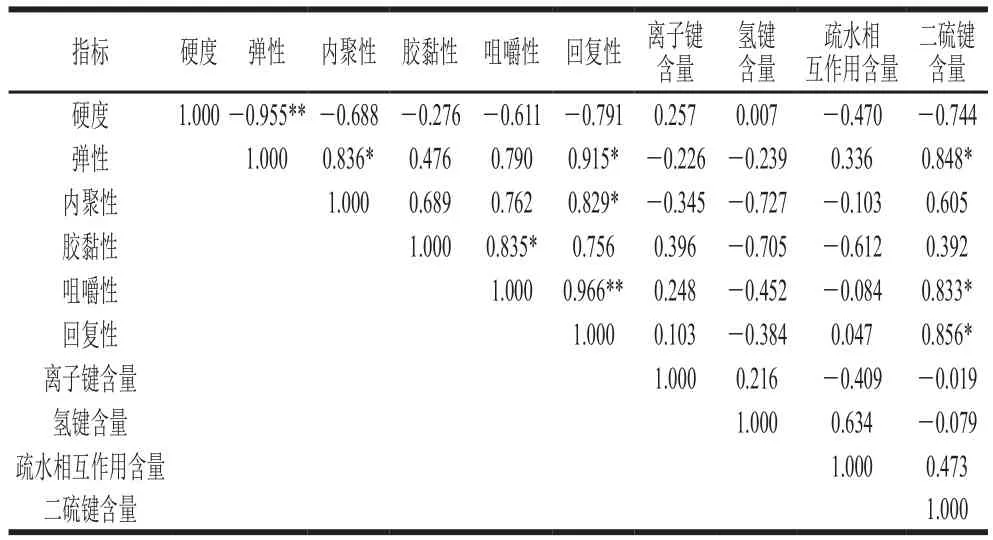
表2 貨架期內冷藏鱔魚熟化后化學作用力與質構特性之間的相關性Table2 Correlation analysis between chemical forces and textural properties of cooked Monopterus albus
由表2可知,冷藏期間,鱔魚肉熟化后二硫鍵含量與彈性、咀嚼性、回復性之間具有顯著正相關性(P<0.05)。這表明隨著冷藏時間的延長,二硫鍵與熟化鱔魚肉相關質構特性變化密切相關。冷藏1~3 d再熟化后的鱔魚肉,其二硫鍵含量隨冷藏時間的延長而增加,可能是因為熟化鱔魚肉不易流動水增加[25],使鱔魚肉的彈性、咀嚼性和回復性有所增加;而冷藏3~5 d內,貯藏時間越長的鱔魚肉,經熟化后其二硫鍵含量及疏水相互作用越低,蛋白結構變松散,魚肉持水性進一步降低,鱔魚肉彈性、咀嚼性和回復性下降。因此,冷藏過程中,鱔魚肉熟化后二硫鍵含量是影響其相關質構指標變化的主要因素。
2.5 不同冷藏時間的鱔魚肉經熟化后的全蛋白電泳圖譜
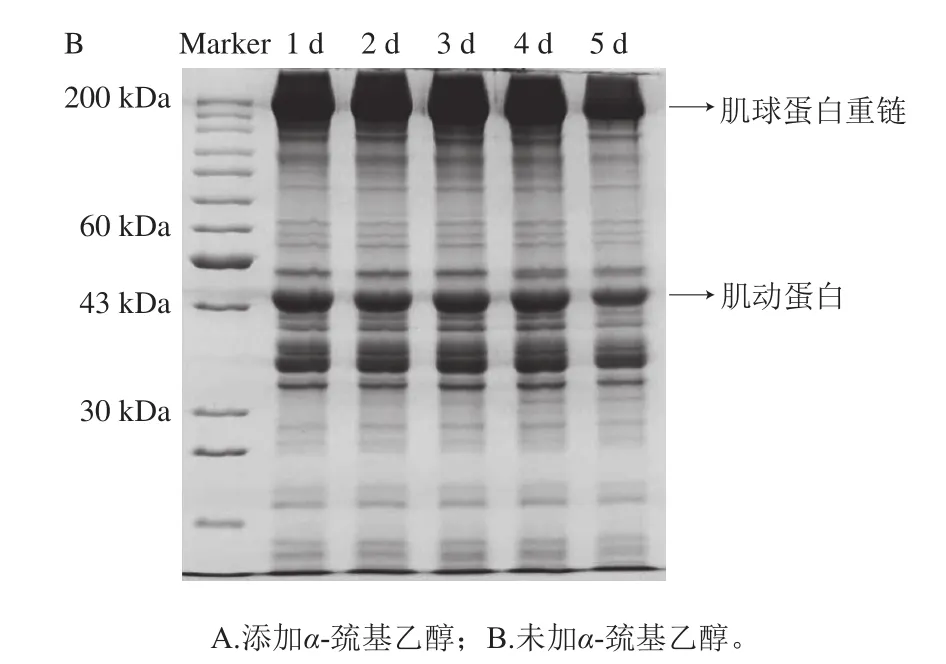
圖3 不同冷藏時間的鱔魚肉經熟化后全蛋白的SDS-PAGE圖的變化Fig.3 Change in SDS-PAGE pattern of total proteins from cooked Monopterus albus as a function of cold storage time
通過SDS-PAGE可以觀察蛋白交聯和降解情況,同時通過氧化型與還原型電泳圖譜對比可以了解二硫鍵的交聯情況。由圖3A可知,在還原型電泳圖譜中,隨著冷藏時間的延長,鱔魚肉中分子質量約43、200 kDa等主要蛋白條帶逐漸變淺,表明蛋白質發生了降解。由圖3B可知,在氧化型電泳圖譜中,分子質量約35、43 kDa的蛋白條帶強度先增加后降低,這與二硫鍵含量的變化趨勢基本一致,說明這幾個條帶中部分組分是通過二硫鍵交聯而成,這些組分可能會提高鱔魚肉的保水性。與氧化型電泳圖譜對比,觀察到還原型電泳圖譜中出現一些新的條帶,如分子質量約30 kDa的蛋白條帶,此外,分子質量低于30 kDa及分子質量約37、60 kDa的蛋白條帶變深且小分子條帶明顯增多。由此可推測這些蛋白組分可能參與了二硫鍵的形成,進而對熟化鱔魚肉的質構產生影響。
2.6 不同冷藏時間的鱔魚肉經熟化后的拉曼光譜分析
拉曼光譜不需要對樣品進行前處理,可以較好地反映魚肉自身蛋白結構的變化情況,因此常被用來測定魚肉蛋白結構的變化[26]。不同冷藏時間的鱔魚肉經熟化后的拉曼光譜見圖4。根據Herrero等[27-28]報道的方法進行拉曼譜帶的指認。
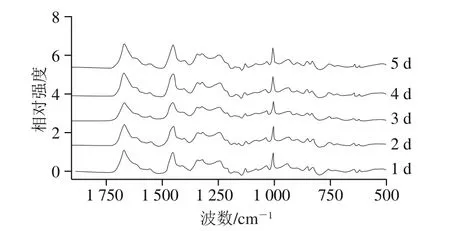
圖4 不同冷藏時間的鱔魚肉經熟化后的拉曼光譜(500~2 000 cm-1)Fig.4 Raman spectra of cooked Monopterus albus with different storage times in the range of 500-2 000 cm-1
2.6.1 不同冷藏時間的鱔魚肉經熟化后的蛋白質微環境變化
表3 不同冷藏時間的鱔魚肉經熟化后色氨酸(和酪氨酸比值)歸一化強度的變化Table3 Changes inand intensity ratio of Raman tyrosine doublet of proteins from cooked Monopterus albus with different storage times
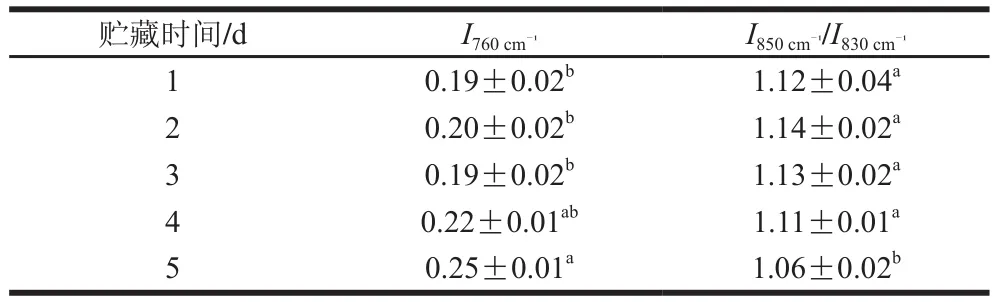
表3 不同冷藏時間的鱔魚肉經熟化后色氨酸(和酪氨酸比值)歸一化強度的變化Table3 Changes inand intensity ratio of Raman tyrosine doublet of proteins from cooked Monopterus albus with different storage times
貯藏時間/d I760 cm-1 I850 cm-1/I830 cm-1 1 0.19±0.02b 1.12±0.04a 2 0.20±0.02b 1.14±0.02a 0.19±0.02b 1.13±0.02a 4 0.22±0.01ab 1.11±0.01a 5 0.25±0.01a 1.06±0.02b 3
拉曼光譜中酪氨酸、色氨酸等疏水性殘基能夠表征蛋白質微環境的變化[29]。其中760 cm-1附近的條帶被認為是色氨酸環的伸縮振動引起的,當色氨酸殘基從包埋的疏水微環境暴露到極性環境,760 cm-1波數處的峰度下降[30]。830 cm-1和850 cm-1附近的2 個特征峰被稱為費米共振雙峰,根據的比值可以判斷蛋白質分子中酪氨酸殘基的暴露與包埋狀態,其中的比值在0.9~2.5時表明酪氨酸殘基暴露[31]。
2.6.2 不同冷藏時間的鱔魚肉經熟化后的蛋白二級結構含量變化
酰胺I帶(1 640~1 680 cm-1)主要源于肽鍵C=O的面內伸縮振動及N-H的面內彎曲振動,常常被用來估算蛋白質的二級結構信息[32]。拉曼光譜中,酰胺I帶主要由1 645~1 660 cm-1(α-螺旋)、1 660~1 665 cm-1(無規卷曲)、1 665~1 680 cm-1(β-折疊)等重疊的譜帶構成[33]。對酰胺I帶的計算結果進行去卷積和高斯擬合,得到各二級結構含量變化情況。
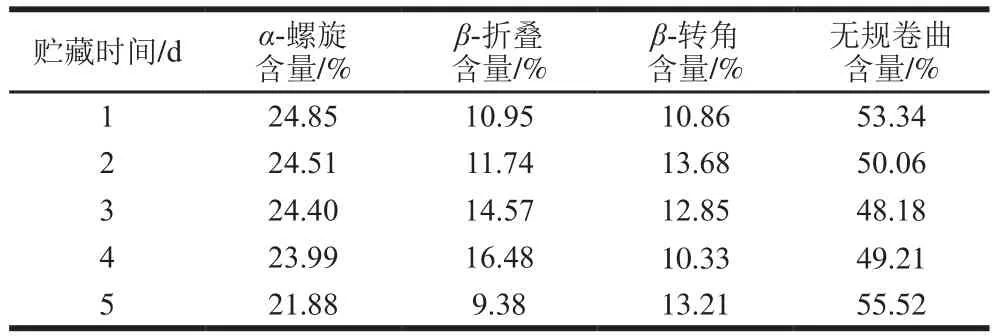
表4 不同冷藏時間的鱔魚肉經熟化后的蛋白二級結構含量Table4 Changes in secondary structure contents of cooked Monopterus albus with different storage times
由表4可知,不同冷藏時間的鱔魚肉經熟化后的蛋白二級結構相對含量以無規卷曲為主。冷藏的前3 d主要是α-螺旋和無規卷曲向β-組分轉化,后期則由α-螺旋和β-折疊結構轉化為β-轉角和無規卷曲。貯藏1~3 d范圍內,蛋白變性展開,蛋白質分子間通過形成的二硫鍵發生共價交聯,形成部分有序、粗糙的結構,α-螺旋和無規卷曲向β-轉角和β-折疊轉化。貯藏的3~5 d,生鮮鱔魚蛋白結構不穩定,更易降解;因此經加熱熟化后,鱔魚蛋白間二硫鍵及疏水相互作用被破壞,構象改變,導致α-螺旋和β-折疊結構逐漸轉化為β-轉角和無規卷曲,蛋白無序程度增加。
3 結 論
隨著冷藏時間的延長,鱔魚肉熟化后持水性有所降低,熟化鱔魚肉中二硫鍵的變化是造成不同冷藏時間的鱔魚肉熟化后彈性、咀嚼性和回復性變化的主要因素。SDS-PAGE結果顯示,分子質量約30、37、60 kDa及分子質量低于30 kDa等蛋白組分可能參與二硫鍵的形成,進而對熟化鱔魚肉的質構指標產生影響。拉曼光譜結果表明熟化鱔魚肉的色氨酸、酪氨酸殘基的疏水性降低,二級結構分析表明,冷藏的前3 d主要是α-螺旋和無規卷曲向β-轉角和β-折疊轉化,后期則由α-螺旋和β-折疊結構轉化為β-轉角和無規卷曲,蛋白無序化程度增加,蛋白構象發生改變。綜上所述,生鮮鱔魚肉冷藏及加熱后價鍵會發生變化,導致蛋白空間結構改變,進而造成不同冷藏時間的鱔魚肉熟化后相關質構指標變化。

