食源性細菌關鍵小分子信號通路研究進展
王飛飛,傅玲琳,鮑星月,劉長軍,張曉雙,王彥波,*
(1.浙江工商大學食品與生物工程學院,浙江食品質量安全工程研究院,浙江 杭州 310018;2.象山縣水產技術推廣站,浙江 象山 315700)
研究表明細菌是引起食品腐敗變質的重要原因,據統計全球約1/4的食品損失是由細菌等微生物單獨活動引起的[1],其導致了巨大的經濟損失和嚴重的公共衛生問題。自20世紀30年代以來,研究人員逐漸發現大多食源性致病菌能形成生物被膜,可以存在于食品加工廠包括塑料、玻璃、金屬和木材等各種表面;也可以在食品運輸和貯藏過程中形成,黏附在固體表面[2]。細菌在形成生物被膜后對化學殺菌劑和環境變化的敏感程度顯著降低,耐熱性也相應增加,可引起顯著的食品安全問題,最終導致嚴重的健康問題和經濟損失[3]。
研究表明細菌有兩種關鍵的小分子信號通路,包括群體感應(quorum sensing,QS)系統和環二鳥苷酸(cyclic di-guanosine monophosphate,c-di-GMP)系統,其在多種細菌的一系列生理功能中都起著重要調控作用,包括胞外酶分泌、毒力調節、生物被膜形成和細胞運動性等[4]。此外,近年來越來越多的研究報道了QS對食品腐敗的調控作用。QS通過自誘導物(autoinducers,AIs)的分泌、釋放、感應來調控細胞密度依賴的基因表達,使細胞的基因表達從低細胞密度的個體生活方式轉換為協同的高細胞密度狀態[5]。c-di-GMP系統可以將包括分子氧、氨基酸、電子、光子等環境刺激轉化為c-di-GMP信號[6],并由其效應分子核糖開關或/和受體蛋白介導調控基因表達完成信號轉導[7]。食源性細菌通過胞外AIs和胞內c-di-GMP這兩大類小分子信號來調控其生存狀態,從而影響食品的品質和安全。目前,有關QS和c-di-GMP信號通路的研究主要集中在醫藥和生物防治領域,在食品領域仍待進一步探究,鑒于此,本文綜述食源性細菌關鍵小分子信號通路研究進展,旨在提供保障食品品質和安全的控制靶點。
1 食源性細菌關鍵小分子信號通路概述
1.1 細菌QS概述
研究發現,細菌會通過細胞間的相互交流控制一系列的生命活動。細菌在生長過程中通過QS來調控相關基因的表達以促使自身更好地適應外界環境。QS依賴于被稱為AIs的信號分子的產生、分泌及應答,信號分子隨著細菌的生長在一定基礎水平上繼續產生和分泌,從而使環境介質中信號分子濃度達到一個閾值水平(即群體水平),并與細胞膜上或胞內的受體結合進而調控QS依賴的目的基因表達來誘導相應表型[8],這種細胞間的相互溝通方式被稱為QS。目前,可將已經鑒定到的信號分子歸為4大類:一是酰基高絲氨酸內酯(acylhomoserine lactone,AHL),其是一種脂肪酸的衍生物,被統一稱為AI-1,產生于革蘭氏陰性菌中,主要參與種內信號交流;二是呋喃硼酸二酯,產生于S-腺苷高半胱氨酸到同型半胱氨酸的循環過程中,被統稱為AI-2,可同時由革蘭氏陰性菌和陽性菌產生,并參與種內和種間的信號傳遞;三是AI-3,首次在腸出血性大腸埃希菌中發現,參與調控毒性因子的產生;四是自誘導多肽(autoinducing peptides,AIPs),存在于由革蘭氏陽性菌中[9]。細菌大多數QS調節的生理過程都是為了確保在一定環境下更高的存活率[10]。
大多數細菌利用兩種機制來檢測AIs并作出響應,從而調控靶向基因的表達。第一種機制以依賴AHL的QS系統為代表,存在于革蘭氏陰性菌中,AHL由LuxI型AHL合成酶產生,其受體是LuxR家族轉錄因子。LuxR-AHL復合物是一個二聚物,與受QS調控的啟動子保守回文序列結合,包括luxI自身的啟動子,激活AHL的產生(自誘導)以及其他靶基因的表達。在另一種機制中,信號分子則由膜雙組分應答調節系統檢測到,同時存在于革蘭氏陰/陽性菌中[11],如葡萄球菌屬(Staphylococcus)產生的信號多肽AIP。在該系統中,信號分子由膜上的感應器檢測并將信號轉導給胞內的反應調節子,通過調節性RNAs和轉錄因子來調控靶基因表達[12]。哈氏弧菌(Vibrio harveyi)的QS系統卻同時具備革蘭氏陰性菌和陽性菌的特征,既可以像革蘭氏陰性菌那樣產生并應答高絲氨酸內酯,也可以像革蘭氏陽性菌那樣通過膜結合的組氨酸激酶來實現信號轉導[11]。
1.2 細菌c-di-GMP概述
細菌c-di-GMP最初作為木醋桿菌(Gluconacetobacter xylinum)中纖維素合酶的變構激活劑而被發現[13]。c-di-GMP由兩個三磷酸鳥苷分子在二鳥苷酸環化酶(diguanylate cyclase,DGC)作用下合成,DGC包含由大約170 個氨基酸組成的GGDEF結構域[14]。相反地,c-di-GMP被特異性磷酸二酯酶(phosphodiesterase,PDE)降解,PDE包含由大約250 個氨基酸組成的EAL或HD-GYP結構域[15]。與QS機制不同的是,c-di-GMP有著多重信號通路,很多細菌都能編碼大量合成和降解c-di-GMP的蛋白,比如大腸桿菌K-12(Escherichia coli K-12)能編碼12 個含有GGDEF結構域的蛋白,10 個含有EAL結構域的蛋白,以及7 個同時含有這兩個結構域的蛋白[16]。其次,在細菌基因組中編碼GGDEF和EAL結構域蛋白的數量是高度可變的,從不編碼到編碼100多個蛋白不等。雖然這些結構域都是保守的,每個蛋白都有其獨特的N-末端感知域用來接收外界不同信號[17]。
目前已確認c-di-GMP在生物體內主要通過效應蛋白和mRNA核糖開關發揮作用。效應蛋白包括含PilZ結構域的蛋白,含有退化的GGDEF和EAL結構域蛋白以及轉錄調控因子[18]。mRNA核糖開關指mRNA 5’非編碼區的特定保守序列折疊成一定的構象,能專一性地與c-di-GMP結合并影響蛋白質翻譯。在G. xylinum中發現c-di-GMP能激活BcsA-BcsB纖維素合酶復合體從而增加胞外多糖基質的合成,經結構分析發現c-di-GMP能與BcsA蛋白C末端的PilZ結構域結合,這也是第一個被實驗證實的c-di-GMP受體蛋白。含PilZ結構域的蛋白分布非常廣泛,例如E. coli中調節細菌運動能力的YcgR和銅綠假單胞菌(Pseudomonas aeruginosa)中調節胞外藻酸鹽合成的AlgA。退化的GGDEF和EAL結構域蛋白指含有與GGDEF、EAL或HD-GYP類似的結構域,且不具有合成或降解c-di-GMP活性的蛋白,P. aeruginosa中發現的調控Pel多糖合成的內膜蛋白PelD和熒光假單胞菌(Pseudomonas fluorescens)中發現的調控生物被膜中胞外蛋白合成與分泌的LapD都屬于這類蛋白[7]。P. aeruginosa中的FleQ[19]和霍亂弧菌(Vibrio cholerae)中的FlrA[20]都是增強子結合蛋白,屬于c-di-GMP轉錄因子類型的效應蛋白。c-di-GMP是重要的細菌第二信使,被認為是各種生物體中形成和維持生物被膜的調節中心,控制著細胞在可運動的單細胞狀態與黏附的多細胞狀態之間的轉換[17]。
2 食源性細菌關鍵小分子信號通路對食品腐敗的調控
近年來,關于QS對食品腐敗調控方面的研究越來越多,目前已在各類食品中檢測到QS信號分子,包括牛奶和乳制品、肉和肉制品、海鮮和水產品、水果和蔬菜等。此外,QS對食品腐敗的調控也在一些研究中得到驗證。而細菌胞內小分子信號c-di-GMP對食源性細菌腐敗特性的調控及其機制還鮮有研究。以下將圍繞QS與食品腐敗展開討論。
牛奶中腐敗菌Pseudomonas spp.、Serratia spp.、腸桿菌屬(Enterobacter spp.)和Hafnia alvei的致腐能力與QS有關[21]。從包裝鱈魚片中檢出的N-(3-羥基)-L-高絲氨酸內酯(N-(3-hydroxyoctanoyl)-L-homoserine lactone,3-OH-C8-HSL)能夠調節明亮發光桿菌(Photobacterium phosphoreum)和氣單胞菌屬(Aeromonas spp.)的幾丁質酶活性,表明AHL型QS系統可能在甲殼類動物的腐敗中發揮作用[22]。從熏制鮭魚里分離出來的變形斑沙雷氏菌(Serratia proteamaculans)B5a菌株,其胞外酶活性受AHL信號分子調節[23]。同樣地,N-丁酰基-L-高絲氨酸內酯(N-butanoyl-L-homoserine lactone,C4-HSL)能增加嗜冷假單胞菌(Pseudomonas psychrophila)PSPF19菌株胞外酶的產量并提高其在冷藏淡水魚中的致腐能力[24]。另外,豆芽的細菌性腐敗也受QS系統影響[25]。從生鮮蔬菜加工線分離的樸立茅次沙雷菌(Serratia plymouthica)RVH1菌株中的LuxI的同系物SplI,負責調控C4-HSL、N-己酰-L-高絲氨酸內酯(N-hexanoyl-L-homoserine lactone,C6-HSL)和N-(3-O-己酰基)-L-高絲氨酸內酯(N-(3-oxohexanoyl)-L-homoserine lactone,3-oxo-C6-HSL)的產生。S. plymouthica胞外幾丁質酶、核酸酶以及蛋白酶的產生與SplI型的QS系統有關[26]。在S. plymouthica RVH1菌株的SplI突變體中,這些胞外酶的產量減少,只有通過添加C6-HSL或3-oxo-C6-HSL才能恢復[27]。在與黃瓜腐病相關的黏質沙雷菌(Serratia marcescens)MG1菌株和沙雷氏菌(Serratia sp.)ATCC 39006菌株中,其與腐敗有關的胞外酶的分泌分別受SwrI/SwrR QS系統及其同源物質C4-HSL、SmaI/SmaR QS系統及其同源物質C4-HSL和C6-HSL的調節[26,28-29]。最近,一系列環二肽分子(diketopiperazines,DKPs)在多種革蘭氏陰性菌中被檢出,且被報道具有調控AHL型QS能力[30]。研究發現DKPs能促進腐敗希瓦氏菌(Shewanella putrefaciens)和/或波羅地海希瓦氏菌(Shewanella baltica)生物被膜的形成[31-32]、氧化三甲胺還原酶(trimethylamine N-oxide reductase A,torA)和鳥氨酸脫羧酶(ornithine decarboxylase,ODC)的基因表達[32],以及揮發性鹽基氮、三甲胺、腐胺和胞外蛋白酶的產生[31-33]。因此,DKPs被認為是新型QS信號分子[34]。本課題組研究發現,S. baltica中DKPs能與LuxR型受體直接結合從而調控氧化三甲胺還原酶調節蛋白TorS,誘導型鳥氨酸脫羧酶SpeF和鞭毛馬達蛋白PomA的表達,進而影響三甲胺、腐胺和生物被膜的形成。上述研究初步確認了QS系統對食品腐敗菌致腐能力的調控作用,但QS調控腐敗菌致腐能力以及生物被膜形成能力的分子機制仍有待進一步研究。
3 食源性細菌關鍵小分子信號通路對生物被膜的調控
由食源性疾病引發的食品問題已成為我國目前主要的食品安全問題,其中,微生物是主要食源性疾病病原。食源性致病菌形成復雜和多層結構的生物被膜有助于細菌群落在靜止和安全的環境中生存而不容易被徹底清除,從而使其得到擴散蔓延,影響食品安全。
3.1 細菌QS與生物被膜形成
研究表明無法合成N-(3-O-十二酰基)-L-高絲氨酸內酯(N-(3-oxododecanoyl)-L-homoserine lactone,3-oxo-C12-HSL)的P. aeruginosa lasI突變株只能形成平坦、未分化的生物被膜,并且對十二烷基硫酸鈉的分散作用更敏感[35],該研究首次將QS與生物被膜形成聯系起來。目前普遍認為QS在食源性細菌生物被膜形成中起著重要作用。
Cloak等在從牛奶和雞湯中分離出來的空腸彎曲桿菌(Campylobacter jejuni)中檢出了AI-2,并在其基因組中找到了編碼AI-2合成酶的基因luxS[36]。研究發現C. jejuni的luxS突變株與野生株相比生物被膜形成減少,添加野生株的無菌24 h培養上清液促進了生物被膜的形成[37]。嗜水氣單胞菌(Aeromonas hydrophila)AHL合成酶ahyI突變株由于不能合成C4-HSL,不能形成成熟的生物被膜。此外,在A. hydrophila中發現了一個LuxR型受體能與AHL結合從而調控ahyR突變株生物被膜的形成,這說明QS能調控A. hydrophila的生物被膜形成[38]。蠟樣芽孢桿菌(Bacillus cereus)QS系統包括LuxR型受體PlcR和LuxS/AI-2系統,plcR突變株形成的生物被膜比野生株多約4 倍[39]。外源添加AI-2降低了B. cereus野生株生物被膜的形成,添加AI-2到B. cereus已形成的生物被膜中導致被膜分散[40]。因此,PapR和AI-2對B. cereus生物被膜的形成具有負調控作用。單增李斯特菌(Listeria monocytogenes)具有LuxS/AI-2系統,其luxS突變株形成的生物被膜比野生株厚4 倍,故AI-2對L. monocytogenes生物被膜形成具有負調控作用[41]。E. coli QS系統包括LuxS/AI-2系統和LuxR型受體SdiA,外源添加AI-2增加了E. coli K-12野生株的生物被膜形成[42],SdiA突變株的生物被膜形成比野生株增加好幾倍,外源添加的AHL通過與SdiA受體結合從而抑制生物被膜形成[43]。鼠傷寒沙門氏菌(Salmonella enterica serovar Typhimurium)也有LuxS/AI-2系統,luxS突變株不能形成成熟的生物被膜,當進行luxS基因回補時其生物被膜得以恢復[44]。V. cholerae在高細胞密度時的生物被膜形成主要受LuxR型轉錄因子HapR調控,hapR突變株生物被膜形成增加[45]。創傷弧菌(Vibrio vulnificus)luxR型基因smcR突變株的生物被膜形成比野生株增加了大約5 倍[46]。P. aeruginosa有2 套LuxR/LuxI系統,即LasR/LasI和RhlR/RhlI,lasI和rhlI突變株形成的生物被膜較野生株顯著減少[47],lasI和rhlI突變株中控制基質胞外多糖合成的pel操縱子的轉錄受到了抑制[48]。此外,6-姜酚可以通過與P. aeruginosa中的3-oxo-C12-HSL競爭結合LasR受體從而減少生物被膜的形成[49]。以上研究均在一定程度上說明了QS對細菌生物被膜形成的調控作用,包括正調控和負調控。但是有關QS對食品腐敗菌生物被膜形成的調控研究仍停留在表型,需要進一步挖掘其調控分子機制,為消除腐敗菌生物被膜和開發新型食品保鮮劑提供新思路。
3.2 細菌c-di-GMP與生物被膜形成
細菌c-di-GMP在生物被膜形成中的作用首次在2002年由2 個團隊分別提出,Boles[50]和D’Argenio[51]等分別在副溶血性弧菌(Vibrio parahaemolyticus)和P. aeruginosa中通過突變或/和過表達技術發現了影響生物被膜形成的GGDEF和EAL結構域蛋白。目前,胞內c-di-GMP濃度與生物被膜形成和細胞運動性之間的相關性已在多種細菌中被證明,如E. coli、P. aeruginosa、V. cholerae、A. hydrophila等,這些細菌也是食品中常見的致病菌,極易造成食品污染并給消費者帶來不同程度的危害。細菌c-di-GMP普遍抑制細菌運動性并刺激生物被膜形成,刺激細菌黏附素和細胞外基質組分的合成,此外,參與某些致病菌急性感染的毒力基因表達被c-di-GMP下調,而慢性感染通常與高c-di-GMP水平和生物被膜形成相關[52]。本文圍繞擁有典型c-di-GMP通路的E. coli、P. aeruginosa和V. cholerae展開討論。
3.2.1 E. coli生物被膜形成機制
YhjH是E. coli的一個具有高效PDE活性的蛋白,與DGC活性蛋白YegE和YedQ共同控制E. coli整體c-di-GMP水平,主要負責調控細胞運動性[53]。在生長對數期,YhjH通過保持低水平的c-di-GMP來維持鞭毛運動性,進入穩定期后,由于YhjH的表達下調,c-di-GMP水平增加[54],使得c-di-GMP效應蛋白YcgR活化并與鞭毛馬達相互作用抑制其活性[53,55]。因此,在生長的大腸桿菌細胞中,YhjH通過保持細胞c-di-GMP的濃度低于能夠激活YcgR的閾值水平而在維持細胞運動性方面起著核心作用。另一個c-di-GMP調節體系由DGC活性蛋白YdaM和PDE活性蛋白YciR組成,ydaM和yciR基因缺失株嚴重影響csgD轉錄,即影響關鍵生物被膜形成調節因子的表達,從而影響卷曲菌毛合成而不影響細胞運動性,這與yegE和yhjH基因缺失株的表型相反[54]。研究表明,YegE/YhjH和YdaM/YciR以級聯的方式運作共同決定c-di-GMP水平,YciR作為具有雙功能的觸發酶,其降解c-di-GMP的酶活性功能與通過互作直接抑制YdaM功能相互干涉。因此,當胞內c-di-GMP水平較高時,YciR顯示PDE活性從而減輕對YdaM的抑制作用,使其能發揮DGC活性產生c-di-GMP,同時YdaM作為雙功能蛋白通過與轉錄因子MlrA直接互作,從而促使csgD轉錄,影響生物被膜形成[56]。
3.2.2 P. aeruginosa生物被膜形成機制
在P. aeruginosa中,至少有5 個DGC活性蛋白可以調控細胞從可運動狀態到生物被膜形成,分別為WspR、SadC、RoeA、SiaD和YfiN。相反,DGC活性蛋白GcbA和NicD以及PDE活性蛋白DipA、RbdA和NbdA與生物被膜分散有關[57]。關于DGC活性蛋白的第一個生化特征研究源自于GGDEF蛋白WspR,WspR通過調節胞外多糖的合成來控制生物被膜形成。WspR發揮作用經歷3 個過程:首先,當感應到表面黏附生長時,Wsp信號轉導復合物使WspR磷酸化并觸發c-di-GMP的合成[58];接著,WspR磷酸化觸發亞細胞WspR寡聚成簇,進一步增加了DGC的活性[59];最后,WspR的活性受到c-di-GMP的反饋抑制。除了WspR,另外一個DGC活性蛋白YfiN作為膜錨定蛋白也能促進胞外多糖pel和psl操縱子的表達[60]。在P. aeruginosa中,很多轉錄因子被確認為c-di-GMP受體,即能檢測細胞內c-di-GMP水平,并將此信息轉化,使特定細胞應答/信號轉導途徑激活。當胞內c-di-GMP水平較低時,FleQ作為增強子結合蛋白是鞭毛基因表達的主要激活因子[19],當c-di-GMP水平上升時,c-di-GMP與FleQ的結合將其作為參與產生胞外多糖和黏附素的pel、psl和cdr基因的阻遏物轉化為激活劑,從而促進生物被膜的形成[61]。另一個響應c-di-GMP的轉錄因子是BrlR,BrlR可以通過上調編碼多藥外排泵基因的表達從而增加生物膜細胞對抗菌劑的抗性[62]。此外,BrlR對c-di-GMP的結合親和力比FleQ要強,與FleQ相比,BrlR在較低的c-di-GMP水平和生物被膜發育過程的較早階段發揮作用[63]。
3.2.3 V. cholerae生物被膜形成機制
在V. cholerae中,c-di-GMP主要通過抑制細胞運動并促進生物被膜基質產生來控制生物被膜的形成,總的來說,c-di-GMP隨著細胞密度增加而減少。系統研究表明,缺失DGC活性蛋白CdgD(VCA0697)、CdgH(VC1067)、CdgK(VC1104)或CdgL(VC2285)可以增強其運動性[64];相反,缺失PDE活性蛋白RocS(VC0653)或CdgJ(VC0137)抑制其運動性[64-65];而缺失DGC活性蛋白CdgA(VCA0074)、CdgH、CdgK、CdgL、CdgM(VC1376)和VpvC以及PDE活性蛋白RocS、CdpA(VC0130)、CdgJ、MbaA(VC0703)、CdgC(VCA0785)和VC1851的突變株通過影響多聚糖基因vps的表達來調節生物被膜的形成[66-67]。c-di-GMP在轉錄水平上調控鞭毛相關基因,FlrA作為P. aeruginosa中FleQ的同源蛋白,是V. cholerae決定細胞運動性的鞭毛生物合成操縱子flrBC的轉錄因子,當其與c-di-GMP結合后其活性受損,從而使細胞運動性減弱[20]。另外,MshA亞基聚合形成的菌毛控制V. cholerae的表面附著能力,亞基聚合需要由ATP酶MshE提供能量,而MshE的激活需要c-di-GMP的結合,mshE或mshA基因缺失會使細菌喪失初始表面附著能力,表明c-di-GMP介導的MshA菌毛的合成是生物被膜形成的關鍵早期步驟[68-70]。c-di-GMP還可以通過與VpsR(VC0665)和VpsT(VCA0952)結合在轉錄水平上激活VPS的生物合成以及其他生物被膜基質蛋白的表達[71]。
4 細菌QS與c-di-GMP調控網絡
細菌QS和c-di-GMP信號通路在細菌中具有廣泛的保守性,而且在生物被膜形成、毒力因子合成以及其他相關生理過程中都發揮著關鍵作用,這暗示著這兩條信號通路之間存在某種聯系。V. cholerae作為一種食源性細菌,是研究QS和c-di-GMP的典型菌株,目前對V. cholerae中QS和c-di-GMP通路之間的調控網絡研究也比較透徹,鑒于此,本文以V. cholerae為代表討論QS和c-di-GMP通路之間的調控關系。
在V. cholerae中,QS對c-di-GMP的調控體現在多個水平。具有QS調節活性的同源(quorum regulatory,Qrr)sRNA可以直接促進編碼DGC活性蛋白VCA0939的mRNA翻譯,而不依賴于中心調節子HapR。Qrr sRNA對VCA0939的誘導作用與低細胞密度下更高的c-di-GMP水平相符,但VCA0939缺失株的生物被膜形成情況較野生株無明顯變化,因為僅一個DGC活性蛋白的缺失并不能對一個復雜的c-di-GMP信號通路造成很大的影響[72],對于VCA0939的活性還有待進一步研究。Qrr sRNA的下游分子也能影響c-di-GMP的產生,高細胞密度時HapR的表達控制著14個GGDEF結構域蛋白/EAL結構域蛋白和4個HD-GYP結構域蛋白的轉錄,最終導致細胞c-di-GMP水平下降,從而使vps表達下降[73-74]。相反,hapR基因突變導致c-di-GMP水平上升,使菌落形態發生從光滑到多皺的轉變[74]。低細胞密度時AphA也控制著一系列DGC活性蛋白和PDE活性蛋白的表達[75]。除了在多層面上對c-di-GMP產生的直接調控,QS和c-di-GMP信號通路能共同合作控制V. cholerae中2 個關鍵轉錄因子AphA和VpsT的表達。c-di-GMP可以通過與受體VpsR結合形成復合物從而激活aphA的轉錄[76],由于AphA是低細胞密度下QS的主要轉錄因子,而低細胞密度時c-di-GMP水平較高,因此這條通路具有實際意義。研究發現在aphA的啟動子中有HapR和VpsR的重疊結合位點,而且兩者的結合是相互排斥的[77],這很好地解釋了aphA在低細胞密度時能被c-di-GMP激活,而在高細胞密度時被HapR抑制的情況,從而共同確保AphA在低細胞密度中的表達。與aphA類似,vpsT的表達也同時受HapR和VpsR的調控,在vpsT的啟動子中發現了HapR和VpsR的重疊結合位點[74,76]。由此可知,V. cholerae整合QS和c-di-GMP兩個信號通路形成調控網絡,從而將多個環境信號轉化成vpsT和aphA的表達。
除了V. cholerae,QS和c-di-GMP的聯系在其他食源性細菌中也有相關闡述。P. aeruginosa中的酪氨酸磷酸酶(protein tyrosine phosphatase,TpbA)可以對GGDEF結構域蛋白TpbB進行去磷酸化,從而抑制其活性,減少生物被膜形成。TpbA受Las-QS系統調控,因此,QS對c-di-GMP的產生具有負調控作用[78]。在A. hydrophila中,過表達DGC活性蛋白對生物被膜形成的誘導依賴于完整的AI-2 QS系統[79],食源性細菌中QS與c-di-GMP這兩個關鍵小分子信號分子之間的調控關系見圖1,但是這2 個通路是如何互作從而影響生物表型還有待進一步研究。
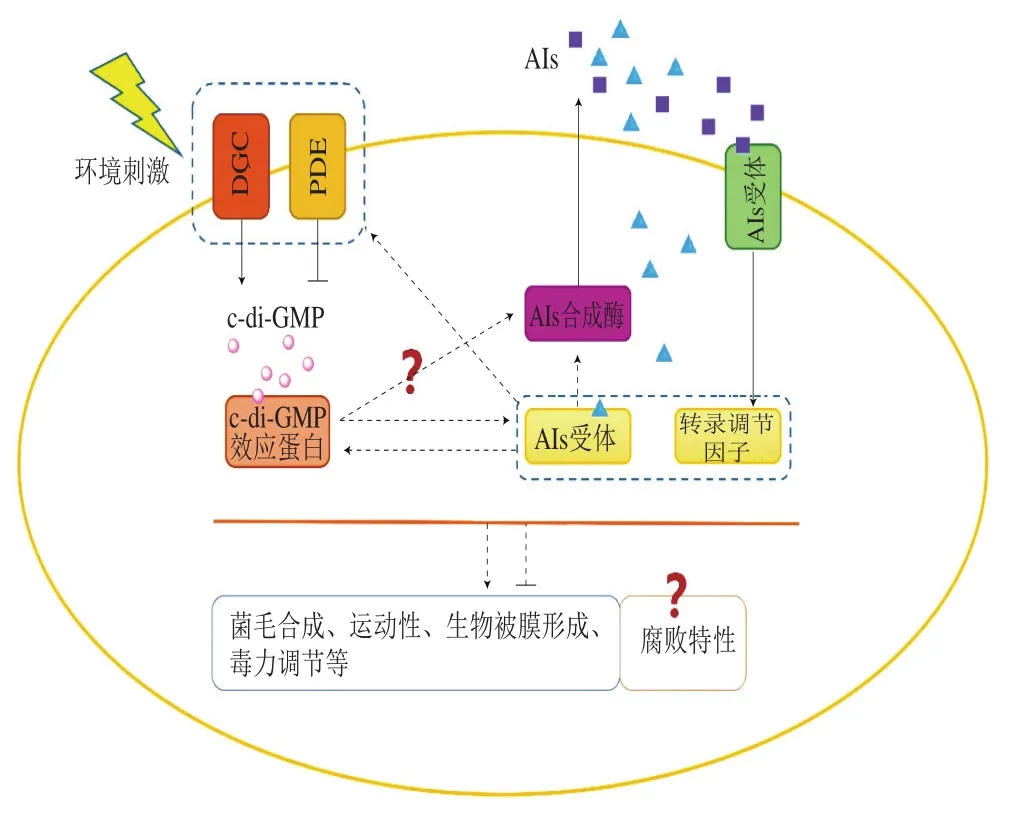
圖1 食源性細菌關鍵小分子信號通路QS與c-di-GMP調控網絡Fig.1 Regulatory network between QS and c-di-GMP signaling pathways in foodborne bacteria
5 結 語
細菌活動是引起食品品質變化與安全問題的重要原因。雖然在很多變質的食物(肉、奶、魚、果蔬等)中檢測到了QS信號分子,意味著QS在調控食品變質中發揮一定作用,但它們在食物變質中所起的確切作用目前尚不明確。對于食源性細菌中QS和c-di-GMP系統在食品腐敗和生物被膜形成方面的作用及其作用機制仍需進一步研究。有研究表明,早前涉及細菌致病機制的QS系統也可能在食品腐敗中發揮作用,這為研究基于QS的食品腐敗提供一定的參考。對于c-di-GMP通路,在食源性腐敗菌中還鮮有研究,但是在很多食品腐敗菌的基因組中同樣存在著編碼DGC和PDE活性蛋白的基因序列,這意味著食品腐敗菌的相關生理特性也可能受c-di-GMP通路調控,甚至QS與c-di-GMP通路形成調控網絡共同決定腐敗菌的致腐能力及生物被膜形成。了解食物生態系統中的QS和c-di-GMP通路以及兩個信號通路之間的調控網絡,有助于進行關鍵基因的靶向控制,即充分利用現有技術不斷發現或合成QS及c-di-GMP調控劑,從而高效特異地抑制目標食源性細菌的致腐和致病能力,解決食物品質與安全問題。

