基于簇毛麥No.1026轉錄組的SSR序列分析及其PCR標記開發
陳竟男,馬曉蘭,王振,李仕金,謝皓,葉興國,林志珊
?
基于簇毛麥No.1026轉錄組的SSR序列分析及其PCR標記開發
陳竟男1,2,馬曉蘭1,王振3,李仕金1,謝皓2,葉興國1,林志珊1
(1中國農業科學院作物科學研究所/農作物基因資源與基因改良國家重大科學工程/農業部麥類生物學與遺傳育種重點實驗室,北京 100081;2北京農學院植物科學技術學院,北京 102206;3北方民族大學生物工程與科學學院,銀川 750021)
【目的】探究從前蘇聯引進的簇毛麥No.1026(Dv#4)的EST-SSR序列特征及其在染色體的分布,分析它們在不同簇毛麥間及與小麥間的多態性,為其進一步的研究與利用提供依據。【方法】通過Illumina HiSeq測序獲得No.1026植株的轉錄組序列,利用MISA軟件分析轉錄組SSR序列及特征,采用Primer 3設計SSR引物,隨機合成238對引物,對小麥中國春與簇毛麥Dv#4和引自英國劍橋的簇毛麥Dv#2的基因組DNA進行擴增,在瓊脂糖凝膠上分離評價擴增產物的多態性,并利用一套小麥-簇毛麥異染色體系進行擴增分析。【結果】檢測了No.1026總長62.76 Mb的轉錄組序列,發現10 497個SSR位點,它們分布于8 735條Unigene上。在1—6個核苷酸的重復單元中,單、雙、三堿基的重復占95.85%,其中三核苷酸串聯重復數量最多,占SSR總數的50.33%,而CCG/CGG基序的重復占三核苷酸串聯重復的41.66%;單核苷酸重復是第二大類型,出現頻率為27.13%,其中A/T重復占單核苷酸重復的74.58%。二核苷酸重復類型的數量位列第三,占SSR總數的18.39%。在238對EST-SSR引物中,88對在中國春與簇毛麥(包括Dv#2和Dv#4)之間的擴增產物顯示多態性;8對只在簇毛麥和單一異染色體系擴增;4對可在簇毛麥和多個異染色體系中特異擴增;但多數可在簇毛麥中清晰擴增的引物不能在任何異染色體系中擴增,推測可能與簇毛麥基因組及染色體導入小麥過程中的變異有關;47對(19.74%)在2份不同來源的簇毛麥Dv#2和Dv#4之間的擴增產物呈現多態性。利用1對EST-SSR引物和1個EST-PCR標記檢測48個簇毛麥植株,證明多態性的SSR引物可有效用于檢測簇毛麥的異質性。【結論】簇毛麥No.1026(Dv#4)的轉錄組中存在豐富的SSR序列,其中CCG/CGG、A/T和AG/CT等三核苷酸、單核苷酸和二核苷酸是其最主要的串聯重復基序。部分EST-SSR的側翼保守序列與單一或若干外源染色體特異相關聯,據此開發特異的分子標記,可用于跟蹤檢測小麥背景中特異的簇毛麥染色體或染色體片段。Dv#4與Dv#2間的部分EST-SSR具有多態性,提示2份不同來源簇毛麥的表達序列間存在一定程度的遺傳差異,因此,簇毛麥Dv#4值得進一步的發掘研究。
簇毛麥;轉錄組;EST-SSR;異染色體系;染色體定位;遺傳多樣性
0 引言
【研究意義】簇毛麥((L.) P. Candargy, syn.Schur)是小麥的二倍體近源種屬(2n=2x=14,VV),為一年生異花授粉植物,主要分布于地中海的東北部和高加索地區[1]。由于簇毛麥表現出許多生物脅迫的抗性(如抗條銹、稈銹、白粉、梭條花葉病毒病、癭螨等多種小麥主要病蟲害)和非生物脅迫抗性(如耐寒、耐鹽、抗旱),同時擁有分蘗力強、生長繁茂、多小花、籽粒蛋白質含量高等重要農藝性狀[1-3],因此,受到廣泛關注,并被認為是小麥改良的潛在優異基因源。【前人研究進展】前人利用不同來源的簇毛麥開展了有益基因導入小麥的研究,培育了硬粒小麥-簇毛麥雙二倍體[4-6]、普通小麥-簇毛麥異附加系、異代換系和易位系[6-10],鑒定了位于6V#2S和6#4S上的白粉病抗性基因[7-10],并克隆了主效抗病基因[11-12]。Zhang等[13]培育了抗小麥梭條花葉病毒病的T4VS.4DL易位系,將抗梭條花葉病毒病基因定位在4VS上。Zhao等[14]進一步利用CSph1b誘導獲得4VS小片段易位,將定位在4VS染色體臂近端部FL為0.78—1.00區間。研究還表明,簇毛麥所特有的護穎穎脊剛毛的形態特征由2V染色體短臂上的基因所控制[15],而1V、5V染色體分別攜帶高分子量麥谷蛋白亞基(HMW-GS)基因和籽粒軟質基因。此外,5V還具有成株期的白粉病抗性,它們已被導入普通小麥,分別育成T1DL·1VS、T1DS·1VL和T5VS·5DL易位系[16-18]。Qi等[19]利用一套源于簇毛麥Dv#3,并由Lukaszewski培育的小麥-簇毛麥二體異附加系進行鑒定,發現DA6V#3對銹病小種Ug99表現出較好的抗性,開發了7對6V#3特異的EST–STS標記用于從6D和6V#3染色體雙單體的F2群體中篩選易位系,并在F3世代獲得生長和育性正常的純合易位系T6AS.6V#3L和T6AL.6V#3S,隨之將抗銹病相關的基因定位于染色體長臂6V#3L,命名為。是一個溫敏型基因,其作用在16℃最有效,而28℃失效。【本研究切入點】上述研究所涉及的簇毛麥大多來源于Dv#2以及Dv#3,而從前蘇聯引進的簇毛麥No.1026(Dv#4)除了6V#4染色體代換系及6V#4S.6DL易位系外,涉及其他染色體性狀的研究鮮見報道。而且,盡管先前的研究表明,6V#4與6V#2間在病蟲抗性[20]、染色體結構[21]、基因序列[22-26]間均存在多態性,但不同來源的簇毛麥基因組間的多態性還缺少深入研究。據報道,SSR標記的多態性明顯高于其他類型的分子標記[27-28],但傳統開發SSR標記引物過程繁瑣,需要構建文庫、篩選重復序列、測序等環節,成本高,時間長[29]。近年來,隨著測序技術的發展及成本的下降,利用EST或轉錄組序列開發SSR標記變得更為簡便快速[30-31]。因此,EST-SSR標記目前已被廣泛應用于植物的遺傳連鎖圖譜構建[32]、種質資源的遺傳多樣性分析[33-34]等研究。【擬解決的關鍵問題】本研究利用簇毛麥No.1026轉錄組測序數據分析表達序列中的SSR序列及特征;基于側翼保守區序列設計引物,分析EST-SSR序列在不同簇毛麥間的多態性;利用一套小麥-簇毛麥附加系或代換系對這些標記進行染色體定位;篩選在小麥中國春與簇毛麥間具有多態性的標記,為No.1026的進一步研究和利用奠定基礎。
1 材料與方法
1.1 植物材料
材料包括2份不同來源的簇毛麥:英國劍橋引進的簇毛麥和前蘇聯引進的簇毛麥No.1026,按照對不同來源簇毛麥的區分方法[35,10],分別用Dv#2和Dv#4表示。2份簇毛麥的種子均由中國農業科學院作物科學研究所陳孝研究員保存并提供,其中,源于英國劍橋的簇毛麥Dv#2原由南京農業大學陳佩度教授惠贈;小麥-簇毛麥異附加系DA2V#2、DA3V#2、DA4V#2、DA5V#2、DA6V#2和DA7V#2由南京農業大學王秀娥教授惠贈;江蘇里下河地區農業科學研究所別同德博士提供了小麥-簇毛麥異代換系1V#2(1D)的DNA。為方便描述,本文將上述異附加系與異代換系統稱為異染色體系,用于EST-SSR的染色體定位分析。中國農業科學院作物科學研究所小麥抗逆分子育種課題組收集保存的小麥品種中國春為對照。
1.2 轉錄組數據獲得及EST-SSR引物設計
轉錄組數據來源于筆者所在實驗室2016年對前蘇聯簇毛麥No.1026(Dv#4)進行高通量測序的結果[25-26]:取溫室盆栽的植株成株期葉片,利用Trizol法提取RNA,委托北京諾禾致源生物信息科技有限公司完成cDNA文庫構建和HiSeq測序。使用軟件MISA(27/09/2010)http://pgrc.ipk-gatersleben.de/misa/misa.html進行SSR分析:設定各個重復單元的最少重復次數分別為1—10、2—6、3—5、4—5、5—5和6—5,即:以單核苷酸為重復單元時,其重復數至少為10次才可被檢測到;以雙核苷酸為重復單元時,其最少重復數為6次;以三、四、五、六核苷酸為重復單元的重復次數均需達到5次以上。找出SSR序列之后,采用Primer3進行SSR引物設計。
1.3 DNA提取及其引物擴增條件
采用DNA提取試劑盒(北京康為世紀生物科技有限公司)按說明書提取每份材料新鮮葉片的基因組DNA,并稀釋成100 ng·μL-1,4℃保存備用。238對隨機選取的EST-SSR引物由生工生物工程(上海)股份有限公司合成。先用中國春、DV#2、DV#4的DNA進行引物初篩選;對小麥與簇毛麥擴增產物間具有多態性的引物進一步用一套DV#2異附加系進行擴增,分析RST-SSR位點的染色體分布。PCR擴增體系為MIX 7.5 μL、上下游引物各0.5 μL、模板1 μL和dd H2O 5.5 μL,混合均勻后置于PCR儀(T100-Thermal Cycler, BIO-RAD)中擴增。擴增程序為95℃5 min;94℃30 s,54—60℃30 s(退火溫度因不同引物而異),72℃1 min,34個循環;72℃8 min,4℃保存。
2 結果
2.1 源于簇毛麥Dv#4轉錄組數據的SSR序列構成特性分析
在總長62.76 Mb的轉錄組47 384條序列中,共檢測到10 497個SSR位點,平均每5.98 kb有1個位點,它們分布于8 735條Unigene上。其中含有1個以上SSR位點的Unigene有1 442條。SSR有單一型和混合型2種類型,單一型重復基序的SSR位點數9 979個,混合型重復基序的位點數為518個。SSR包括單堿基重復2 848個、雙堿基重復1 930個、三堿基重復5 283個、四堿基重復394個、五堿基重復36個和六堿基重復6個(表1)。可見,1—3個堿基重復是No.1026轉錄序列中主要的SSR重復類型,而三核苷酸串聯重復數量最多,占SSR總數的50.33%,其構成基序主要有CCG/CGG、AGG/CCT、AGC/CTG、ACC/GGT、AAG/CTT、ACG/CGT等10種,其中CCG/CGG基序占三核苷酸串聯重復的41.66%。單核苷酸重復類型排列第二位,其出現頻率為27.13%,其中A/T重復明顯多于G/C重復,占單核苷酸重復的74.58%。二核苷酸重復類型排列第三位,其出現頻率為18.39%,以AG為主的重復基序占二核苷酸重復類型的54.61%,而且在擬南芥EST-SSR中極為罕見的GC基序在No.1026中擁有二核苷酸重復的8.13%。4—6核苷酸的重復基序僅為SSR總數的4.15%。
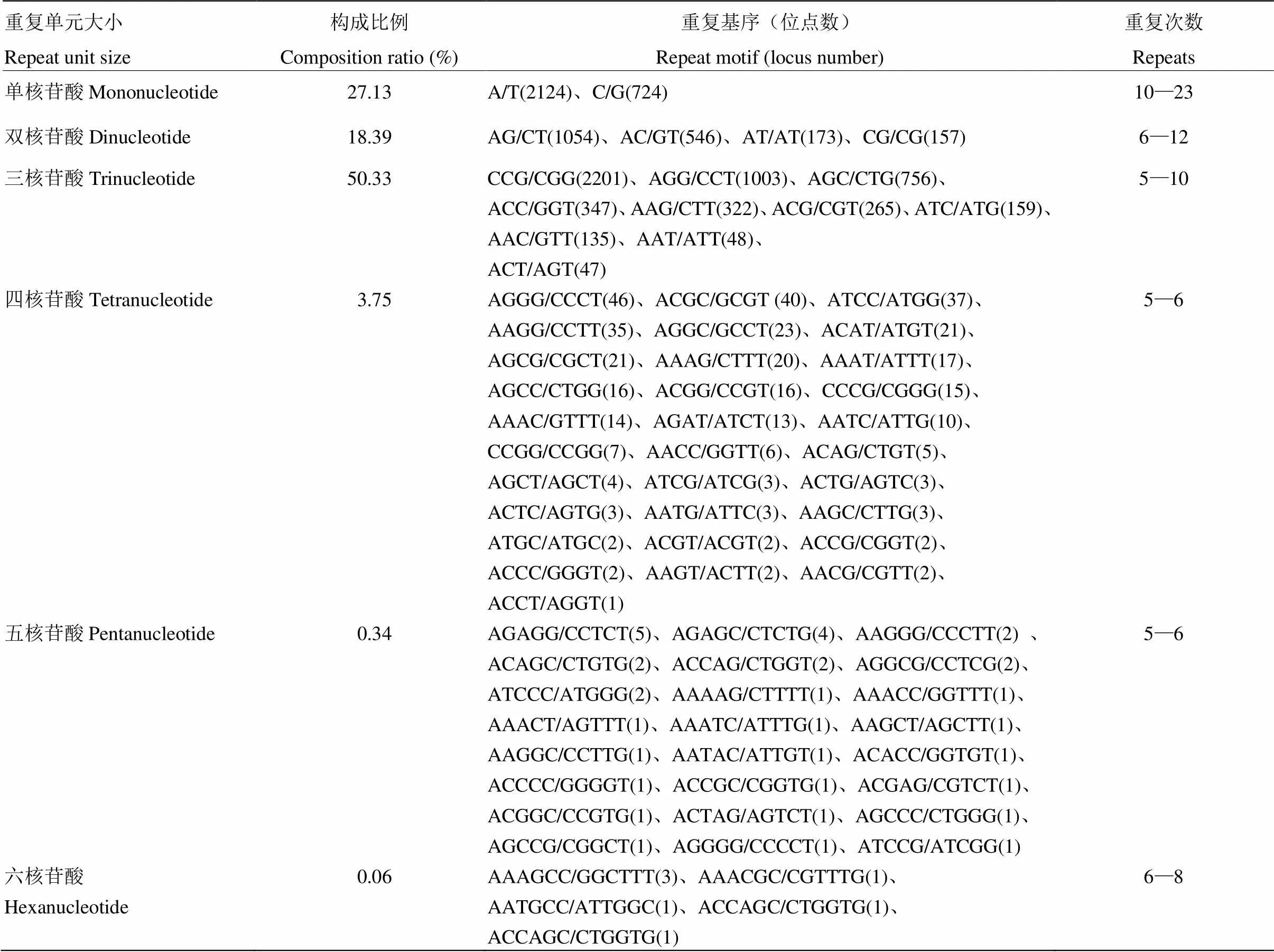
表1 Dv#4的EST-SSR構成
2.2 SSR引物在小麥與簇毛麥間擴增的多態性及在簇毛麥染色體的分布
隨機合成238對引物,對包括單核苷酸、二核苷酸、三核苷酸、四核苷酸4種主要重復單元的SSR位點進行引物有效性驗證,對CS、簇毛麥Dv#2和Dv#4進行擴增分析。結果顯示,88對引物在CS與簇毛麥之間具有擴增產物的多態性。圖1顯示了部分引物的擴增結果。圖中可見,多態性類型分為2種:類型1在簇毛麥中清晰擴增的引物在小麥中沒有明顯的擴增帶,如圖1中的5、6、8、24、44、51、54和65,表現為有、無的多態性;類型2則表現為在簇毛麥與小麥間擴增產物的長度多態性。將這些與小麥具有多態性的引物進一步對1V#2(1D)異代換系以及DA2V#2-7V#2異附加系進行擴增,8對引物只在簇毛麥和單一異染色體系中擴增出相同的目的條帶(圖2),表明這些引物位于簇毛麥單一染色體上,可作為這些染色體特異的EST-SSR標記。
本研究對每一個SSR位點都分別設計了3組引物,8584.0的3組引物p1、p2和p3都可在簇毛麥和4V異附加系擴增出特異帶(圖2),說明該SSR位點確實位于4V染色體上。引物3155.0p3和13764.0p1可在簇毛麥和二體異附加系DA2V#2特異擴增,而引物18808F3可在簇毛麥和二體異附加系DA5V#2特異擴增。引物1211F2和12613.0F3除了在簇毛麥擴增外,還分別在二體異附加系3V和6V擴增。此外,有4對引物可同時在簇毛麥和多個異染色體系中特異擴增(圖3),表明這些SSR位點分布在簇毛麥多條染色體上。其中,引物18131.3751可在簇毛麥DV#2不同的異染色體系上擴增出分子量大小明顯不同的產物。

M:Marker 2000的部分區段,條帶對應于100、250和500 bp;1—65表示65對不同引物,其擴增產物顯示小麥與簇毛麥或簇毛麥間的多態性M: Parts of Marker 2000, the bands are corresponding to 100 bp, 250 bp and 500 bp in size, respectively. 1-65 indicate 65 pairs of EST-SSR primers, the amplified products showing the PCR polymorphic fragments between wheat and D. villosum or betweentwo D. villosum accessions
2.3 特異SSR擴增產物在不同簇毛麥間的多態性
在238對SSR引物中,有47對引物(19.74%)在Dv#2和Dv#4之間顯示出多態性。從圖1可以看出,部分引物如2、3、4、32和44在Dv#4中具有預期擴增條帶,而在Dv#2則沒有明顯的擴增帶。而引物11、14、15、31、42、45、61、63、64及65則在2份簇毛麥間顯示擴增片段長度多態性。由于這些SSR引物來自簇毛麥的轉錄組,說明這兩份不同來源簇毛麥的表達序列存在著差異。
2.4 新開發分子標記對簇毛麥異質性的鑒定
曾經將簇毛麥Dv#2與簇毛麥Dv#4近距離種植,用開發的EST-SSR引物225(225F:5’-ACCAGTTGTT AAGGTGGGCC-3’,225R:5’-ACCGTTGTTACGCCG TACAA-3’)和1個定位于6VS(6V-12[26])的EST-PCR標記檢測從簇毛麥Dv#2衍生的部分后代植株。6V-12可在原始的2個簇毛麥Dv#2和Dv#4擴增出多態性片段,對48個簇毛麥Dv#2衍生的植株無一例外都穩定擴增出來自6V#2S的特異帶,沒有6V#4S的特異帶。但EST-SSR引物225則擴增出3種類型,不同植株在該SSR位點顯示了分離(圖4)。說明2份近距離種植的簇毛麥間可能曾經發生過天然的異交,也表明了SSR引物可有效用于簇毛麥異質性的鑒定。
3 討論
3.1 EST-SSR序列在簇毛麥基因組的構成及其染色體的分布
本研究對來自前蘇聯簇毛麥No.1026轉錄組數據的分析結果表明,No.1026的表達序列中存在豐富的SSR序列。根據對擬南芥的研究[36-37],發現轉錄區的SSR分布呈現從5’端到3’端遞減的特性,5’UTR的SSR分布頻率顯著高于其他轉錄區,且以二核苷酸AG和三核苷酸AAG重復為主,二核苷酸GC重復基序極其罕見。而基因編碼區的SSR序列中,92.6%為三核苷酸及六核苷酸的串聯重復序列,認為可能與三聯體密碼子所受的選擇壓有關。三核苷酸重復基序又以AAG的頻率最高,CCG的基序最少。本研究的結果明顯不同于擬南芥,整體上,簇毛麥No.1026轉錄組中三核苷酸的串聯重復序列占SSR總數的50.33%。這與前人對水稻、小麥、大豆、玉米等作物[38]以及杉木[39]的研究結果相類似。而且,CCG/CGG是三核苷酸重復的主要基序,其出現頻率占三核苷酸重復的41.66%,這一結果與水稻很相似。根據Gao等[38]的研究,水稻的EST中,平均每100 kb就有23.6個CCG基序的SSR重復,而小麥、玉米和大豆分別為10.3、3.5和0.9。Gao等[38]認為許多三核苷酸可能與重要的基因功能相關,如CCG重復可能涉及脅迫抗性、轉錄調控、代謝酶的合成、信號轉導等基因功能。另外,單核苷酸作為簇毛麥轉錄組SSR的第二大主要的串聯重復單元,A/T出現的頻率遠高于C/G,這一特征與小麥、水稻、玉米、大豆及擬南芥都是相同的[38,36]。
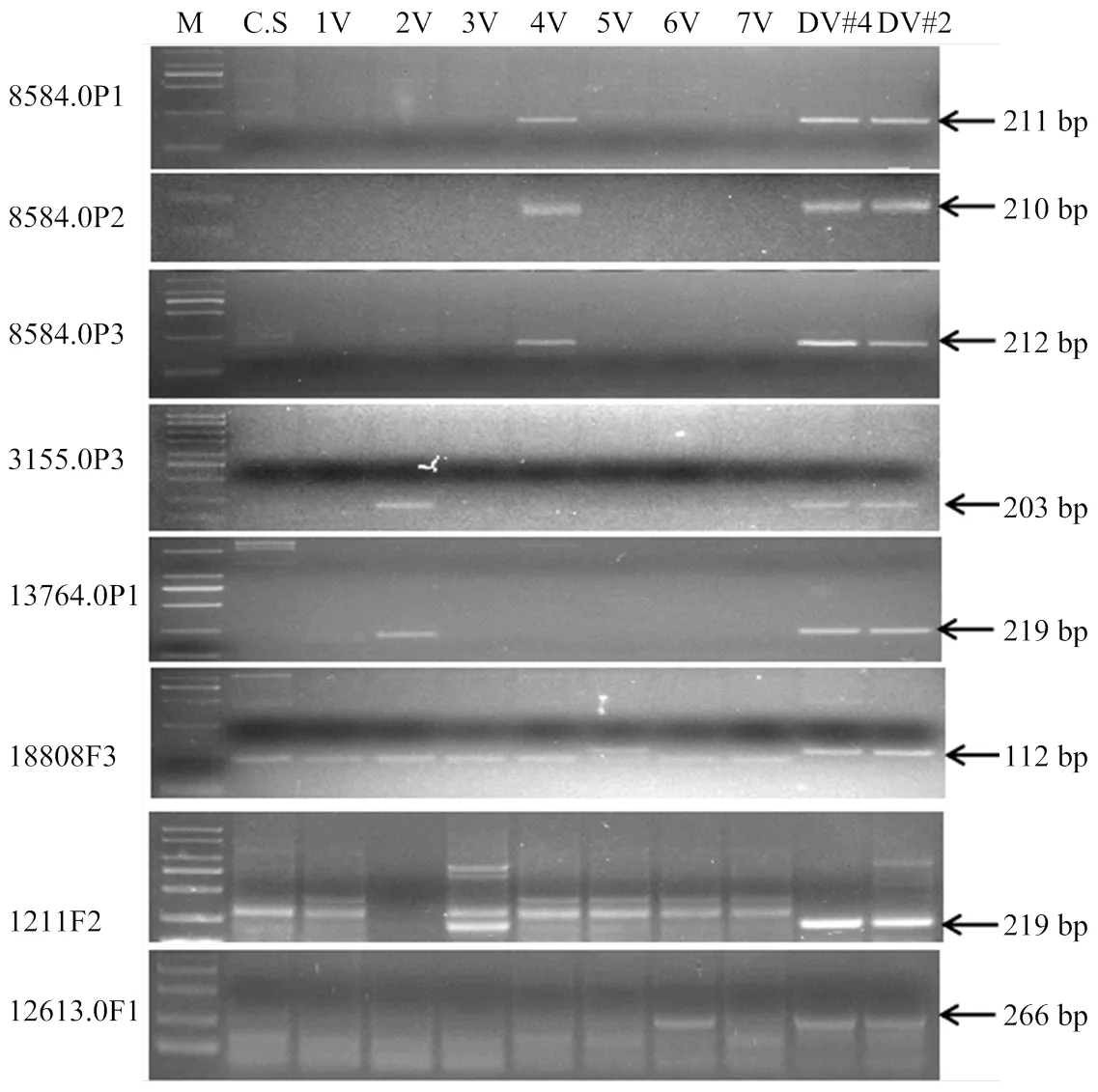
M:Marker 2000,左側為引物名稱,右側箭頭顯示引物擴增的特異條帶及片段大小。下同
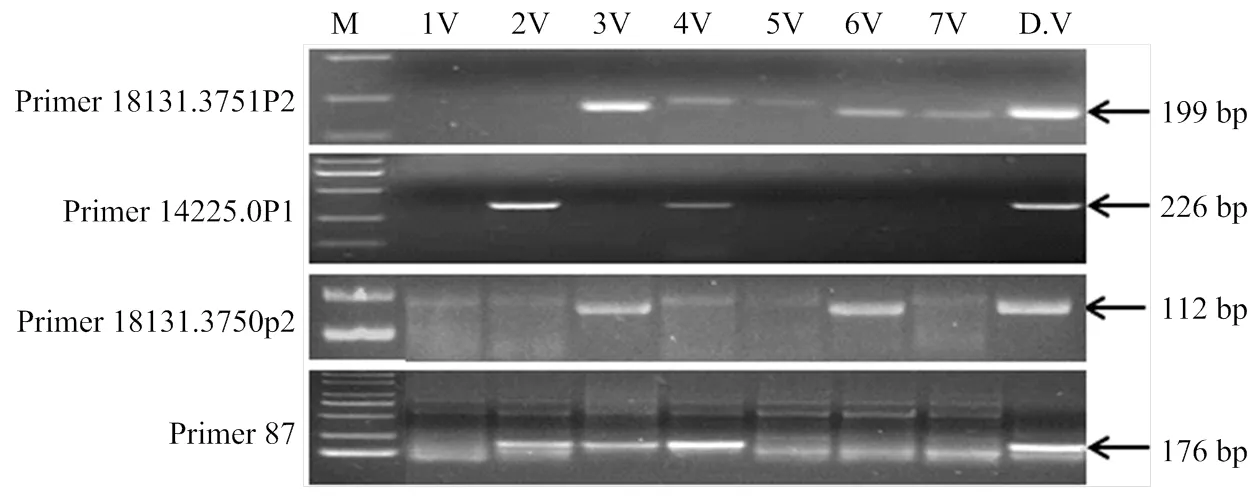
圖3 4對引物對1V—7V異染色體系和Dv#4的擴增圖譜
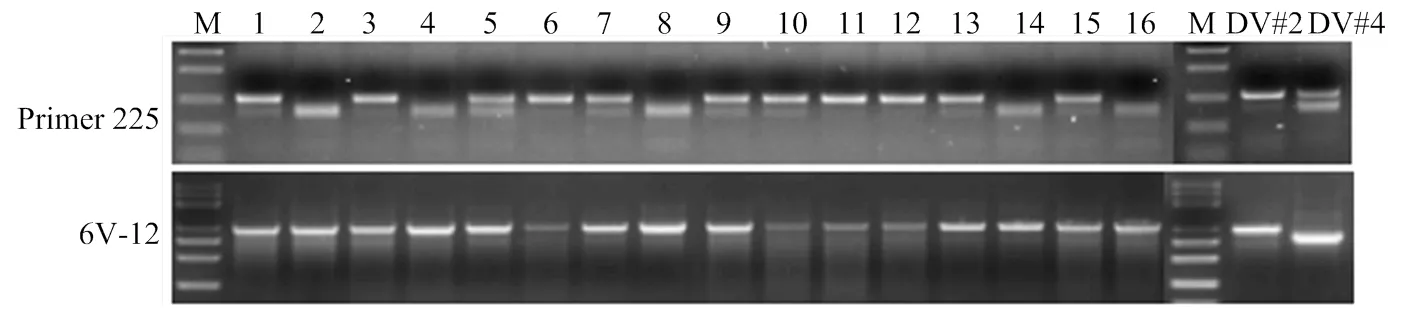
M:Marker 5000;1—16:曾經與簇毛麥Dv#4近距離種植的Dv#2衍生的部分植株,簇毛麥Dv#2和Dv#4為原始親本
基于SSR開發的PCR標記具有操作簡易的特點,尤其是,來自轉錄組的SSR直接與功能基因的表達相關,鑒定SSR位點與特定染色體的相關性,開發外源染色體特異的SSR分子標記,對于充分利用轉錄組的SSR序列資源,輔助篩選和鑒定向小麥基因組轉移的簇毛麥染色體及其性狀具有十分重要的意義。No.1026迄今還沒有整套的附加或代換系,所以,本研究借助了來自英國劍橋的簇毛麥Dv#2的一套異染色體系(附加或代換系)對No.1026的SSR在染色體上的分布進行了調查。雖然結果不能完全代表No.1026,但依然具有一定的參考價值,因為作為基因的一部分,轉錄序列在種間相對保守,而且本研究選擇用于染色體定位的引物都可在2份簇毛麥Dv#2和Dv#4中擴增出大小相似清晰的特異片段。
隨機合成的238對引物擴增結果顯示:簇毛麥基因組中SSR可能位于單條染色體,也可能分布于多條染色體。但是本研究有許多在簇毛麥可清晰擴增出目的條帶的引物在任何一個異染色體系上都無擴增,這可能是由于:源于Dv#2的附加系中,外源染色體并沒有完全保持簇毛麥原始親本中染色體的完整性。因為從簇毛麥到附加系的培育過程中,經歷過異源多倍體化(如硬-簇雙二倍體的合成)及多次的回交和自交,在異源多倍體化過程中,基因組的重新整合可能出現基因的缺失、刪除或突變[40]。事實上,SSR引物是基于SSR序列側翼的保守序列設計的,這些保守序列的缺失或變異都可能造成擴增的失敗。另外,這些來自轉錄組的SSR引物在基因組擴增時,可能由于內含子或其他插入序列的存在而比預期片段大。
3.2 不同簇毛麥間的遺傳多樣性
簇毛麥攜帶許多改良小麥潛在的優良性狀,但對不同來源簇毛麥的遺傳多樣性的研究迄今為止多局限于6V,如研究表明,6V#2和6V#4染色體都攜帶白粉病抗性基因,而6V#1和6V#3的異染色體系則對白粉菌敏感。此外,不同來源的6VS對癭螨及其所傳播的病毒抗性也存在差異[20]。最近的研究中,至少有10個分子標記顯示出6V#2和6V#4間的多態性[22-26]。然而,涉及其他染色體的此類研究還很缺乏。另外,除了白粉病抗性,簇毛麥中控制重要農藝性狀的很多基因尚未鑒定和利用。本研究利用來自轉錄組的SSR序列,對2份不同簇毛麥進行擴增分析,揭示了它們之間存在豐富的多態性。而且,本研究是基于瓊脂糖凝膠電泳技術區分樣品的多態性的,其分辨率較低,一些原本存在的差異不足以在瓊脂糖凝膠上區分。所以,推測實際上簇毛麥間的多態性可能更高。而遺傳多樣性是研究與利用種質資源的基礎。因此,將不同來源簇毛麥導入普通小麥,培育附加、代換或易位系,對其有益基因的發掘、鑒定及在小麥改良中的利用具有重要的意義,而基于基因序列的差異開發的EST-SSR標記在上述過程中也可作為重要的輔助選擇的工具。
4 結論
簇毛麥No.1026(Dv#4)的轉錄組存在大量的SSR序列,其中CCG/CGG、A/T和AG/CT等三核苷酸、單核苷酸和二核苷酸是其最主要的串聯重復基序。部分EST-SSR側翼保守序列與單一或多條外源染色體相關聯,據此開發特異的分子標記,可用于跟蹤檢測小麥背景中特異的簇毛麥染色體或染色體片段。簇毛麥Dv#4與Dv#2間的部分EST-SSR具有多態性,提示2份不同來源的簇毛麥其表達序列間存在一定程度的遺傳差異,因此,Dv#4值得進一步的發掘研究。
[1] Gr?dzielewska A. The genus Dasypyrum-part 2.- a wild species used in wheat improvement.,2006, 152: 441-454.
[2] 趙萬春, 董劍, 陳其皎, 李曉燕, 高翔, 石引剛, 陳良國. 簇毛麥—用于小麥改良的一種野生植物. 草業科學, 2012, 29(10): 1613-1621.
ZHAO W C, DONG J, CHEN Q J, LI X Y, GAO X, SHI Y G, CHEN L G. Advance in-a valuable wild species used in wheat improvement., 2012, 29(10): 1613-1621. (in Chinese)
[3] CHEN Q, CONNER R L, LI H, LAROCHE A, GRAF R J, KUZYK A D. Expression of resistance to strip rust, powdery mildew and the wheat curl mite in×lines., 2002, 82(2): 451-456.
[4] 劉大鈞, 陳佩度, 吳沛良, 王耀南, 邱伯行, 王蘇玲. 硬粒小麥-簇毛麥雙二倍體. 作物學報, 1986, 12(3): 155-162.
LIU D J, CHEN P D, WU P L, WANG Y N, QIU B X, WANG S L.amphidiploid., 1986, 12(3): 155-162. (in Chinese)
[5] 陳孝, 徐惠君, 杜麗璞, 尚立民, 韓彬, 施愛農, 肖世和. 利用組織培養技術向普通小麥導入簇毛麥抗白粉病基因的研究. 中國農業科學, 1996, 29(5): 1-8.
CHEN X, XU H J, DU L P, SHANG L M, HAN B, SHI A N, XIAO S H. Transfer of gene resistant to powdery mildew fromto common wheat by tissue culture.,1996, 29(5): 1-8. (in Chinese)
[6] 陳佩度, 周波, 齊莉莉, 劉大鈞. 用分子原位雜交(GISH)鑒定小麥-簇毛麥雙倍體、附加系、代換系和易位系. 遺傳學報, 1995, 22(5): 380-386.
CHEN P D, ZHOU B, QI L L, LIU D J. Identification of wheat-amphiloid, addition, substitution and translocation lines byhybridization using biotin-labelled genomic DNA as a probe., 1995, 22(5): 380-386. (in Chinese)
[7] CHEN P D, QI L L, ZHOU B, ZHANG S Z, LIU D J. Development and molecular cytogenetic analysis of wheat-6VS/6AL translocation lines specifying resistance to powdery mildew., 1995, 91: 1125-1128.
[8] 齊莉莉, 陳佩度, 劉大鈞, 周波, 張守中, 盛寶欽, 向齊君, 段霞渝, 周益林.小麥白粉病新抗源——基因. 作物學報, 1995, 21(3): 257-262.
QI L L, CHEN P D, LIU D J, ZHOU B, ZHANG S Z, SHEENG B Q, XIANG Q J, DUAN X Y, ZHOU Y L. The gene- a new source for resistance to wheat powdery mildew., 1995, 21(3): 257-262. (in Chinese)
[9] LI H, CHEN X, XIN Z Y, MA Y Z, XU H J, CHEN X Y, JIA X. Development and identification of wheat–T6DL.6VS chromosome translocation lines conferring resistance to powdery mildew., 2005, 124: 203-205.
[10] LIU C, QI L L, LIU W X, ZHAO W C, WILSON J, FRIEBE B, GILL B S. Development of a set of compensating-Robertsonian translocation lines., 2011, 54: 836-844.
[11] XING L, HU P, LIU J., WITEK K, ZHOU S, XU J, ZHOU W, GAO L, HUANG Z, ZHANG R, WANG X, CHEN P, WANG H, JONES J D G, KARAFIATOVA M, VRANA J, BARTOS J, DOLEZEL J, TIAN Y, WU Y, CAO A. Pm21 fromencodes a CC-NBS-LRR that confers powdery mildew resistance in wheat., 2018, doi: 10.1016/j.molp.2018.02.013.
[12] HE H, ZHU S, ZHAO R, JIANG Z, JI Y, JI J, QIU D, LI H, BIE T. Pm21, encoding a typical CC-NBS-LRR protein, confers broad- spectrum resistance to wheat powdery mildew disease., 2018, doi: 10.1016/j.molp.2018.03.004.
[13] ZHANG Q P, LI Q, WANG X E, WANG H Y, LANG S P, WANG Y N, WANG S L, CHEN P D, LIU D J. Development and characterization of a-translocation line T4VS·4DL confer-ring resistance to wheat spindle streak mosaic virus., 2005, 145: 317-320.
[14] ZHAO R, WANG H, XIAO J, BIE T, CHENG S, JIA Q, YUAN C, ZHANG R, CAO A, CHEN P, WANG X. Induction of 4VS chromosome recombinants using the CS ph1b mutant and mapping of the wheat yellow mosaic virus resistance gene from, 2013, 126: 2921-2930.
[15] 李淑梅, 徐川梅, 周波, 陳佩度. 普通小麥-簇毛麥2V染色體端體異附加系的選育與鑒定. 南京農業大學學報, 2009, 32(1): 1-5.
LI S M, XU C M, ZHOU B, CHEN P D. Development and identification ofditelesomic addition lines involving chromosome 2V of., 2009, 32(1): 1-5. (in Chinese)
[16] 董劍, 楊華, 趙萬春, 李曉燕, 陳其皎, 高翔. 普通小麥中國春–簇毛麥易位系T1DL·1VS和T1DS·1VL的農藝和品質特性. 作物學報, 2013, 39(8): 1386-1390.
DONG J, YANG H, ZHAO W C, LI X Y, CHEN Q J, GAO X. Agronomic traits and grain quality of Chinese Spring-translocation lines T1DL?1VS and T1DS?1VL., 2013, 39(8): 1386-1390. (in Chinese)
[17] 張瑞奇, 馮祎高, 侯富, 陳樹林, 別同德, 陳佩度. 普通小麥-簇毛麥T5VS.5DL易位染色體對小麥主要農藝性狀、品質和白粉病抗性的遺傳效應分析. 中國農業科學, 2015, 48(6): 1041-1051.
ZHANG R Q, FENG Y G, HOU F, CHEN S L, BIE T D, CHEN P D. The genetic effect of wheat-T5VS.5DL translocated chromosome on agronomic characteristics, quality, and powdery mildew resistance of common wheat., 2015, 48(6): 1041-1051. (in Chinese)
[18] ZHANG R, SUN B, CHEN J, CAO A, XING L, FENG Y, LAN C, CHEN P., a developmental-stage and tissue-specific powdery mildew resistance gene introgressed frominto common wheat., 2016, 129: 1975-1984.
[19] QI L L, PUMPHREY M O, FRIEBE B, ZHANG P, QIAN C, BOWDEN R L, ROUSE M N, JIN Y, GILL B S. A novel Robertsonian translocation event leads to transfer of a stem rust resistance gene () effective against race Ug99 frominto bread wheat., 2011, 123(1): 159-167.
[20] LI H J, CONNER R L, CHEN Q, JIA X, LI H, GRAF R J, LAROCHE A, KUZYK A D. Different reactions to the wheat curl mite and wheat streak mosaic virus in various wheat–6V and 6VS lines., 2002, 86(4): 423-428.
[21] LIU C, Ye X G, Wang M J, LI S J, LIN Z S. Genetic behavior oftranslocation chromosomes T6V#4S·6DL and T6V#2S·6AL., 2017, 16(10): 2136-2144.
[22] 張云龍, 王美蛟, 張悅, 褚翠萍, 林志珊, 徐瓊芳, 葉興國, 陳孝, 張憲省. 不同簇毛麥6VS 染色體臂的白粉病抗性特異功能標記的開發及應用. 作物學報, 2012, 38(10): 1827-1832.
ZHANG Y L, WANG M J, ZHANF Y, CHU C P, LIN Z S, XU Q F, YE X G, CHEN X, ZHANG X S. Development and application of functional markers specific to powdery mildew resistance on chromosome arm 6VS from different origins of, 2012, 38(10): 1827-1832. (in Chinese)
[23] LIN Z S, ZHANG Y L, WANG K, LI J R, XU Q F, CHEN X, ZHANG X S, YE X G. Isolation and molecular analysis of genesandhomologous to powdery mildew resistance genein aaccession and its derivatives., 2013, 54: 417-426.
[24] BIE T D, ZHAO R H, ZHU S Y, CHEN S L, HE H G. Development and characterization of marker MBH1 simultaneously tagging genesandconferring resistance to powdery mildew in wheat., 2015, 35: 189.
[25] 劉暢, 李仕金, 王軻, 葉興國, 林志珊. 簇毛麥6VS特異轉錄序列P21461及P33259的獲得及其分子標記在鑒定小麥–簇毛麥抗白粉病育種材料中的應用. 作物學報, 2017, 43(7): 983-992.
LIU C, LI S J, WANG K, YE X G, LIN Z S. Developing of specific transcription sequences P21461 and P33259 on6VS and application of molecular markers in identifying wheat-breeding materials with powdery mildew resistance., 2017, 43(7): 983-992. (in Chinese)
[26] LI S J, LIN Z S, LIU C, Wang K, Du L P, YE X G. Development and comparative genomic mapping of6V#4S- specific PCR markers using transcriptome data., 2017, 130(10): 2057-2068.
[27] PLASCHKE J, GANAL M E, RODER M S. Detection of genetic diversity in closely related bread wheat using microsatellite markers., 1995, 91: 1001-1007.
[28] BRYAN G J, COLLINS A J, STEPHENSON P, Orry A, Smith J B, Gale M D. Isolation and characterization of microsatellites from hexaploid bread wheat., 1997, 94(5): 557-563.
[29] 謝皓, 陳學珍, 楊柳, 王建立. EST-SSR標記的發展和在植物遺傳研究中的應用. 北京農學院學報, 2005, 20(4): 73-76.
XIE H, CHEN X J, YANG L, WANG J L. Development and application of EST-SSR marker in plant genetic., 2005, 20(4): 73-76. (in Chinese)
[30] 曹亞萍, 曹愛忠, 王秀娥, 陳佩度. 基于EST-PCR的簇毛麥染色體特異分子標記篩選及應用. 作物學報, 2009, 35(1): 1-10.
CAO Y P, CAO A Z, WANG X E, CHEN P D. Screening and application of EST-based PCR markers specific to individual chromosomes of, 2009, 35(1): 1-10. (in Chinese)
[31] 李珊珊, 曾艷飛, 何彩云, 張建國. 基于沙棘轉錄組序列開發EST-SSR分子標記. 林業科學研究, 2017, 30(1): 69-74.
LI S S, ZENG Y F, HE C Y, ZHANG J G. Development of EST-SSR markers based ontranscriptomic sequences., 2017, 30(1): 69-74. (in Chinese)
[32] 陳岳, 張微微, 莫海波, 付乃峰, 田代科. EST-SSR標記構建蓮()遺傳連鎖圖譜. 分子植物育種, 2017, 15(6): 2265-2273.
CHEN Y, ZHANG W W, MO H B, FU N F, TIAN D K. Construction of a genetic linkage map of lotus () using EST-SSR markers., 2017, 15(6): 2265-2273. (in Chinese)
[33] 陳勛, 龔自明. 基于EST-SSR 標記的湖北茶樹種質資源遺傳多樣性分析. 分子植物育種, 2017, 15(5): 1831-1838.
Chen X, Gong Z M. Analysis of genetic diversity with EST-SSR markers for tea germplasm in Hubei province., 2017, 15(5): 1831-1838. (in Chinese)
[34] 李翔, 張穎, 許俊強, 宋婷, 李文璐, 董玉梅, 張應華. 基于EST-SSR 標記的云南黃瓜種質資源遺傳多樣性分析. 分子植物育種, 2016, 14(5): 1179-1188.
LI X, ZHANG Y, XU J Q, SONG T, LI W L, DONG Y M, ZHANG Y H. Analysis on genetic diversity of local cucumber germplasm resources in Yunnan based on EST-SSR markers., 2016, 14(5): 1179-1188. (in Chinese)
[35] QI L L, WANG S L, CHEN P D, LIU D J, GILL B S. Identification and physical mapping of threechromosome-6V deletion lines., 1998, 97(7): 1042-1046.
[36] ZHANG L D, YUAN D J, YU S W, LI Z G, CAO Y F, MIAO Z Q, QIAN H M, TANG K X. Preference of simple sequence repeats in coding and non-coding regions of., 2004, 20(7): 1081-1086.
[37] 張利達, 唐克軒. 植物EST-SSR標記開發及其應用. 基因組學與應用生物學, 2010, 29(3): 534-541.
ZHANG L D, TANG K X. Development of plant EST-SSR markers and its application., 2010, 29(3): 534-541. (in Chinese)
[38] GAO L F, TANG J F, LI H W, JIA J Z. Analysis of microsatellites in major crops assessed by computational and experimental approaches., 2003, 12: 245-261.
[39] 文亞峰, 韓文軍, 周宏, 徐剛標. 杉木轉錄組SSR挖掘及EST-SSR標記規模化開發. 林業科學, 2015, 51(11): 40-49.
WEN Y F, HAN W J, ZHOU H, XU G B. SSR mining and development of EST-SSR markers forbased on transcriptome sequences., 2015, 51(11): 40-49. (in Chinese)
[40] KASHKUSH K, FELDMAN M, LEVY A A. Silencing and activation in a newly synthesized wheat allotetraploid., 2002, 160(4): 1651-1659.
SSR sequences and development of PCR markers based on transcriptomeNo.1026
CHEN JingNan1,2, Ma XiaoLan1, WANG Zhen3, LI ShiJin1, Xie Hao2, YE XingGuo1, LIN ZhiShan1
(1Institute of Crop Science, Chinese Academy of Agricultural Sciences/National Key Facility of Crop Gene Resources and Genetic Improvement/Key Laboratory of Biology and Genetic Improvement of Triticeae Crops, Ministry of Agriculture, Beijing 100081;2School of Plant Science and Technology, Beijing university of agriculture, Beijing 102206;3College of bioscience & bioengineering, North Minzu university, Yinchuan 750021)
【Objective】The aim of this study is to explore the characteristics of the EST-SSR sequences of aaccession No.1026 (Dv#4) introduced from the former Soviet Union, and their distributions on chromosomes and polymorphism in differentaccessions and between Dv#4 and common wheat. 【Method】Transcriptome sequences of Dv#4 plants were obtained by Illumina HiSeq sequencing and used to search and analyze the SSR sequences using MISA software and design primers by Primer 3. In total, 238 pairs of primers were selected randomly for synthesis and used to amplify the genomic DNAs of wheat Chinese Spring (CS) and the two differentaccessions. The polymorphisms of the PCR products on agarose gel were evaluated. Further, the features of their chromosome distributions in Dv#4 were studied by using a set of wheat-alien chromosome lines (including disomic addition lines and disomic substitution lines). 【Result】 A total sequence length of 62.76 Mb was detected and 10 497 SSR loci were found in the transcriptome data. They are involved in 8 735 unigenes. Repeated unit of mono-, di-, tri- nucleotides are the main type, holding 95.85% of all loci among 1-6 nucleotides repeats, among which tri-nucleotide is the richest component that makes up of 50.33% and contains CCG/CGG motif by 41.66%. The next component is mono-nucleotide tandem repeat, and its occurrence frequency is 18.39%, and A/T repeats occupy 74.58% in this type. Di-nucleotide ranks the 3rd, and it holds 18.39% in the total SSR loci. Among 238 pairs of randomly synthetized EST-SSR primers, 88 pairs amplified polymorphic fragments between CS and(including Dv#2 and Dv#4); 8 pairs only had amplifications inand some single alien chromosome lines; 4 pairs could specifically amplify bands inand multiple alien chromosome lines. But, many primers which had amplification in bothaccessions had no amplification in any alien chromosome lines. Therefore, it can be inferred that variations on the flanking conserved sequences of SSR might occur during the transferring of the exogenous genome or chromosomes into wheat. Additionally, 47 pairs of primers (19.74%) showed polymorphisms between Dv#2 and Dv#4. By using a pair of EST-SSR primer and a PCR marker, respectively, polymorphic amplicons were detected in 48plants, indicating that polymorphic SSR primer can be used to detect the heterogeneity ofeffectively.【Conclusion】Dv#4 has abundant SSR sequences in its transcriptome, of which, CCG/CGG, A/T, AG/CT and other tri-, mono-, and di-nucleotide are the main tandem repeats.The flanking conserved sequences of partial EST-SSR in Dv#4 are associated with a single or several chromosomes specifically, which provides an ideal sequence resource for the development of specific molecular markers to track and detectchromosomes or chromosome fragments in wheat background. Some of the EST-SSR polymorphism between Dv#4 and Dv#2 indicates that there is a certain degree of genetic diversity in some of the expressed sequences between the two different originaccessions. Therefore, Dv#4 is valuable to be further investigated.
; transcriptome; EST-SSR; alien chromosome lines; chromosome localization; genetic diversity
10.3864/j.issn.0578-1752.2019.01.001
2018-07-01;
2018-09-19
國家重點研發計劃(2016YFD0102002,2016YFD0102001)、中國農業科學院科技創新工程(2060302-2-17年)
陳竟男,E-mail:1293498949@qq.com。 通信作者謝皓,E-mail:xiehao126@126.com。通信作者林志珊,E-mail:linzhishan@caas.cn
(責任編輯 李莉)

