近零磁場下干擾磁響應關鍵基因對褐飛虱壽命的影響
賀靜瀾,張明,劉瑞瑩,萬貴鈞,潘衛東,陳法軍
?
近零磁場下干擾磁響應關鍵基因對褐飛虱壽命的影響
賀靜瀾1,張明1,劉瑞瑩1,萬貴鈞1,潘衛東2,陳法軍1
(1南京農業大學植物保護學院,南京 210095;2中國科學院電工研究所生物電磁學北京市重點實驗室,北京 100190)
【目的】隱花色素(cryptochrome, Cry)和鐵硫簇蛋白IscA(iron-sulfur cluster assembly,即MagR)是生物體內潛在的磁受體蛋白,本研究通過RNA干擾(RNAi)技術,分別敲減褐飛虱()體內的磁響應關鍵基因、和,旨在探明近零磁場(near-zero magnetic field,NZMF)環境下,以上3種基因在褐飛虱壽命調節過程中的作用,從而間接探討這3種基因對磁場的響應情況。【方法】采用RNAi技術,以實驗室正常磁場環境下穩定飼養的短翅初羽化褐飛虱雌雄成蟲為材料,通過向其體內注射雙鏈RNA(dsRNA)分別抑制磁響應關鍵基因、和,隨后立即分別放入正常磁場(geomagnetic field,GMF)和近零磁場中,于每日相同時間觀察記錄試蟲壽命。同時于注射后的1、2和3 d通過RNAiso Plus法提取GMF中褐飛虱雌成蟲總RNA,反轉錄合成第一鏈DNA,后采用實時熒光定量PCR(RT-qPCR)技術檢測該基因的表達情況,以確定基因干擾效率。【結果】注射ds后,褐飛虱雌雄成蟲壽命在近零磁場和正常磁場間均無顯著差異。注射ds后,近零磁場中褐飛虱雌雄成蟲壽命比正常磁場分別顯著延長27.78%和50.04%;此外,與注射ds處理相比,正常磁場下注射ds的雌成蟲壽命縮短,而近零磁場下注射ds的雌成蟲壽命延長,但二者差異均不顯著;近零磁場和正常磁場下注射ds的雄成蟲壽命均縮短(25.41%和10.73%),且正常磁場下差異顯著。近零磁場中,注射ds的雌成蟲壽命較注射ds的壽命顯著縮短了16.48%,而雄成蟲壽命在磁場間、干擾處理間的差異均不顯著。【結論】磁場變化下褐飛虱雌雄成蟲體內3種磁響應關鍵基因對其壽命的調節功能存在差異。其中,對磁場變化存在敏感響應,表現為敲減該基因與磁場變化的互作顯著地影響雌雄成蟲壽命,且表現出“性二型性”;也可對磁場變化產生明顯響應,但該響應只存在于雌成蟲;此外,對磁場變化無響應,該基因或與褐飛虱雌雄成蟲壽命調節無關。
磁場強度變化;褐飛虱;磁響應基因;RNA干擾;成蟲壽命;磁生物學效應
0 引言
【研究意義】磁場能以機械力的方式作用于一定范圍內的磁體或運動電荷[1]。根據磁場的強度(用磁感應強度B表示,單位為特斯拉,T),可人為地將磁場劃分為弱磁場(<1 mT)、中等強度磁場(1 mT—1 T)、強磁場(1—5 T)和超強磁場(>5 T)[2]。地球磁場(geomagnetic field,GMF)的平均場強為50 μT左右,屬于弱磁場范圍,而強度比地磁場更小的弱磁環境又可進一步被定義為亞磁場(亞磁空間),也可稱近零磁場(near-zero magnetic field,NZMF)[3]。生物磁響應(magnetic response)指生物感知磁場強度及方向的信息,并直接或間接地通過行為、生理、代謝等作出從宏觀表型到微觀分子水平響應的現象[4]。目前對于弱磁場,尤其是地磁場,人們更側重于研究其對生物行為的影響,如以家鴿為代表的遷徙性動物極有可能利用自地磁信息進行定向和導航[5];至于強磁場和超強磁場,人們則更關注這類磁場對人體造成的潛在威脅,如核磁共振成像時的短時強磁空間等[6];因此磁場生物學效應的研究一度集中于中等強度磁場[7];而隨著近千年來地球磁場的不斷衰弱,針對強度低于地磁場強度——即近零磁場的生物磁響應研究也逐漸增多。實驗證實,如果長期處于該磁場環境下,動物的中樞神經系統將產生障礙[8-12],早期發育過程受到明顯影響[13-14],而短期暴露近零磁場環境也會影響人體的健康[15-17]。可見進行有關近零磁場下生物的磁生理響應研究,進而推測地球磁場的變化對生物的不利效應具有重要意義。【前人研究進展】大量研究有力地證實了生物可對磁場變化作出響應,而相較于此,對于生物磁響應機制的探索卻一直未有定論。事實上,生物對地磁場感知的關鍵在于“磁受體”(magnetoreceptor)的確定,對此學者們提出了多種假說,而其中有兩種得到了廣泛認可,即磁顆粒介導的磁受體假說與依賴光的自由基對假說。前者認為,生物可借助體內的磁鐵礦(Fe3O4)顆粒感受磁場[18],后者則認為生物體內的隱花色素(cryptochrome,Cry)可受光激發產生自由基對反應,是理想的磁受體[19]。這兩種假說均具有堅實的理論與實驗基礎,且目前科學家們更傾向于認同生物磁響應過程是這兩種機制共同作用的結果[20]。此外,近期我國科學家發現了另一種潛在的磁受體[21],即鐵硫簇蛋白IscA(iron-sulfur cluster assembly),IscA也被認為是一種潛在的磁受體蛋白(magnetoreceptor protein,MagR)。該蛋白可與隱花色素結合形成復合物,體外實驗證明該復合物不僅可感受磁場,且自身具有磁特性。同時,另一項側重于體內生物學實驗的研究也支持鐵硫簇蛋白中的一種:IscA1具有磁感受功能,但后者的研究結果表明該蛋白可不依賴隱花色素單獨調控神經活動[22]。【本研究切入點】目前,對于昆蟲的磁生理響應多集中于中等磁場和強磁場,而對于弱磁場特別是地磁場和近零磁場環境下昆蟲的生理變化研究較少[23]。褐飛虱()是一種典型的夜間遷飛型害蟲,而夜間遷飛的昆蟲最可能利用地磁場作為其黑暗中的定向信號[24],暗示其具有磁響應的能力。利用超導量子磁強計結合普魯士藍染色觀察發現,褐飛虱腹部含有鐵磁性物質,可能為Fe3O4,且這種鐵磁顆粒的含量與其翅型、性別和發育歷期等有關[25]。研究表明,相較于地球磁場,近零磁場可影響褐飛虱與白背飛虱()的趨光性、飛行能力、卵及若蟲歷期、成蟲壽命以及翅型比率等,且實時熒光定量PCR(RT-qPCR)結果顯示,稻飛虱體內與表達量在兩個磁場間存在顯著差異[26-27],但進一步的分子驗證仍是空白。【擬解決的關鍵問題】基于生物磁響應現象與磁感受機制的研究現狀,以及前人針對稻飛虱對磁場的生理響應表型實驗,選擇褐飛虱雌雄成蟲體內的磁響應關鍵基因,即、以及潛在磁受體蛋白基因(即)作為研究對象,通過RNA干擾(RNAi)技術分別敲減以上3種基因,并分別暴露于南京本地磁場(GMF:49 μT)和近零磁場(NZMF:1.8 μT)中,通過比較RNAi的褐飛虱雌雄成蟲壽命的變化規律,探討3種磁響應關鍵基因對磁場變化的響應及其對壽命的調控情況,為進一步明確磁受體及磁響應生物學通路打下基礎。
1 材料與方法
試驗于2017年在南京農業大學完成。
1.1 磁場發生裝置的建立
采用自主研發的直流電亥姆霍茲線圈創造穩定的靜態磁場環境(專利號:ZL201320004497.5),以中心點為球心的直徑30 cm的球形范圍為該線圈可控制的有效磁場范圍,本研究中所使用的幾組線圈可控最小值范圍為500—1 800 nT,因此取1.8 μT為本試驗中近零磁場磁場強度。共設置兩個穩定靜態磁場,即模擬南京本地磁場強度的地磁場(GMF:49 μT),以及抵消絕大部分地磁場以達到近零水平的近零磁場(NZMF:1.8 μT)。在磁場搭建調試、試驗的開始、過程及結束階段,使用磁通門計監測各磁場處理的強度,以保證控制環境試驗中磁場強度設置的穩定性。
1.2 供試昆蟲與試驗條件
供試褐飛虱采集自位于南京市的江蘇省農業科學院試驗稻田,飼養于室內種植的感蟲水稻品種TN1上,溫室環境為溫度(26±1)℃,相對濕度80%,光周期14 L﹕10 D,磁場環境為南京本地地磁場。供試種群已于該環境內連續培養10代以上,且用于壽命分析的試蟲均為發育整齊的短翅型雌雄成蟲。
1.3 主要試劑
總RNA提取試劑RNAiso Plus(TaKaRa)、反轉錄試劑盒PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)、凝膠回收試劑盒AxyPrepTMDNA Gel Extraction kit(Axygen)、PCR試劑2×Fast Taq Master Mix(Gentbios)、零背景pTOPO-TA Simple克隆試劑盒(Aidlab)、感受態細胞Trans1-T1(TransGen Biotech)、質粒抽提與純化試劑盒DNA Clean & ConcentratorTM-5(ZYMO RESEARCH)、體外轉錄試劑盒T7 RiboMAXTMExpress RNAi System(Promega)、RT-qPCR試劑SYBR?TM(TaKaRa)。
引物合成及測序均由南京金斯瑞科技有限公司完成。
1.4 dsRNA的制備
根據前期研究[28-29],獲得褐飛虱(GenBank登錄號:KM108578)、(GenBank登錄號:KM108579)、()(GenBank登錄號:KY026177)基因序列,經NCBI網站進行序列比對鑒定。應用Primer Premier 5.0軟件設計3種基因的上下游克隆引物,同時設計綠色熒光蛋白基因的克隆引物(表1,下劃線為T7啟動子)。其中陰性對照的模板來自實驗室保存的菌種。
取1.2中飼養的褐飛虱雌雄成蟲各3只,同性別試蟲冰浴中混合研磨勻漿后采用RNAiso Plus提取褐飛虱總RNA,其質量通過瓊脂糖凝膠電泳進行檢測,濃度通過Nanodrop2000(Thermo,USA)進行測定,隨后按照反轉錄試劑盒PrimeScriptTMRT reagent Kit的操作要求,獲得可作為模板的cDNA序列。PCR反應體系為2×FastTaq PCR Master Mix 25 μL,10 μmol·L-1的上下游引物各1.5 μL,cDNA模板4 μL,ddH2O 18 μL,總反應體系為50 μL。PCR反應條件為95℃預變性3 min,95℃變性20 s,60℃復性20 s,72℃延伸30 s,30個循環,最后72℃延伸5 min。反應產物經瓊脂糖凝膠電泳檢測無誤后,通過凝膠回收試劑盒AxyPrepTMDNA Gel Extraction kit回收特定片段。
通過零背景pTOPO-TA Simple克隆試劑盒,將含有T7啟動子的目的片段插入pTOPO-T質粒載體,轉入大腸桿菌感受態細胞Trans1-T1,均勻涂布在含有1%青霉素的LB固體培養基上37℃倒置培養9 h,挑取單個菌落于1%青霉素的LB液體培養基中37℃搖菌5 h,取1 μL菌液進行PCR擴增,并送南京金斯瑞科技有限公司測序,測序結果通過MEGA軟件進行比對。最終,按照DNA Clean & ConcentratorTM-5試劑盒的說明書對合格的菌液進行質粒抽提,隨后按照體外轉錄試劑盒T7 RiboMAXTMExpress RNAi System的操作說明合成dsRNA,退火及純化后最終獲得4種dsRNA,即ds、ds、ds及ds,調整濃度至4 000 ng·μL-1儲存于-80℃備用。
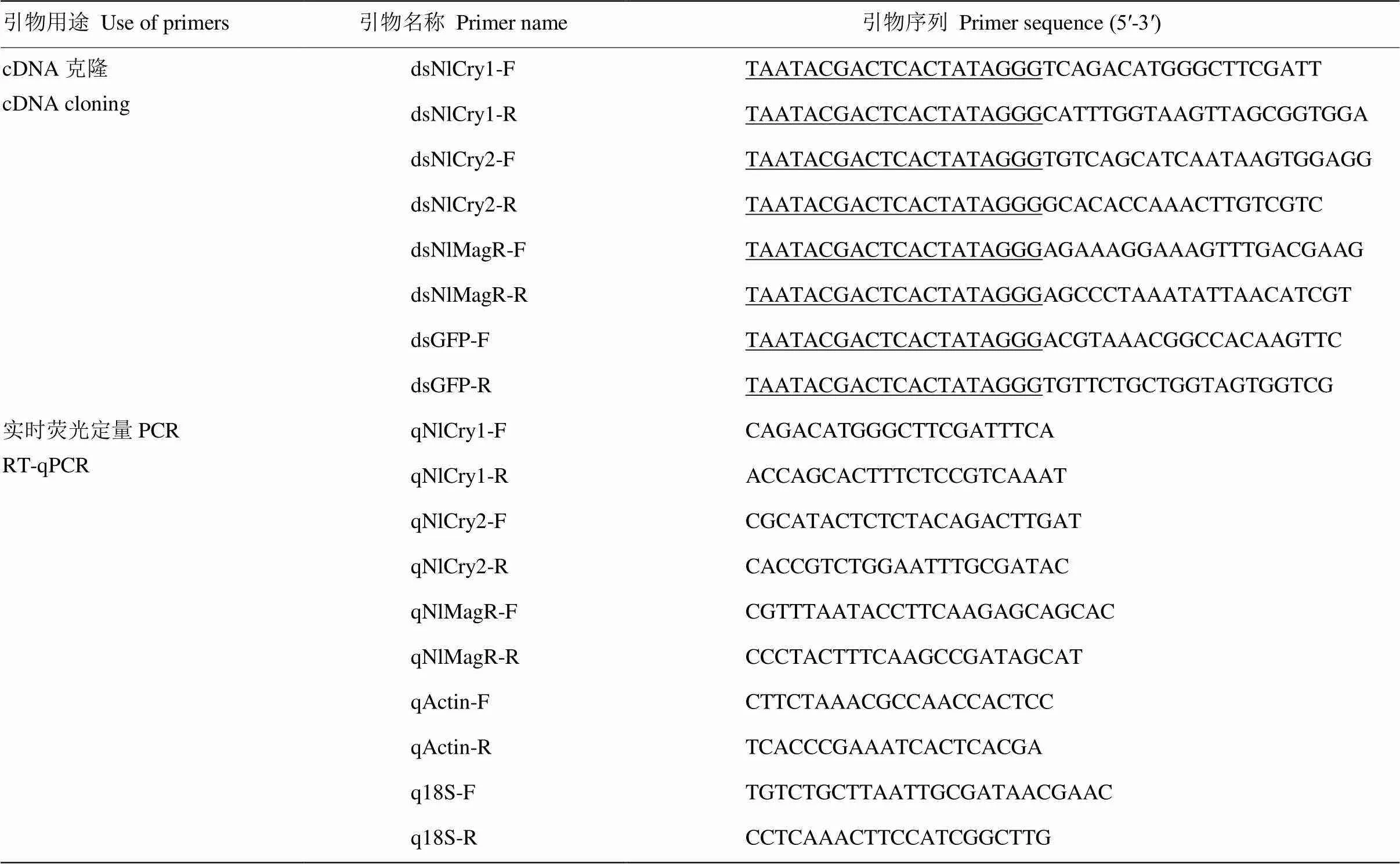
表1 本試驗所用引物及序列
1.5 RNAi
隨機選取于1.2中飼養至初羽化1 d的短翅型雌雄成蟲進行顯微注射,以其胸部中足和后足間的外側表皮處作為注射位點,并根據雌雄蟲體形差異,確定雌蟲注射量為75 nL,雄蟲注射量為50 nL。共設3個處理組,即注射 ds、ds和 ds;以注射ds的試蟲為陰性對照組。組內再分雌雄性別和不同磁場處理。因磁場空間有限,該試驗分3批進行。注射后的試蟲以單頭單管的形式飼養于試管內種植的15日齡TN1水稻苗上,并分別置于南京本地磁場的GMF(49 μT)和近零磁場NZMF(1.8 μT)中,溫濕度和光周期等環境條件同1.2。每日記錄各處理試蟲死亡情況。
1.6 干擾效率檢查
于RNAi處理后的24、48及72 h,隨機取各處理位于GMF中的雌蟲各9只,生物學重復設置3次,進行RNA抽提及基因RNAi后表達量情況測定。RT-qPCR采用20 μL體系,即SYBR?TM10 μL,上下游引物(10 μmol·L-1)各0.4 μL,ROX Reference Dey 0.4 μL,cDNA模板2 μL,ddH2O 6.8 μL。RT-qPCR反應采用兩步法程序,即95℃預變性30 s,95℃變性5 s,60℃退火34 s,循環40次。擴增片段(引物列于表 1)經過測序和原序列比對,以和基因為雙內參,以Comparative ΔΔCT法檢測褐飛虱、及的相對表達量。
1.7 數據統計與分析
試驗數據通過Excel 2010軟件進行匯總整理,并采用SPSS16.0軟件進行數據分析。其中,dsRNA的干擾效率通過獨立樣本T檢驗進行分析,敲減關鍵磁響應基因(、、)、磁場變化(NZMF vs GMF)及其交互作用對褐飛虱雌雄成蟲壽命的影響分別通過雙因子方差分析(Two-way ANOVA)進行比較,并采用群體T檢驗進行處理間差異顯著性比較(<0.05為顯著,<0.01為極顯著)。
2 結果
2.1 dsRNA干擾效率
RT-qPCR結果顯示,與注射ds的陰性對照相比,注射ds、ds和ds的雌成蟲體內各對應基因1—3 d的相對表達量均顯著或極顯著降低(<0.05或0.01)。與注射ds的陰性對照相比,注射ds2 d后試蟲體內表達量顯著降低了71%(<0.05),注射3 d后該基因表達量仍維持在較低水平,但差異不顯著(圖1-A);注射ds1—2 d后試蟲體內表達量分別極顯著降低了49%和54%(<0.01,圖1-B);注射ds2—3 d后試蟲體內表達量分別顯著降低了60%和53%(<0.05,圖1-C)。可見,顯微注射ds對3個磁響應關鍵的靶標基因具有相應的干擾效果。
2.2 敲減NlCry1后褐飛虱雌雄成蟲在正常磁場和近零磁場環境下的壽命
RNAi、磁場變化及兩者之間的交互作用均未顯著影響褐飛虱雌雄成蟲的壽命(≤2.87,≥0.092,表2)。與注射ds的對照相比,GMF下注射ds的雌雄成蟲壽命分別縮短了8.36%(圖2-A)和20.26%(圖2-B),NZMF下注射ds的雌雄成蟲壽命分別延長了11.97%(圖2-A)和7.23%(圖2-B);與GMF相比,NZMF下注射ds的雌成蟲壽命縮短了6.70%(圖2-A),而雄成蟲壽命延長了5.00%(圖2-B)。但以上RNAi處理以及磁場處理間差異均不顯著(>0.05,圖2)。
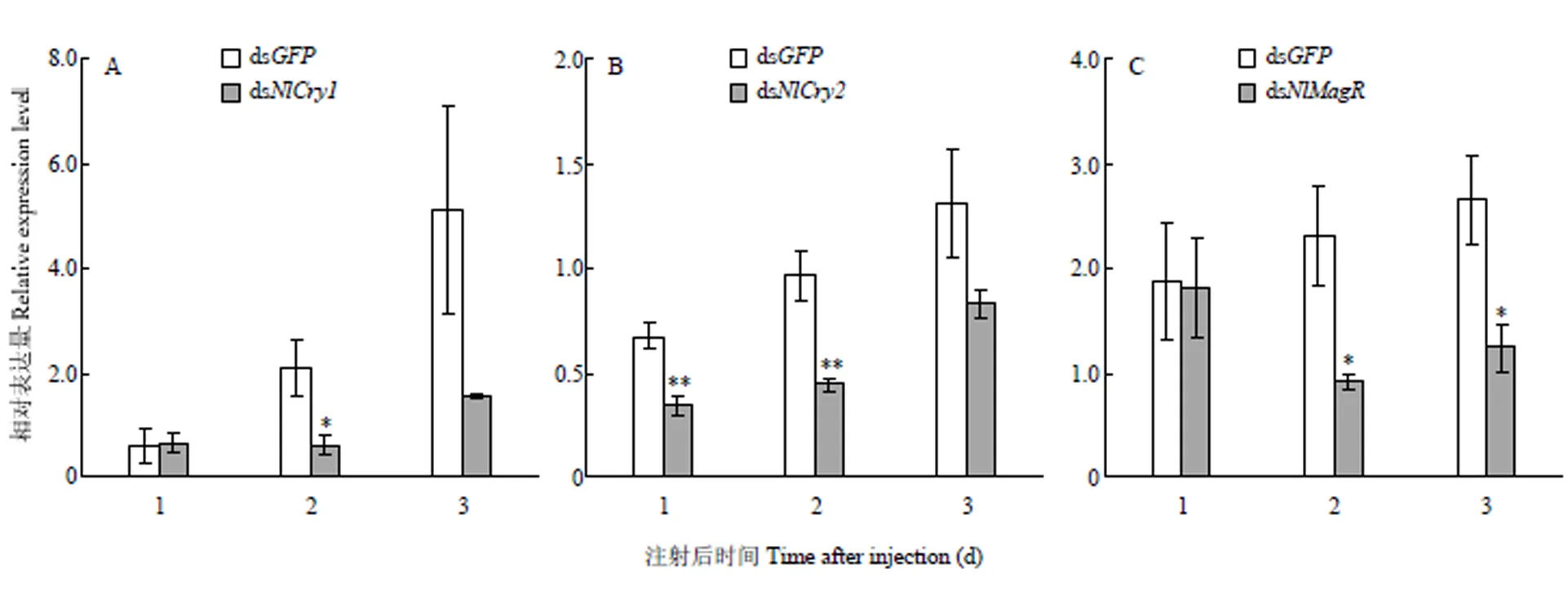
試蟲均為初羽化短翅型雌成蟲,置于B=49 μT的GMF中;*和**分別表示經T檢驗處理間差異達P<0.05和P<0.01的顯著水平
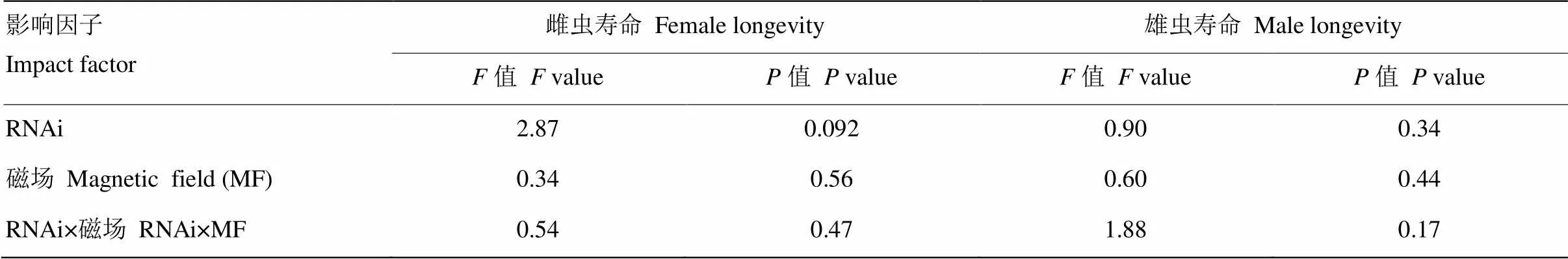
表2 RNAi(dsNlCry1 vs. dsGFP)和磁場處理(GMF vs. NZMF)對褐飛虱雌雄成蟲壽命影響的雙因素方差分析
2.3 敲減NlCry2后褐飛虱雌雄成蟲在正常磁場和近零磁場環境下的壽命
磁場變化顯著影響了褐飛虱雄成蟲壽命(=4.14,=0.044<0.05),且RNAi和磁場變化之間的交互作用還顯著影響了雌成蟲壽命(=4.45,=0.037<0.05),并極顯著地影響了雄成蟲壽命(=7.08,=0.009<0.01,表3)。與注射ds的對照相比,GMF下注射ds的雌成蟲壽命縮短了2.59%,而NZMF下注射ds的雌成蟲壽命延長了13.07%,但差異均不顯著(>0.05,圖3-A);GMF下注射ds的雄成蟲壽命顯著縮短了25.41%(<0.05),而在NZMF下注射ds的雄成蟲壽命縮短了10.73%,但差異不顯著(>0.05,圖3-B)。與GMF相比,NZMF下注射ds的褐飛虱雌雄成蟲壽命分別顯著延長了27.28%和50.04%(<0.05,圖3)。
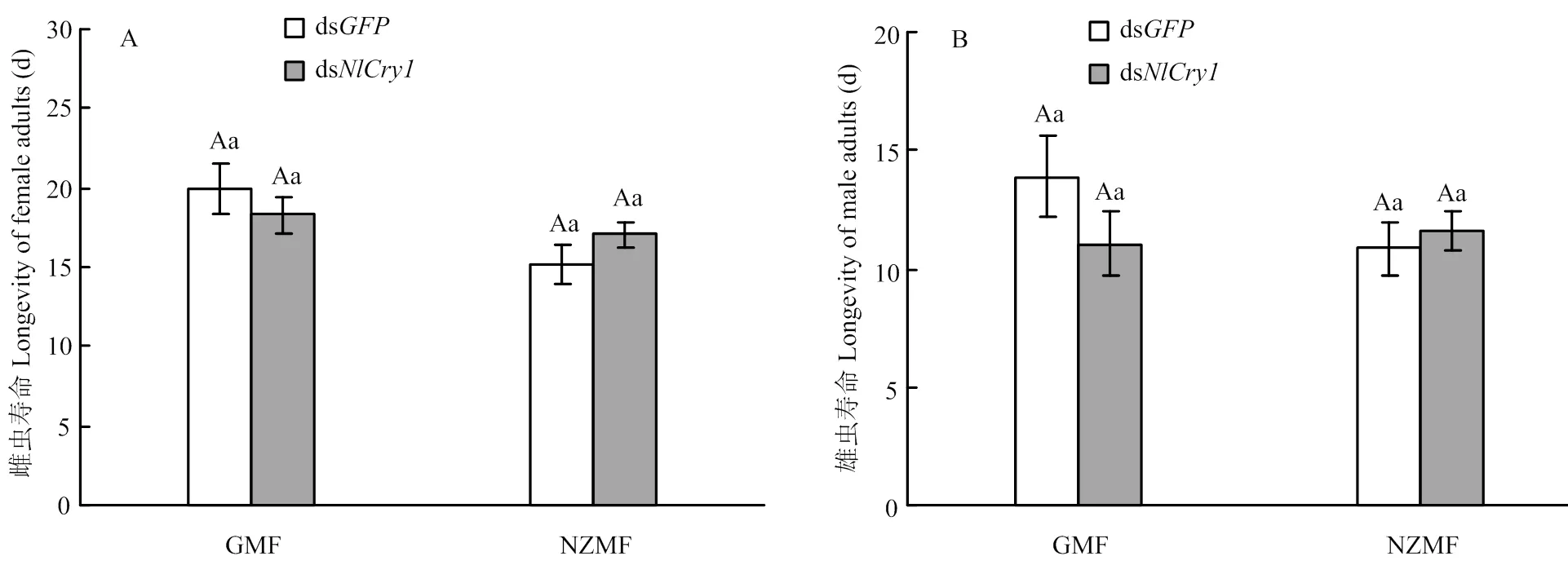
相同小寫字母和相同大寫字母分別表示同一磁場同一性別褐飛虱成蟲壽命在dsNlCry1與dsGFP處理之間,以及同一性別同一RNAi干擾處理下GMF和NZMF處理之間經T檢驗差異不顯著(P>0.05)
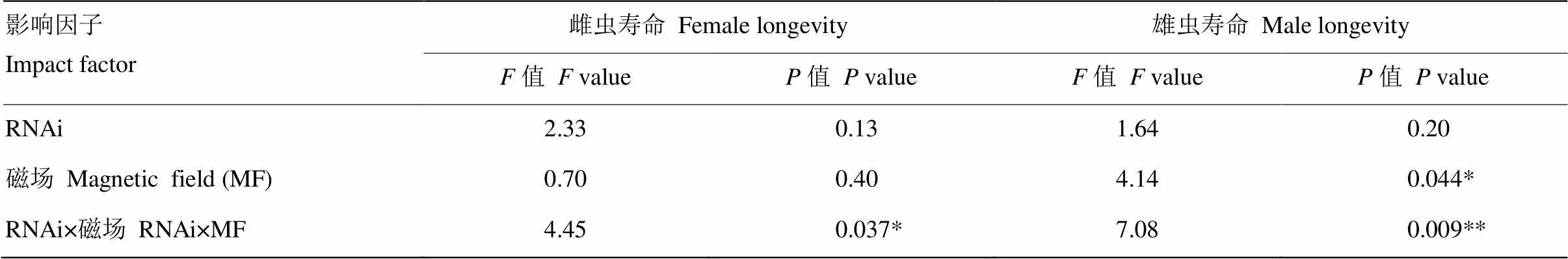
表3 RNAi(dsNlCry2 vs. dsGFP)和磁場處理(GMF vs. NZMF)對褐飛虱雌雄成蟲壽命影響的雙因素方差分析
*<0.05,**<0.01。表4同The same as Table 4
2.4 敲減NlMagR后褐飛虱雌雄成蟲在正常磁場和近零磁場環境下的壽命
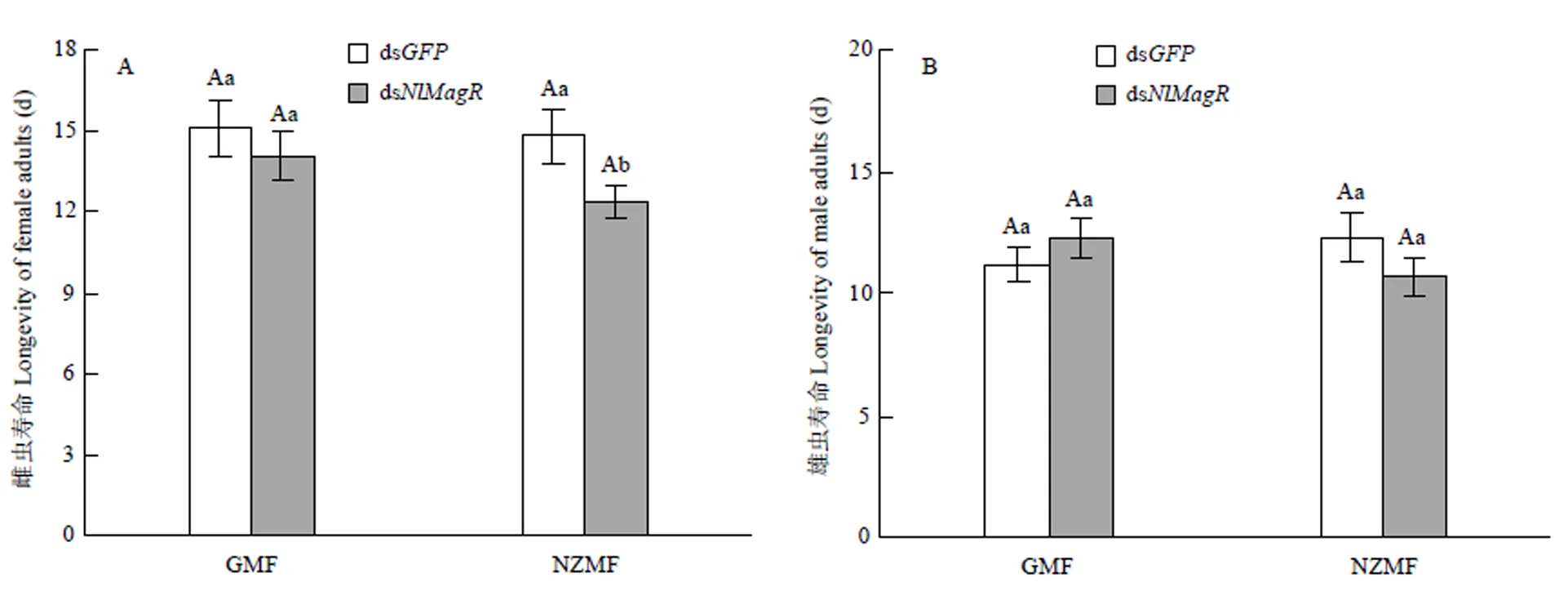
RNAi及其與磁場變化之間的交互作用均未顯著影響褐飛虱雌雄成蟲壽命(≤2.59,≥0.11),敲減僅在NZMF下顯著影響了雌成蟲壽命(=3.97,=0.048<0.05,表4)。與注射ds的對照相比,GMF下注射ds的雌成蟲壽命縮短6.69%,NZMF下則顯著縮短16.48%(<0.05,圖4-A);GMF下注射ds的雄成蟲壽命延長9.32%,而NZMF下則縮短12.98%,但二者差異并不顯著(>0.05,圖4-B);與GMF相比,NZMF下注射ds的褐飛虱雌雄蟲壽命分別縮短了12.16%和12.68%,但差異并未達到顯著水平(>0.05,圖4)。

不同小寫字母和不同大寫字母分別表示同一磁場同一性別褐飛虱成蟲壽命在dsNlCry2與dsGFP處理之間,以及同一性別同一RNAi干擾處理下GMF和NZMF處理之間經T檢驗差異顯著(P<0.05)
不同小寫字母和不同大寫字母分別表示同一磁場同一性別褐飛虱成蟲壽命在dsNlMagR與dsGFP處理之間,以及同一性別同一RNAi干擾處理下GMF和NZMF處理之間經T檢驗差異顯著(P<0.05)
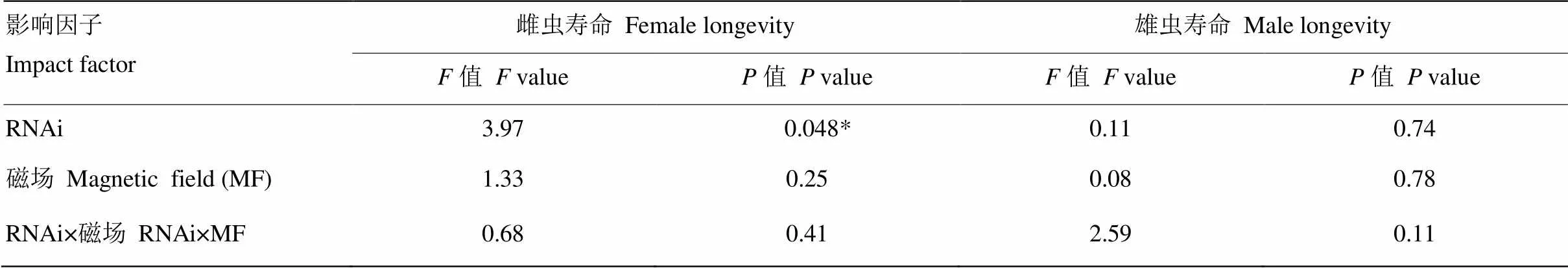
表4 RNAi(dsNlMagR vs. dsGFP)和磁場處理(GMF vs. NZMF)對褐飛虱雌雄蟲壽命影響的雙因素方差分析
3 討論
近年來,大量研究表明隱花色素(Cry)可作為潛在磁受體參與生物的磁場響應過程。昆蟲中的果蠅只含有一種隱花色素,可作為研究該蛋白響應磁場變化的模式生物。有關行為學實驗表明,全光照下野生型果蠅可對磁場作出顯著反應,而隱花色素缺陷的果蠅突變體則對磁場無響應,有趣的是,當屏蔽藍紫光(即隱花色素可接收的光譜)后,即使是野生型果蠅也不再響應磁場的變化,證實了隱花色素的存在是果蠅進行磁響應活動的必要條件,也為基于隱花色素的磁敏系統提供了首個遺傳學證據[30]。隨后,在有關晝夜節律的研究中發現,藍光光譜下磁場可增強隱花色素對果蠅生物鐘節律的“減緩”現象,而隱花色素突變體果蠅中則未觀察到這一現象[31]。此外,另有研究發現,果蠅的負趨地性會受到磁場的干擾,而這種“干擾”又受隱花色素的調節,具體而言,破壞隱花色素的羧基端后,磁場對果蠅負趨地性的影響消失,證明隱花色素在這一信號通路中發揮著重要的作用[32]。近期一項針對磁場對稻飛虱生物學效應的研究表明,與GMF相比,NZMF使白背飛虱若蟲歷期延長,并顯著縮短了長翅未交配白背飛虱成蟲壽命;且RT-qPCR結果顯示,NZMF下5齡若蟲體內的和均上調表達[33]。本研究中,注射ds后,相比GMF,NZMF中褐飛虱雌雄成蟲壽命均顯著延長,而作為陰性對照的ds處理組雌雄蟲壽命在磁場間均無顯著差異,且雙因素方差分析顯示,磁場與干擾互作對褐飛虱成蟲壽命有極顯著影響,表明該基因可對磁場變化產生敏感響應。此外,磁場與敲減的交互作用對不同性別的褐飛虱成蟲壽命的影響不同,具體表現為注射ds后,NZMF下褐飛虱雌雄成蟲壽命均呈現延長趨勢;注射ds后,NZMF下褐飛虱雌雄成蟲壽命均出現縮短的趨勢;而注射ds后,NZMF下雌成蟲壽命延長,雄成蟲壽命縮短,即表現“性二型性”。綜上所述,參與了褐飛虱成蟲的壽命調控,且該過程受到磁場影響,符合隱花色素可響應磁場變化的假說。
本研究中,干擾后褐飛虱的成蟲壽命在不同磁場處理間存在顯著差異,而干擾后褐飛虱的成蟲壽命在磁場處理間無顯著差異,可見不同磁場環境下兩種隱花色素調控褐飛虱成蟲壽命的功能不同。隱花色素主要在動物的生物鐘調控方面發揮重要作用,可分為兩類,即光敏的Ⅰ型隱花色素和非光敏的Ⅱ型隱花色素;其中,Ⅰ型為藍光受體,在生物鐘系統中起著感光作用,而Ⅱ型為晝夜節律調節過程中的反饋回路抑制子[34]。褐飛虱的兩種隱花色素基因與分別屬于動物Ⅰ型與動物Ⅱ型隱花色素。有研究表明,與在褐飛虱的發育生理中扮演著不同的角色,前者在褐飛虱的遷徙行為中發揮作用,而后者對晝夜節律的適應顯示出更明顯的動態變化[29]。可見更有可能作為動物生物鐘的核心組件。而生物鐘又可與神經內分泌系統協同作用[35-37],二者可能間接調控昆蟲體內激素穩態,如蛻皮激素、保幼激素的分泌等[38-40]。因此,可能作為關聯磁場效應與激素信號傳導的“橋梁”,進而在褐飛虱的生物鐘系統中發揮潛在作用。另一方面,或與稻飛虱的趨光行為有關。Wan等研究表明,NZMF顯著提高了初羽化2日齡的白背飛虱內的正趨光性;且RT-qPCR結果顯示,該時段內其體內上調表達,進而推測NZMF提高白背飛虱正趨光性或與羧基端多效性有關[27]。因此,作為Ⅰ型隱花色素,可能更多發揮感光受體作用,或參與調節磁場影響下的起飛或趨光等行為,而不參與磁場對褐飛虱壽命的調控。
鐵硫簇蛋白IscA屬于鐵硫蛋白亞家族hesB,是一類高度保守的蛋白。近期,Qin等研究發現該蛋白在離體條件下具有磁性,推測可能是一種全新的磁受體蛋白[21-22]。Qin等[21]以離體實驗為主,認為鐵硫簇蛋白與隱花色素結合,前者感磁,后者感光,協同發揮“生物指南針”功能;而Long等[22]以線蟲為研究對象,認為鐵硫簇蛋白不需與隱花色素結合便可發揮磁受體功能。但該理論提出后受到質疑,且缺乏活體驗證,至今仍無后續相關報道。本研究中,NZMF下干擾的褐飛虱雌蟲壽命顯著短于對照處理,而雄蟲中雖有相似趨勢,卻未達顯著水平,推測NlMagR或對磁場存在一定的感知,且它的缺失可縮短雌蟲壽命,進而影響其生長發育。鐵硫簇蛋白是一類重要的線粒體內蛋白,MagR(IscA)對于維持線粒體穩定以及調控呼吸能量代謝具有重要生物學意義。有研究表明,缺失該基因會導致鐵元素在酵母菌線粒體內累積,進而使其無法正常生長[41-43]。此外MagR(IscA)也是線粒體鐵硫蛋白成熟所必需的組裝蛋白,敲除斑馬魚體內的會導致其血紅蛋白缺失,從而造成重度貧血[44]。最近有關該基因在人類疾病方面的研究也表明,IscA的異常表達會導致某些疾病的發生,如腦白質病變與神經退行性疾病[45]以及槭糖尿病[46]。本試驗中,GMF條件下干擾后,相較于dsGFP處理,褐飛虱雌成蟲壽命縮短但不顯著,但NZMF條件下干擾該基因后的試蟲壽命進一步縮短達并到顯著水平,這可能暗示了:(1)NlMagR(即鐵硫簇蛋白)的缺失對褐飛虱雌成蟲有消極影響,原因可能是上文提到的線粒體或鐵硫蛋白受損等;(2)NZMF“放大”了NlMagR缺失帶來的消極影響。據此推測NlMagR可以感受磁場的變化,并在褐飛虱雌成蟲的壽命這一體征中有所體現,符合“生物磁受體”的理論要求。
4 結論
對于遷飛型害蟲褐飛虱而言,其體內對磁場變化存在響應,表現為敲減該基因與磁場變化的互作可對褐飛虱雌雄蟲壽命產生顯著影響,且具有“性二型性”;()也可對磁場產生一定響應,但該響應只存在于雌蟲中,雄蟲的影響不明顯;而以壽命為指標不能判定對磁場變化是否存在響應,該基因或與褐飛虱壽命調節無關。研究結果可為進一步明確生物磁受體以及磁響應生物學通路提供有力的理論支撐。
[1] 朱曉璐, 王江云. 地磁場與生物的磁感應現象. 自然雜志, 2013, 35(3): 200-206.
Zhu X L, Wang J Y. The effect of geomagnetism on biomagnetism., 2013, 35(3): 200-206. (in chinese)
[2] Dini L, Abbro L. Bioeffects of moderate-intensity static magnetic fields on cell cultures., 2005, 36(3): 195-217.
[3] 莫煒川, 劉纓, 赫榮喬. 亞磁場及其生物響應機制. 生物化學與生物物理進展, 2012, 39(9): 835-842.
Mo W C, Liu Y, He R Q. A biological perspective of the hypomagnetic field: from definition towards mechanism., 2012, 39(9): 835-842. (in chinese)
[4] 賀靜瀾, 萬貴鈞, 張明, 潘衛東, 陳法軍. 生物地磁響應研究進展. 生物化學與生物物理進展, 2018, 45(7): 689-704.
He J L, Wan G J, Zhang M, Pan W D, Chen F J. Progress in the study of giomagnetic responses of organisms., 2018, 45(7): 689-704. (in chinese)
[5] Lohmann K J, Lohmann C M, Putman N F. Magnetic maps in animals: nature’s GPS., 2007, 210(21): 3697-3705.
[6] Schenck J F. Safety of strong, static magnetic fields., 2000, 12(1): 2-19.
[7] Rosen A D. Mechanism of action of moderate-intensity static magnetic fields on biological systems., 2003, 39(2): 163-173.
[8] 王學斌, 徐慕玲, 李兵, 李東風, 蔣錦昌. 亞磁空間中孵化的一日齡小雞味覺回避長時記憶受損. 科學通報, 2003, 48(19): 2042-2045.
Wang X B, Xu M L, Li B, Li D F, Jiang J C. Long-term memory was impaired in one-trial passive avoidance task of day-old chicks hatching from hypomagnetic field space., 2003, 48(19): 2042-2045. (in chinese)
[9] Zhang B, Lu H, Wang X, Zhou X J, XU S Y, ZHANG K, JIANG J C, LI Y, GUO A K. Exposure to hypomagnetic field space for multiple generations causes amnesia in., 2004, 371(2/3): 190-195.
[10] Prato F S, Robertson J A, Desjardins D, Hensel J, Thomas A W. Daily repeated magnetic field shielding induces analgesia in CD-1 mice., 2005, 26(2): 109-117.
[11] Mo W C, Fu J P, Ding H M, LIU Y, HUA Q, HE R Q. Hypomagnetic field alters circadian rhythm and increases algesia in adult male mice., 2015, 42(7): 639-646.
[12] Bliss V L, Heppner F H.Circadian activity rhythm influenced by near zero magnetic field., 1976, 261(5559): 411-412.
[13] Fesenko E E, Mezhevikina L M , Osipenko M A, GORDON R Y, KHUTZIAN S S.Effect of the “zero” magnetic field on early embryogenesis in mice., 2010, 29(1/2): 1-8.
[14] Mo W C, Liu Y, Cooper H M, HE R Q. Altered development ofembryos in a hypogeomagnetic field., 2012, 33(3): 238-246.
[15] Binhi V N, Sarimov R M. Zero magnetic field effect observed in human cognitive processes., 2009, 28(3): 310-315.
[16] Binhi V N, Sarimov R M. Effect of the hypomagnetic field on the size of the eye pupil., 2013, arXiv:1302.2741.
[17] Gurfinkel Y I, Vasin A L, Matveeva T A, Sasonko M L. Evaluation of the hypomagnetic environment effects on capillary blood circulation, blood pressure and heart rate., 2016, 42(7): 809-814.
[18] SHAW J, BOYD A, HOUSE M, WOODWARD R, MATHES F, COWIN G, SAUNDERS M, BAER B. Magnetic particle-mediated magnetoreception., 2015, 12(110): 0499.
[19] Ritz T, Adem S, Schulten K. A model for photoreceptor-based magnetoreception in birds., 2000, 78(2): 707-718.
[20] Wiltschko R, Wiltschko W.. Berlin Heidelberg: Springer-Verlag, 1995: 33-41.
[21] Qin S Y, Yin H, Yang C L, Dou Y F, Liu Z M, Zhang P, Yu H, Huang Y L, Feng J, Hao J F, Hao J, Deng L Z, Yan X Y, Dong X L, Zhao Z X, Jiang T J, Wang H W, Luo S J, Xie C.A magnetic protein biocompass., 2016, 15(2): 217-226.
[22] Long X, YE J, ZHAO D, Zhang S J. Magnetogenetics: remote non-invasive magnetic activation of neuronal activity with a magnetoreceptor., 2015, 60(24): 2107-2119.
[23] Zhang X, LI J F, WU Q J, LI B, JIANG J C.Effects of hypomagnetic field on noradrenergic activities in the brainstem of golden hamster., 2007, 28(2): 155-158.
[24] Chapman J W, Drake V A, Reynolds D R. Recent insights from radar studies of insect flight., 2011, 56: 337-356.
[25] Pan W D, Wan G J, Xu J J, Li X M, Liu Y X, Qi L P, Chen F J.Evidence for the presence of biogenic magnetic particles in the nocturnal migratory brown planthopper,., 2016, 6: 18771.
[26] Wan G J, Jiang S L, Zhao Z C, Xu J J, Tao X R, Sword G A, Gao Y B, Pan W D, Chen F J. Bio-effects of near-zero magnetic fields on the growth, development and reproduction of small brown planthopper,and brown planthopper,., 2014, 68: 7-15.
[27] Wan G J, Yuan R, Wang W J, Fu KY, Zhao J Y, Jiang S L, Pan W D, Sword G A, Chen F J. Reduced geomagnetic field may affect positive phototaxis and flight capacity of a migratory rice planthopper., 2016, 121: 107-116.
[28] Xu J J, Zhang Y C, Wu J Q, WANG W H, LI Y, WAN G J, CHEN F J, SWORD G A, PAN W D. Molecular characterization, spatial-temporal expression and magnetic response patterns of the iron-sulfur cluster assembly1 (IscA1) in the rice planthopper,., 2017, DOI 10.1111/1744-7917. 12546.
[29] Xu J J, Wan G J, Hu D B, He J, Chen F J, Wang X H, Hua H X, Pan W D. Molecular characterization, tissue and developmental expression profiles of cryptochrome genes in wing dimorphic brown planthoppers,., 2016, 23(6): 805-818.
[30] Gegear R J, Casselman A, Waddell S, Reppert S M. Cryptochrome mediates light-dependent magnetosensitivity in., 2008, 454(7207): 1014-1018.
[31] Yoshii T, Ahmad M, Helfrich-F?rster C. Cryptochrome mediates light-dependent magnetosensitivity of’s circadian clock., 2009, 7(4): e1000086.
[32] Fedele G, Green E W, Rosato E, Kyriacou C P. An electromagnetic field disrupts negative geotaxis invia a CRY-dependent pathway., 2014, 5: 4391.
[33] Wan G J, Wang W J, Xu J J, Yang Q F, Dai M J, Zhang F J, Sword G A, Pan W D, Chen F J. Cryptochromes and hormone signal transduction under near-zero magnetic fields: New clues to magnetic field effects in a rice planthopper., 2015, 10(7): e0132966.
[34] Zhu H, Yuan Q, Froy O, casselman a, reppert s m. The two CRYs of the butterfly., 2005, 15(23): R953-R954.
[35] Henrich V C, Rybczynski R, Gilbert L I.Peptide hormones, steroid hormones, and puffs: mechanisms and models in insect development., 1998, 55: 73-125.
[36] Stay B.A review of the role of neurosecretion in the control of juvenile hormone synthesis: a tribute to Berta Scharrer., 2000, 30(8/9): 653-662.
[37] Yamanaka N, Rewitz K F, O’Connor M B. Ecdysone control of developmental transitions: lessons fromresearch., 2013, 58: 497-516.
[38] Dubrovsky E B. Hormonal cross talk in insect development., 2005, 16(1): 6-11.
[39] Sandrelli F, Costa R, Kyriacou C P, Rosato E. Comparative analysis of circadian clock genes in insects., 2008, 17(5): 447-463.
[40] Yamanaka N, Romero N M, Martin F A, Rewitz K F, Sun M, O’Connor M B, Léopold P. Neuroendocrine control oflarval light preference., 2013, 341(6150): 1113-1116.
[41] Jensen L T, Culotta V C. Role ofandin iron homeostasis., 2000, 20(11): 3918-3927.
[42] Kaut A, Lange H, Diekert K, Kispal G, Lill R. Isa1p is a component of the mitochondrial machinery for maturation of cellular iron-sulfur proteins and requires conserved cysteine residues for function., 2000, 275(21): 15955-15961.
[43] Pelzer W, Muhlenhoff U, Diekert K, Siegmund K, Kispal G, Lill R. Mitochondrial Isa2p plays a crucial role in the maturation of cellular iron-sulfur proteins., 2000, 476(3): 134-139.
[44] Nilsson R, Schultz I J, Pierce E L, Soltis K A, Naranuntarat A, Ward D M, Baughman J M, Paradkar P N, Kingsley P D, Culotta V C, Kaplan J, Palis J, Paw B H, Mootha V K. Discovery of genes essential for heme biosynthesis through large-scale gene expression analysis., 2009, 10(2): 119-130.
[45] Al-Hassnan Z N, Al-Dosary M, Alfadhel M, Faqeih E A, Alsagob M, Kenana R, Almass R, Al-Harazi O S, Al-Hindi H, Malibari O I, Almutari F B, Tulbah S, Alhadeq F, Al-Sheddi T, Alamro R, Al-Asmari A, Almuntashri M, Alshaalan H, Al-Mohanna F A, Colak D, Kaya N.mutation causes infantile neurodegenerative mitochondrial disorder., 2015, 52(3): 186-194.
[46] Gelling C, Dawes I W, Richhardt N, Lill R, Mühlenhoff U. Mitochondrial Iba57p is required for Fe/S cluster formation on aconitase and activation of radical SAM enzymes., 2008, 28(5): 1851-1861.
Effects of the interference of key magnetic response genes on the longevity of brown planthopper () under near-zero magnetic field
He JingLan1, Zhang Ming1, Liu RuiYing1, Wan GuiJun1, Pan WeiDong2, Chen FaJun1
(1College of Plant Protection, Nanjing Agricultural University, Nanjing 210095;2Beijing Key Laboratory of Bioelectromagetics, Institute of Electrical Engineering, Chinese Academy of Sciences, Beijing 100190)
【Objective】cryptochrome (Cry) and iron-sulfur cluster protein IscA (iron-sulfur cluster assembly, MagR) are potential magnetic receptor proteins in organisms. In this study, key magnetic response genes of the brown planthopper () were knocked-down by RNA interference (RNAi), including,and. The objective of this study is to investigate the role of these three magnetic response genes in the longevity mediation ofin near-zero magnetic field (NZMF). Thus, the response of these three genes to magnetic field could be studied indirectly.【Method】Newly emerged brachypterous female and male adults offed in the lab magnetic field were chosen as the experimental material, and RNAi technology was used to inhibit the key magnetic response genes’ (,and) expression by injection of double stranded RNA, respectively. Then the RNAi treated adults were immediately transformed into the geomagnetic field (GMF) and NZMF respectively to observe their longevity. the total RNA of the RNAi treated adults under GMF was extracted by using the RNAiso Plus method on the 1st, 2nd and 3rd day after the microinjection, respectively. And then the gene expressions of,andwere measured by using the RT-qPCR (real-time quantitative polymerase chain reaction) after the reverse transcription synthesis of first strand DNA in order to test the efficiency of RNAi. 【Result】There was no significant difference in the longevity of female and male adults after the injection of dsbetween the treatments of NZMF and GMF, while after the injection of ds, the longevity of female (27.78%) and male (50.04%) adults under NZMF was significantly longer than that of the individuals under GMF, respectively. Moreover, the longevity of female adults injected with dswas shorter under GMF while longer under NZMF than that of individuals injected with ds, even if the difference was not significant. The longevity of male adults injected with dswas shorter than that of individuals injected with dsunder NZMF (25.41%) and GMF (10.73%), respectively, and the difference under GMF reached the significant level. Furthermore, the longevity of female adults injected with dswas significantly shorter (16.48%) than that of individuals injected with dsunder the NZMF. 【Conclusion】There is a difference in the regulation of the key genes of magnetic susceptibility (,and) on the female and male longevity forunder the change of magnetific field. Hereinto, thesusceptibly responses to the changes of magnetic fields, which shows that the gene knock-down and its interaction with magnetic field changes can significantly influence the longevity of female and male adults, and characterized as “sexual dimorphism”. Similarly, the()also sensitively responds to magnetic field changes, but just for the female adults ofunder the NZMF in contrast to the GMF. However, there is no response ofto magnetic field changes, and this gene may not be involved in the regulation of female and male longevity for.
magnetic field changes;brown planthopper ();magnetic response gene; RNA interference (RNAi); adult longevity; magnetic bio-effect
10.3864/j.issn.0578-1752.2019.01.005
2018-08-02;
2018-09-11
國家自然科學基金(31670855)、國家自然科學基金青年科學基金(31701787)、江蘇省自然科學基金青年基金(BK20160717)、中央高校基本科研業務費青年科技創新基金(KJQN201820)
賀靜瀾,E-mail:2016102054@njau.edu.cn。通信作者陳法軍,E-mail:fajunchen@njau.edu.cn
(責任編輯 岳梅)

