甜菜夜蛾卵黃原蛋白受體基因的RNA干擾
趙靜,陶蓉,郝德君,肖留斌,譚永安
?
甜菜夜蛾卵黃原蛋白受體基因的RNA干擾
趙靜1,2,陶蓉1,郝德君1,肖留斌2,譚永安2
(1南京林業(yè)大學(xué)南方現(xiàn)代林業(yè)協(xié)同創(chuàng)新中心/林學(xué)院,南京 210037;2江蘇省農(nóng)業(yè)科學(xué)院植物保護(hù)研究所,南京 210014)
【目的】卵黃原蛋白受體(vitellogenin receptor,VgR)是介導(dǎo)昆蟲卵黃原蛋白胞吞作用的主要受體,通過RNA干擾(RNAi)方法研究甜菜夜蛾()的功能,為深入了解甜菜夜蛾生殖生理的分子機(jī)制及開發(fā)有效防治新方法提供依據(jù)。【方法】以甜菜夜蛾雌成蟲腹部的cDNA為模板,通過PCR克隆得到甜菜夜蛾基因片段,其包含配體結(jié)合域功能區(qū)。綠色熒光蛋白基因()片段通過特異性引物從筆者實(shí)驗(yàn)室保存的質(zhì)粒上擴(kuò)增。將和目的片段連入pMD-19T載體后進(jìn)行測(cè)序,利用DNAMAN軟件分析基因序列的準(zhǔn)確性。以測(cè)序驗(yàn)證正確的質(zhì)粒作為DNA模板,利用帶T7啟動(dòng)子的引物進(jìn)行PCR擴(kuò)增。用T7 RiboMAXTMExpress RNAi System合成試劑盒合成-dsRNA和-dsRNA。應(yīng)用10 μL微量進(jìn)樣器在化蛹第2、6天的甜菜夜蛾雌蛹腹部注射3 μL雙鏈RNA(2 μg·μl-1)。利用RT-qPCR技術(shù)檢測(cè)甜菜夜蛾剛羽化、羽化24 h、羽化48 h雌成蟲的表達(dá)量變化,同時(shí)統(tǒng)計(jì)對(duì)照組(空白對(duì)照、注射-dsRNA)和處理組(注射-dsRNA)甜菜夜蛾的羽化率及單雌產(chǎn)卵量。【結(jié)果】 擴(kuò)增得到和基因片段,大小分別為327和417 bp。RT-qPCR 檢測(cè)結(jié)果表明,與對(duì)照組相比,注射dsRNA后甜菜夜蛾的表達(dá)水平顯著下降。對(duì)于剛羽化、羽化24 h、羽化48 h的雌成蟲,注射-dsRNA處理組的表達(dá)量相比注射-dsRNA的對(duì)照組分別下降了79.35%、84.22%、67.68%。通過解剖觀察剛羽化、羽化24 h、羽化48 h的甜菜夜蛾卵巢,發(fā)現(xiàn)注射-dsRNA處理組與注射-dsRNA對(duì)照組相比, 卵巢發(fā)育進(jìn)度顯著推遲。對(duì)于羽化24 h的甜菜夜蛾,與注射-dsRNA組相比,注射-dsRNA處理組卵巢管長(zhǎng)度下降了23.92%;注射-dsRNA組的卵巢成熟卵粒較多,平均直徑為(0.46±0.05)mm,而注射-dsRNA處理組成熟卵粒數(shù)量較少且相對(duì)較小,平均直徑為(0.23±0.02)mm。注射-dsRNA組和-dsRNA組的羽化率無(wú)顯著差異。注射-dsRNA處理組的單雌平均產(chǎn)卵量只有170粒,而對(duì)照組(空白對(duì)照和注射-dsRNA)單雌平均產(chǎn)卵量可達(dá)到451粒和420粒,處理組與對(duì)照組的產(chǎn)卵量存在顯著差異。【結(jié)論】通過體外注射dsRNA的方法研究的功能,能夠顯著降低表達(dá)。在甜菜夜蛾的生殖中起著不可替代的作用,直接影響甜菜夜蛾卵巢的發(fā)育與產(chǎn)卵量,可以作為控制甜菜夜蛾的潛在靶標(biāo)。
甜菜夜蛾;卵黃原蛋白受體基因;RNA干擾;卵巢發(fā)育
0 引言
【研究意義】卵黃原蛋白(vitellogenin,Vg)的合成與攝取是昆蟲卵黃形成的關(guān)鍵因素[1-2],其含量高低直接影響雌成蟲產(chǎn)卵潛力。卵黃原蛋白受體(vitellogenin receptor,VgR)是介導(dǎo)昆蟲卵黃原蛋白胞吞作用的主要受體,對(duì)昆蟲卵巢的成熟起著至關(guān)重要的作用,是研究控制害蟲的潛在靶標(biāo)[3-4]。甜菜夜蛾()作為一種世界性分布的多食性重要害蟲,由于其繁殖能力強(qiáng)及較高的抗藥性,亟待開拓減少化學(xué)農(nóng)藥使用的新型無(wú)公害防控手段[5-7]。因此,開展的研究,對(duì)于深入了解甜菜夜蛾生殖生理的分子機(jī)制及開發(fā)有效防治新方法具有重要意義。【前人研究進(jìn)展】目前,關(guān)于昆蟲的研究非常活躍,32種昆蟲的序列已被克隆和測(cè)序,其中大部分是鱗翅目、雙翅目和膜翅目昆蟲,包括家蠶()、斜紋夜蛾()、埃及伊蚊()、紅火蟻()等[8-19]。昆蟲在體內(nèi)合成具有發(fā)育時(shí)期和組織的特異性。大多數(shù)昆蟲的屬于卵巢特異性表達(dá)蛋白,例如橘小實(shí)蠅()[14]、美洲大蠊()[15]、棉鈴蟲()[16]等昆蟲的僅在卵巢中表達(dá)。對(duì)于一些社會(huì)性昆蟲如西方蜜蜂()[12]和紅斑尼葬甲()[18]的研究發(fā)現(xiàn),在頭部、中腸等其他組織也有表達(dá)。不同昆蟲的表達(dá)啟動(dòng)期也不同,大多數(shù)昆蟲的表達(dá)發(fā)生在蛹末期或初羽化成蟲之后,例如斜紋夜蛾[9]、甜菜夜蛾[17]、馬德拉蜚蠊()[19]等,但在家蠶中,在雌性家蠶的整個(gè)發(fā)育周期均有表達(dá),幼蟲期表達(dá)水平較低,隨后逐漸升高,在成蟲期達(dá)到最大值[8]。RNA干擾(RNA interference,RNAi)是由dsRNA或siRNA通過序列配對(duì)的方式特異性地與靶標(biāo)基因mRNA序列相結(jié)合,形成沉默復(fù)合體,降解靶標(biāo)基因的mRNA[20]。目前,RNAi技術(shù)已廣泛地應(yīng)用于鱗翅目、半翅目、膜翅目、鞘翅目等多種昆蟲的基因功能研究[21-26]。通過對(duì)昆蟲生長(zhǎng)發(fā)育及繁殖關(guān)鍵基因的鑒定和功能分析,可為開發(fā)植物或微生物介導(dǎo)的RNAi 技術(shù)的防治新途徑提供理論依據(jù)及新的潛在靶標(biāo)基因資源。Pitino等[27]將桃蚜()的兩個(gè)與生長(zhǎng)發(fā)育相關(guān)的基因(MpC002和Rack-1)分別導(dǎo)入煙草和擬南芥中,用轉(zhuǎn)基因植物飼喂桃蚜,導(dǎo)致桃蚜體內(nèi)的MPC002或Rack-1的表達(dá)量降低了60%,后代數(shù)量減少。然而,目前關(guān)于昆蟲的功能研究?jī)H僅局限于少數(shù)昆蟲,主要關(guān)注其對(duì)昆蟲卵黃形成、卵巢發(fā)育以及生殖能力的影響。如在家蠶和褐飛虱()中,通過干擾的表達(dá),呈現(xiàn)卵巢發(fā)育受阻、不能產(chǎn)卵或產(chǎn)卵量下降等表型[8,26]。【本研究切入點(diǎn)】筆者實(shí)驗(yàn)室前期研究已克隆甜菜夜蛾并明確其時(shí)空表達(dá)特性[17],但甜菜夜蛾的功能尚不明確。【擬解決的關(guān)鍵問題】利用體外合成的甜菜夜蛾卵黃原蛋白受體保守序列dsRNA注射甜菜夜蛾,通過熒光定量PCR(RT-qPCR)分析注射后甜菜夜蛾的表達(dá)情況,研究其對(duì)甜菜夜蛾的卵巢發(fā)育和產(chǎn)卵量的影響,明確在卵黃合成中的作用,以期為利用RNAi技術(shù)防治甜菜夜蛾提供理論依據(jù)。
1 材料與方法
試驗(yàn)于2018年在江蘇省農(nóng)業(yè)科學(xué)院植物保護(hù)研究所完成。
1.1 材料
供試甜菜夜蛾蟲源來自江蘇省農(nóng)業(yè)科學(xué)院植物保護(hù)研究所經(jīng)濟(jì)作物蟲害與生防研究室。甜菜夜蛾飼養(yǎng)條件為溫度(26.5±1)℃,相對(duì)濕度(65±5)%,光周期L﹕D=14 h﹕10 h,成蟲期補(bǔ)充10%蜂蜜水。
1.2 甜菜夜蛾總RNA的提取和cDNA的合成
通過液氮研磨甜菜夜蛾雌成蟲的腹部組織,按照試劑盒說明書用Trizol reagent(Invitrogen)提取總RNA,用50 μL的無(wú)RNA酶水溶解,-70℃保存?zhèn)溆谩R钥俁NA為模板,通過M-MLV酶(Promega)反轉(zhuǎn)錄獲得cDNA,于-20℃保存?zhèn)溆谩?/p>
1.3 VgR基因片段的引物設(shè)計(jì)與擴(kuò)增
根據(jù)筆者實(shí)驗(yàn)室前期已發(fā)表的甜菜夜蛾的全長(zhǎng)序列(GenBank登錄號(hào):KT899978)[18],利用Primer5.0 軟件在基因功能區(qū)設(shè)計(jì)引物-F和-R。以甜菜夜蛾cDNA為模板擴(kuò)增特異性片段。綠色熒光蛋白基因()片段通過特異性引物(表1)從筆者實(shí)驗(yàn)室保存的質(zhì)粒上擴(kuò)增。PCR反應(yīng)程序:94℃預(yù)變性3 min,然后按照94℃ 45 s,60℃ 30 s,72℃ 20 s,進(jìn)行35次循環(huán)反應(yīng),最后于72℃延伸10 min。通過瓊脂糖凝膠電泳分離與的PCR產(chǎn)物,并用膠回收試劑盒(Axygen)純化回收目的DNA片段。目的片段與pMD-19T載體(TaKaRa)連接,經(jīng)PCR篩選陽(yáng)性克隆后,通過AxyPrep質(zhì)粒小量制備試劑盒(Axygen)提取質(zhì)粒送上海生工生物工程有限公司測(cè)序。利用DNAMAN軟件分析該基因序列的準(zhǔn)確性,測(cè)序正確的質(zhì)粒為pMD-19T-與pMD-19T-。
1.4 VgR及GFP-dsRNA的合成與注射
以測(cè)序驗(yàn)證正確的質(zhì)粒作為DNA模板,利用帶T7啟動(dòng)子的引物(-TF與-R、-F與-TR;-TF與-R、-F與-TR;表1)分別進(jìn)行兩個(gè)基因PCR產(chǎn)物正義鏈與反義鏈的擴(kuò)增。用1%的瓊脂糖凝膠進(jìn)行電泳分離回收,用T7 Ribo MAXTMExpress RNAi System(Promega)合成試劑盒合成雙鏈RNA(-dsRNA)和雙鏈RNA(-dsRNA),用無(wú)RNA酶水配制成2 μg·μL-1終濃度的試劑備用。
選取甜菜夜蛾化蛹第2天、大小均一的雌蛹用于注射。應(yīng)用10 μL微量進(jìn)樣器將3 μL-dsRNA(2 μg·μL-1)從腹部靠近尾端1/3處注射。在化蛹的第6天再次注射3 μL相同濃度的-dsRNA。注射完畢后,針頭停留約30 s后緩慢拔出,以免體液過多流出。試驗(yàn)設(shè)注射-dsRNA和不注射兩個(gè)對(duì)照組。每個(gè)處理80頭雌蛹,重復(fù)3次,共計(jì)240頭。
1.5 甜菜夜蛾VgR RNAi的效應(yīng)檢測(cè)
1.5.1 甜菜夜蛾表達(dá)量的RT-qPCR檢測(cè) 注射dsRNA后,取甜菜夜蛾剛羽化、羽化24 h、羽化48 h雌成蟲的卵巢組織,對(duì)所搜集組織樣品進(jìn)行總RNA提取,cDNA合成。以注射-dsRNA和不注射為對(duì)照,每個(gè)樣本設(shè)置3個(gè)生物學(xué)重復(fù),每個(gè)重復(fù)4頭蟲體。以?Taq(Takara)為染料,采用LightCycler? 480 實(shí)時(shí)PCR系統(tǒng)進(jìn)行基因擴(kuò)增以及數(shù)據(jù)分析。及的RT-qPCR引物見表1。RT-qPCR總反應(yīng)體系:SYBR Premix Ex Taq(2×)12.5 μL,forward primer(10 μmol·L-1)0.5 μL,reverse primer(10 μmol·L-1)0.5 μL,cDNA 2.0 μL,ddH2O 9.5 μL,總體積25 μL。反應(yīng)條件:95℃ 30 s;95℃ 5 s,60℃ 20 s,72℃ 10 s,40個(gè)循環(huán);95℃ 15 s;60℃ 1 min;95℃ 15 s。最終結(jié)果的計(jì)算采用2-ΔΔCt法(Ct表示循環(huán)數(shù))。
1.5.2 RNAi后甜菜夜蛾卵巢發(fā)育進(jìn)度的觀察以及羽化率、產(chǎn)卵量的統(tǒng)計(jì) 通過統(tǒng)計(jì)對(duì)照組(不注射、注射-dsRNA)和注射-dsRNA處理組羽化蛹皮的數(shù)量來計(jì)算甜菜夜蛾的羽化率。解剖對(duì)照組(不注射、注射-dsRNA)和注射-dsRNA處理組甜菜夜蛾剛羽化、羽化24 h、羽化48 h雌成蟲(每個(gè)處理30頭)的腹部,觀察卵巢發(fā)育進(jìn)度。測(cè)定不同處理組羽化24 h雌成蟲(每個(gè)處理20頭)的卵巢管長(zhǎng)度及成熟卵粒直徑大小。選擇同日羽化的成蟲20對(duì),分別飼養(yǎng),逐日統(tǒng)計(jì)其單雌產(chǎn)卵量。
1.6 數(shù)據(jù)統(tǒng)計(jì)與分析
相對(duì)表達(dá)量、產(chǎn)卵量、羽化率等數(shù)據(jù)使用SPSS軟件進(jìn)行統(tǒng)計(jì)學(xué)分析,采用單因素方差分析并用Duncan’s新復(fù)極差法進(jìn)行差異顯著性檢測(cè),顯著性檢驗(yàn)水平<0.05。
2 結(jié)果
2.1 目的片段的擴(kuò)增
利用甜菜夜蛾卵巢的總RNA和質(zhì)粒為模板,分別擴(kuò)增甜菜夜蛾和,獲得的PCR產(chǎn)物電泳結(jié)果見圖1,分別得到大小為327和417 bp的單一帶,與預(yù)期片段大小一致。
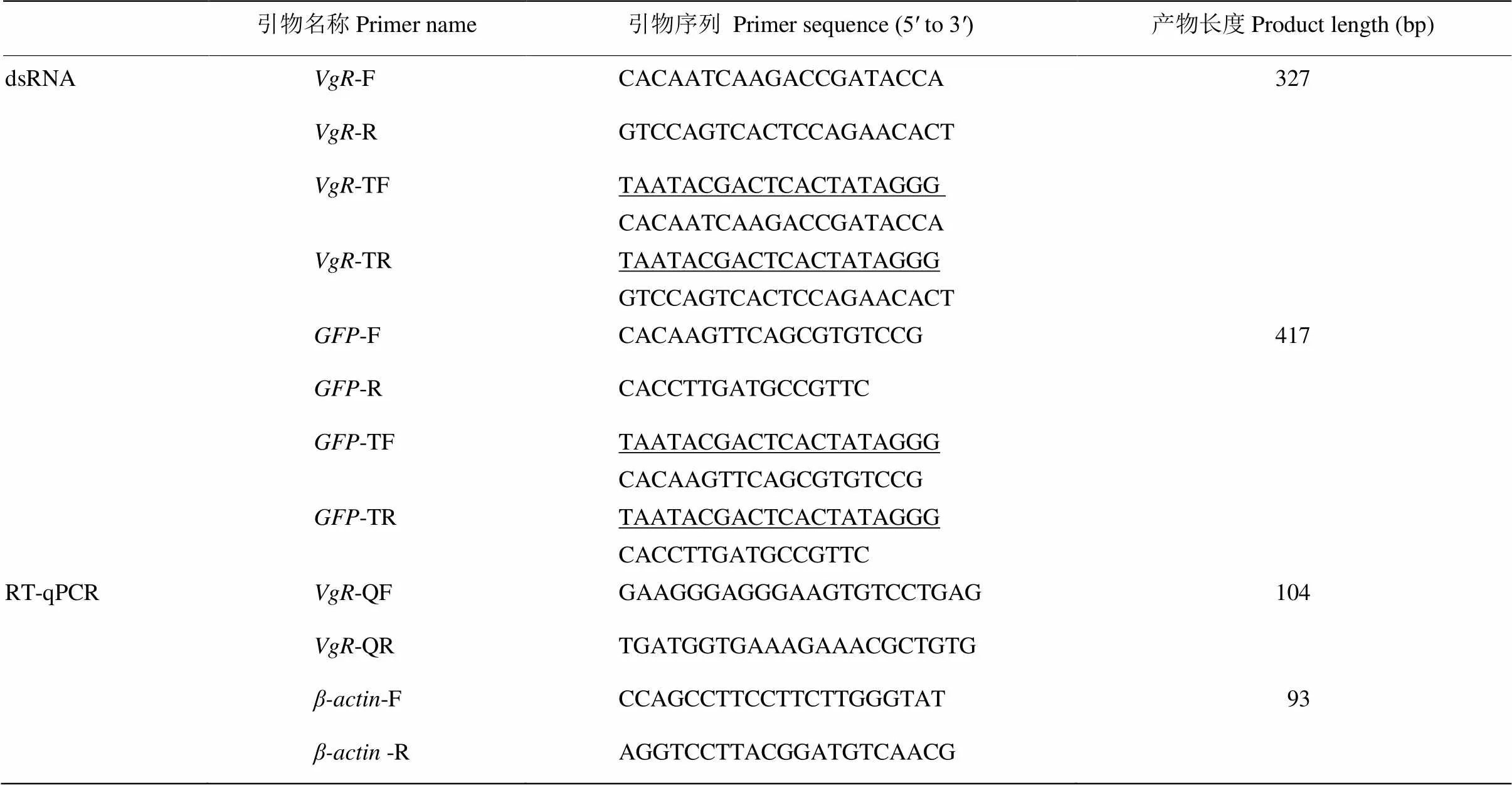
表1 本研究所用引物
下劃線表示T7RNA聚合酶啟動(dòng)子T7RNA polymerase promoter is underlined
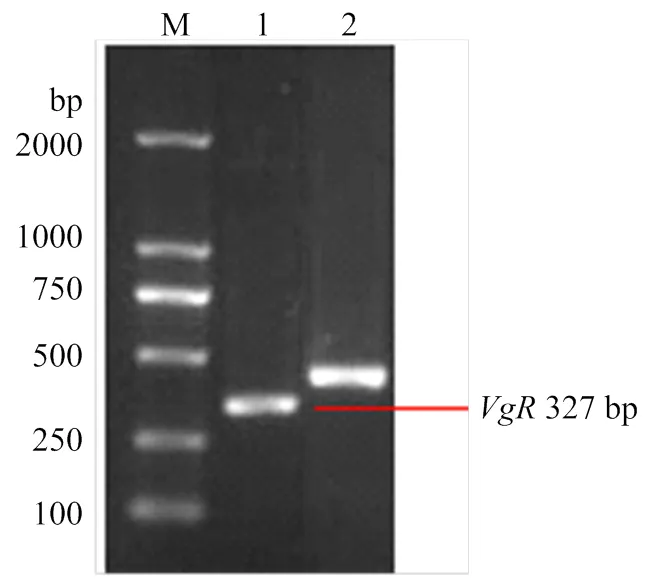
M: Trans2K DNA marker; 1: VgR; 2: GFP
2.2 dsRNA的合成
以pMD-19T-與pMD-19T-質(zhì)粒作為DNA模板,通過PCR擴(kuò)增,在目的序列的兩端加上T7啟動(dòng)子。在T7RNA聚合酶的作用下,轉(zhuǎn)錄合成dsRNA,經(jīng)過一系列洗滌、過柱,得到純化的-dsRNA和-dsRNA,大小約為327和417 bp(圖2),與預(yù)期片段長(zhǎng)度大小一致。
2.3 VgR-dsRNA注射對(duì)甜菜夜蛾VgR表達(dá)量的影響
RT-qPCR檢測(cè)結(jié)果表明,與對(duì)照組相比,注射-dsRNA后的表達(dá)水平顯著下降(圖3)。剛羽化的雌成蟲,注射-dsRNA組的表達(dá)量相比注射-dsRNA的對(duì)照組下降了79.35%;羽化24 h的雌成蟲,注射-dsRNA組的表達(dá)量相比注射-dsRNA的對(duì)照組下降了84.22%;羽化48 h的雌成蟲,注射-dsRNA組的表達(dá)量相比注射-dsRNA的對(duì)照組下降了67.68%。表達(dá)量在不注射dsRNA(ck)和注射-dsRNA的兩個(gè)對(duì)照組之間無(wú)顯著差異(圖3)。說明注射的dsRNA對(duì)該基因具有明顯的沉默效應(yīng)。

1:VgR體外轉(zhuǎn)錄產(chǎn)物dsRNA dsRNA-production of VgR transcripted in vitro;2:GFP對(duì)照Positive control of GFP
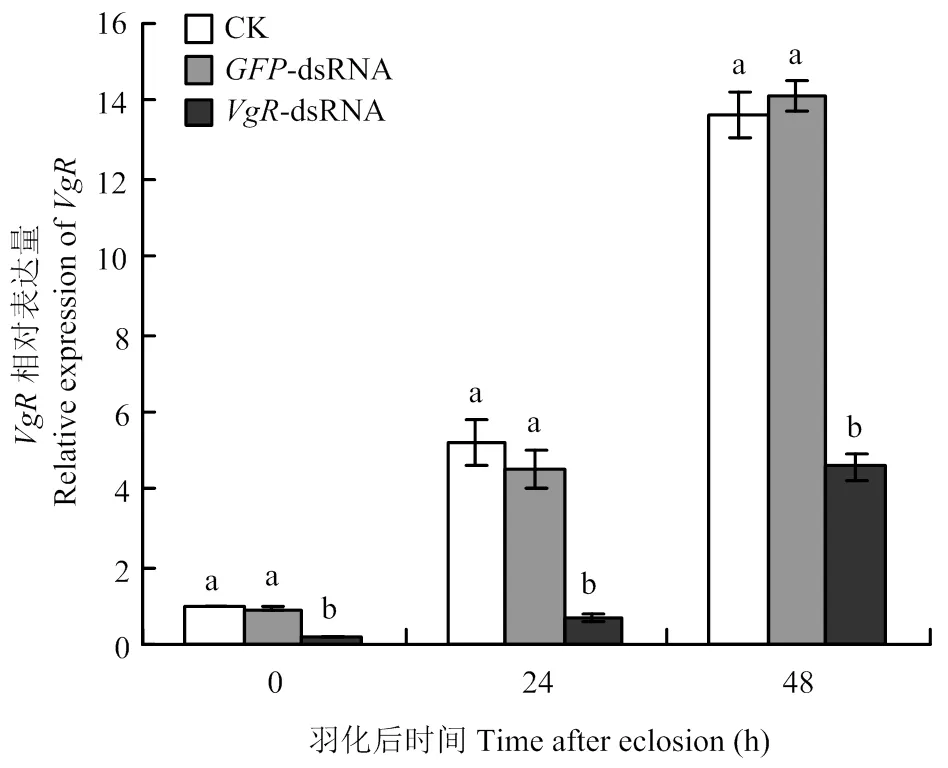
柱上標(biāo)有不同小寫字母表示差異顯著(P<0.05)。圖5同
2.4 VgR-dsRNA注射對(duì)甜菜夜蛾卵巢發(fā)育進(jìn)度的影響
通過解剖觀察剛羽化、羽化24 h、羽化48 h的甜菜夜蛾卵巢,發(fā)現(xiàn)注射-dsRNA組(圖4-a、4-b、4-c)與注射-dsRNA組(圖4-e、4-f、4-g)相比,甜菜夜蛾的卵巢發(fā)育進(jìn)度顯著推遲。測(cè)定羽化24 h的甜菜夜蛾的卵巢管長(zhǎng)度和卵粒大小發(fā)現(xiàn),注射-dsRNA組卵巢管明顯縮短,成熟卵粒數(shù)量和卵粒大小明顯小于注射-dsRNA對(duì)照組。注射-dsRNA組的甜菜夜蛾(羽化24 h)卵巢管長(zhǎng)度為(24.01±1.52)mm,比注射-dsRNA組的卵巢管長(zhǎng)度(31.56±2.03)mm下降了23.92%(圖4-b、4-f);同時(shí),注射-dsRNA組的卵巢成熟卵粒較多,平均直徑為(0.46±0.05)mm(圖4-h),而注射-dsRNA組成熟卵粒較少,卵粒平均直徑為(0.23±0.02)mm,大部分卵粒卵黃沉積較少,處于空癟狀態(tài)(圖4-d)。對(duì)于羽化48 h的甜菜夜蛾卵巢,注射-dsRNA組的干擾效率下降了67.68%,表達(dá)量有所上升(圖3),此時(shí)卵母細(xì)胞中的卵黃沉積加快,卵黃含量增多,但是成熟卵粒數(shù)量還是明顯少于-dsRNA對(duì)照組(圖4-c、4-g)。在解剖過程中,發(fā)現(xiàn)注射-dsRNA組與空白對(duì)照組的卵巢發(fā)育進(jìn)度并無(wú)顯著差異。
2.5 VgR-dsRNA注射對(duì)甜菜夜蛾羽化率及產(chǎn)卵量的影響
以無(wú)注射dsRNA和注射-dsRNA的甜菜夜蛾為對(duì)照,測(cè)定注射-dsRNA后成蟲的羽化率及單雌產(chǎn)卵量,結(jié)果見圖5。可以看出,注射-dsRNA和-dsRNA的甜菜夜蛾的羽化率無(wú)顯著差異,但較對(duì)照組羽化率略降低。注射-dsRNA的甜菜夜蛾單雌平均產(chǎn)卵量只有170粒,而空白對(duì)照和注射-dsRNA的單雌平均產(chǎn)卵量可達(dá)451和420粒。
3 討論
昆蟲細(xì)胞內(nèi)存在將dsRNA切割成siRNA的Dicer酶,長(zhǎng)鏈的dsRNA即可在昆蟲中引起RNAi效應(yīng)[28]。目前將體外合成的dsRNA導(dǎo)入昆蟲活體的方法有注射法和喂食法。與喂食法相比,注射法的優(yōu)點(diǎn)在于便于控制劑量,產(chǎn)生效應(yīng)快,但其局限性體現(xiàn)在操作難度較大。迄今為止,通過注射方法實(shí)現(xiàn)蟲體內(nèi)的RNAi已經(jīng)在多種鱗翅目昆蟲中得以實(shí)施,如煙草天蛾()[29]、家蠶[8]、甜菜夜蛾[21]、棉鈴蟲[16,30]以及斜紋夜蛾[9]等。在前期研究中筆者克隆了甜菜夜蛾的全長(zhǎng)并明確了其表達(dá)規(guī)律,發(fā)現(xiàn)甜菜夜蛾在卵巢特異性表達(dá),其合成和啟動(dòng)期在蛹末期,表達(dá)高峰在成蟲羽化48 h,這與甜菜夜蛾卵巢發(fā)育進(jìn)度緊密相關(guān)[17]。因此,選擇在甜菜夜蛾啟動(dòng)期前期(化蛹第2天)在腹部注射-dsRNA,為了加強(qiáng)RNAi的效果,在蛹末期又注射了相同劑量的dsRNA,表達(dá)量在甜菜夜蛾羽化24 h時(shí)降低了84%。在注射過程中,由于技術(shù)不熟練所造成的機(jī)械損傷對(duì)昆蟲存活率和羽化率會(huì)有一定的影響[21]。本研究中,注射-dsRNA和-dsRNA的試蟲羽化率無(wú)顯著差異,但較未注射的空白對(duì)照組羽化率略降低,可能是機(jī)械損傷導(dǎo)致。
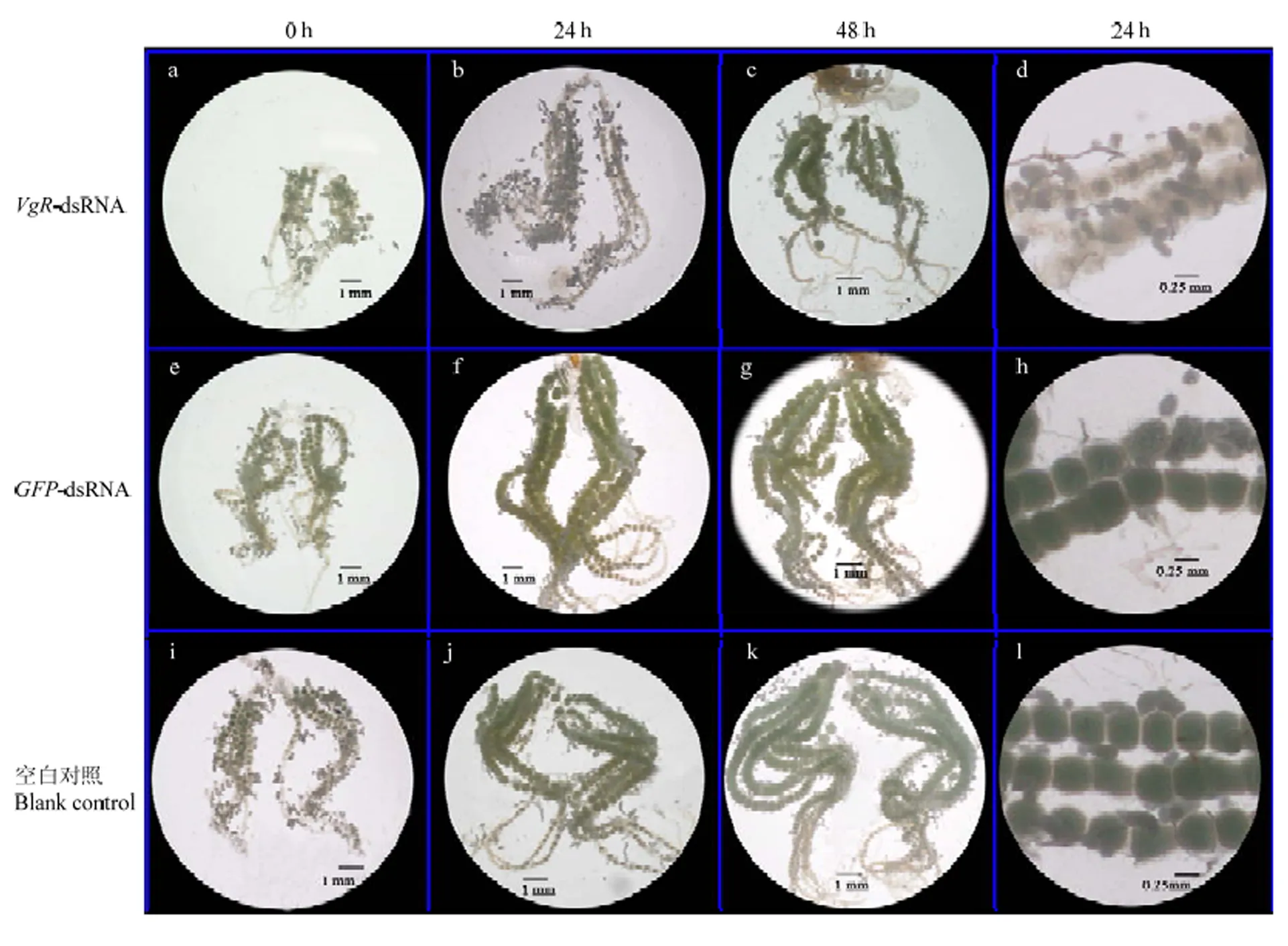
a—c:注射VgR-dsRNA后羽化不同時(shí)間段的雌成蟲卵巢(0、24、48 h)the ovary of 0-, 24-, 48-hour-old adults after VgR-dsRNA injection;e—g:注射GFP-dsRNA后羽化不同時(shí)間段的雌成蟲卵巢(0、24、48 h)the ovariole of 0-, 24-, 48-hour-old adults after GFP-dsRNA injection;i—k:羽化不同時(shí)間段的雌成蟲卵巢(0、24、48 h)the ovary of 0-, 24-, 48-hour-old adults;d:注射VgR-dsRNA后羽化24 h的雌成蟲卵巢管the ovariole of 24-hour-old adults after VgR-dsRNA injection;h:注射GFP-dsRNA后羽化24 h的雌成蟲卵巢管the ovariole of 24-hour-old adults after GFP-dsRNA injection;l:羽化24 h的雌成蟲卵巢管the ovariole of 24-hour-old female adults
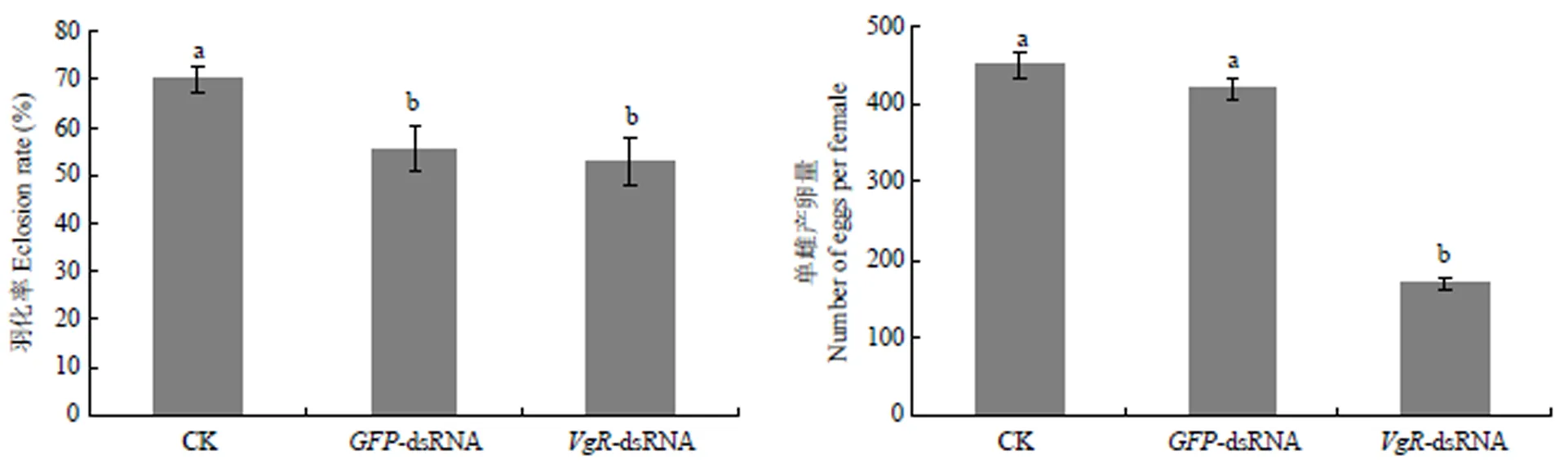
圖5 注射VgR-dsRNA后甜菜夜蛾的羽化率與產(chǎn)卵量
昆蟲有強(qiáng)大的生殖力,能在極短的時(shí)間內(nèi)產(chǎn)生含有大量卵黃的成熟卵。卵黃原蛋白是卵黃的主要成分,它的存在或含量高低直接影響昆蟲的生殖。目前,許多研究者為了探求合理的控制害蟲生殖的方法,采用RNAi技術(shù)沉默介導(dǎo)Vg胞吞作用的卵黃原蛋白受體。對(duì)于昆蟲進(jìn)行RNAi后,重點(diǎn)研究其對(duì)昆蟲卵黃沉積、卵巢發(fā)育進(jìn)度以及生殖能力的影響。Lu等[26]通過向褐飛虱注射-dsRNA,表達(dá)量下調(diào),卵巢表面的受體缺乏不能正常攝取Vg進(jìn)入卵巢,血淋巴中Vg含量增多,最終導(dǎo)致褐飛虱卵巢發(fā)育停滯,不能產(chǎn)卵;Shang等[31]通過對(duì)蚜蟲()注射-dsRNA,發(fā)現(xiàn)蚜蟲的生殖周期有所變化,生殖前期變長(zhǎng),生殖期變短,后代數(shù)量下降。同時(shí),向同一種昆蟲注射不同的-dsRNA,其沉默效果也可能不同;Lin等[8]分別在家蠶蛹第1、4、7天注射兩種-dsRNA,發(fā)現(xiàn)表達(dá)量下降程度不同,mRNA敲除率高的家蠶不能產(chǎn)卵,而mRNA敲除率低的家蠶最終卵粒變小變白;Shu等[9]在斜紋夜蛾的蛹期注射兩種dsRNA,表型基本類似,與對(duì)照相比,血淋巴中Vg含量增多,卵巢中的Vg和VgR含量下降,產(chǎn)卵量顯著下降。與前人研究結(jié)果相似,本研究通過用RNAi方法降低表達(dá)量后,甜菜夜蛾與生殖相關(guān)的卵巢發(fā)育受到了影響,卵母細(xì)胞中沉積的卵黃含量顯著減少,卵巢管變短,直接反映生殖力的產(chǎn)卵量顯著下降。這些結(jié)果表明mRNA表達(dá)是昆蟲Vg攝取和卵發(fā)育的基礎(chǔ)。
甜菜夜蛾是一種重要的世界性害蟲,具有繁殖能力強(qiáng)、易產(chǎn)生抗藥性等特點(diǎn)[5-6]。在昆蟲的生殖中起著不可替代的作用,是卵黃發(fā)生的基礎(chǔ),直接影響昆蟲卵母細(xì)胞的生理與形態(tài)發(fā)育、卵子的數(shù)量[3]。本研究通過體外注射dsRNA的方法研究的功能,表明通過RNAi可以顯著減少甜菜夜蛾的產(chǎn)卵量,起到調(diào)控甜菜夜蛾生殖暴發(fā)的作用,但是如何將-dsRNA應(yīng)用于甜菜夜蛾的防治(dsRNA工程微生物或轉(zhuǎn)基因作物)還需要進(jìn)一步深入研究。
4 結(jié)論
通過合成甜菜夜蛾功能區(qū)序列的dsRNA,體外注射后,能夠顯著降低表達(dá),同時(shí)甜菜夜蛾的卵巢發(fā)育受到了影響,卵母細(xì)胞中沉積的卵黃含量顯著減少,卵巢管變短,直接反映生殖力的產(chǎn)卵量顯著下降。是甜菜夜蛾Vg攝取和卵發(fā)育的基礎(chǔ),可作為控制甜菜夜蛾危害的潛在靶標(biāo)。
[1] 戈林泉, 吳進(jìn)才. 昆蟲卵黃蛋白及其激素調(diào)控的研究進(jìn)展. 昆蟲知識(shí), 2010, 47(2): 236-246.
GE L Q, WU J C. Research progress in insect vitellin and its hormone regulation., 2010, 47(2): 236-246. (in Chinese)
[2] Engelmann F. Insect vitellogenin: Identification, biosynthesis and role in vitellogenesis//Treherne J E, Berridge M J, Wigglesworth V B., 1979, 14: 49-108.
[3] 王加偉, 彭露, 鄒明民, 楊一帆, 汪蕾, 尤民生. 昆蟲卵黃原蛋白受體(s)及其主要功能綜述. 環(huán)境昆蟲學(xué)報(bào), 2016, 38(4): 831-842.
WANG J W, PENG L, ZOU M M, YANG Y F, WANG L, YOU M S. A review of insect vitellogenin receptors (s) and their fundamental functions., 2016, 38(4): 831-842. (in Chinese)
[4] TUFAIL M, TAKEDA M. Insect vitellogenin/lipophorin receptors: molecularstructures, role in oogenesis, and regulatory mechanisms., 2009, 55(2):87-103.
[5] 戴瀚洋, 孫洋, 柏立新, 趙靜, 肖留斌, 譚永安. 亞致死濃度甲維鹽脅迫對(duì)甜菜夜蛾幼蟲解毒酶系活力及其相關(guān)基因表達(dá)量的影響. 棉花學(xué)報(bào), 2015, 27(2): 149-158.
DAI H Y, SUN Y, BAI L X, ZHAO J, XIAO L B, TAN Y A. Activities of detoxification enzymes and expressions of related genes inlarvae treated with sublethal concentrations of emamectin benzoate., 2015, 27(2): 149-158. (in Chinese)
[6] 司升云, 周利琳, 王少麗, 江幸福, 許再福, 慕衛(wèi), 王冬升, 王小平, 陳浩濤, 楊亦樺, 吉訓(xùn)聰. 甜菜夜蛾防控技術(shù)研究與示范——公益性行業(yè)(農(nóng)業(yè))科研專項(xiàng)“甜菜夜蛾防控技術(shù)研究與示范” 研究進(jìn)展. 應(yīng)用昆蟲學(xué)報(bào), 2012, 49(6): 1432-1438.
SI S Y, ZHOU L L, WANG S L, JIANG X F, XU Z F, MU W, WANG D S, WANG X P, CHEN H T, YANG Y H, JI X C. Progress
in research on prevention and control of beet armyworm,in China., 2012, 49(6): 1432-1438. (in Chinese)
[7] 文禮章, 張友軍. 我國(guó)甜菜夜蛾大尺度暴發(fā)頻度與廣域溫度和廣域降雨量關(guān)系的預(yù)測(cè)模型. 昆蟲學(xué)報(bào), 2010, 53(12): 1367-1381.
WEN L Z, ZHANG Y J. Modelling of the relationship between the frequency of large-scale outbreak of the beet armyworm,(Lepidoptera: Noctuidae) and the wide-area temperature and rainfall trends in China., 2010, 53(12): 1367-1381. (in Chinese)
[8] LIN Y, MENG Y, WANG Y X, LUO J, KATSUMA S, YANG C W, BANNO Y, KUSAKABE T, SHIMADA T, XIA Q Y. Vitellogenin receptor mutation leads to the oogenesis mutant phenotype “” of the silkworm,., 2013, 288(19): 13345-13355.
[9] SHU Y H, WANG J W, LU K, ZHOU J L, ZHOU Q, ZHANG G R. The ?rstvitellogenin receptor from a Lepidopteran insect: molecular characterization,expression patterns and RNA interference analysis., 2011, 20(1): 61-73.
[10] CHO K H, Raikhel A S. Organization and developmental expression of the mosquito vitellogenin receptor gene., 2001, 10(5): 465-474.
[11] CHEN M E, LEWIS D K, KEELEY L L, PIETRANTONIO P V. cDNA cloning and transcriptional regulation of the vitellogenin receptor from the imported fire ant,buren (hymenoptera: formicidae)., 2004, 13(2): 195-204.
[12] GUIDUGLI-LAZZARINI K R, DO NASCIMENTO A M, TANAKA E D, PIULACHS M D, HARTFELDER K, BITONDI M G, SIMOES Z L. Expression analysis of putative vitellogenin and lipophorin receptors in honey bee (L.) queens and workers., 2008, 54(7): 1138-1147.
[13] LIU Q N, ZHU B J, LIU C L, WEI G Q, WANG Z G. Characterization of vitellogenin receptor () from the Chinese oak silkworm,, 2011, 64(2): 167-174.
[14] LIN W J, CHIEN C Y, TSAI C L, CHEN M E. A nonovary-specific vitellogenin receptor from the oriental fruit fly,(hendel).2015, 90(4): 169-180.
[15] TUFAIL M, TAKEDA M. Molecular cloning, characterization and regulation ofthe cockroach vitellogenin receptor during oogenesis., 2005,14(4): 389-401.
[16] ZHANG W N, MA L, XIAO H J, XIE B T, SMAGGHE G, GUO Y Y, Liang G M. Molecular characterization and function analysis of the vitellogenin receptor from the cotton bollworm,(Hübner) (Lepidoptera, Noctuidae)., 2016, 11(5): e0155785.
[17] ZHAO J, SUN Y, XIAO L B, TAN Y A, JIANG Y P, BAI L X. Vitellogenin and vitellogenin receptor gene expression profiles inare related to host plant suitability., 2018, 74(4): 950-958.
[18] ROY-ZOKAN E M, CUNNINGHAM C B, HEBB L E, MCKINNEY E C, MOORE A J. Vitellogenin and vitellogenin receptor gene expression is associated with male and female parenting in a subsocial insect., 2015, 282(1809): 20150787.
[19] TUFAIL M, TAKEDA M. Molecular cloning and developmental expressionpattern of the vitellogenin receptor from the cockroach,., 2007, 37(3): 235-245.
[20] 楊中俠, 文禮章, 吳青君, 王少麗, 徐寶云, 張友軍. RNAi技術(shù)在昆蟲功能基因研究中的應(yīng)用進(jìn)展. 昆蟲學(xué)報(bào), 2008, 51(10): 1077-1082.
YANG Z X, WEN L Z, WU Q J, WANG S L, XU B Y, ZHANG Y J. Application of RNA interference in studying gene functions in insects., 2008, 51(10): 1077-1082. (in Chinese)
[21] 周耀振, 修偉明, 董雙林. 應(yīng)用RNA干擾技術(shù)對(duì)甜菜夜蛾信息素結(jié)合蛋白功能的研究. 南京農(nóng)業(yè)大學(xué)學(xué)報(bào), 2009, 32(3): 58-62.
ZHOU Y Z, XIU W M, DONG S L. Functional study of pheromone binding protein by using RNAi in male beet armyworm,Hiibner., 2009, 32(3): 58-62. (in Chinese)
[22] TURNER C T, DAVY M W, MACDIARMID R M, PLUMMER K M, BIRCH N P, NEWCOMB R D. RNA interference in the light brown apple moth,(Walker) induced by double-stranded RNA feeding., 2006, 15(3): 383-391.
[23] CIUDAD L, PIULACHS M D, BELLES X. Systemic RNAi of the cockroach vitellogenin receptor results in a phenotype similar to that of theyolkless mutant., 2006, 273(2): 325-335.
[24] ARAUJO R N, SANTOS A, PINTO F S, GONTIJO N F, LEHANE M J, PEREIRA M H. RNA interference of the salivary gland nitrophorin 2 in the triatomine bug(Hemiptera: Reduviidae) by dsRNA ingestion or injection., 2006, 36(9): 683-693.
[25] BAUM J A, BOGAERT T, CLINTON W, HECK G R, FELDMANN P, ILAGAN O, JOHNSON S, PLAETINCK G, MUNYIKWA T, PLEAU M, VAUGHN T, ROBERTS J. Control of coleopteran insect pests through RNA interference., 2007, 25(11): 1322-1326.
[26] LU K, SHU Y H, ZHOU J L, ZHANG X Y, ZHANG X Y, CHEN M X, YAO Q, ZHOU Q, ZHANG W Q. Molecular characterization and RNA interference analysis of vitellogenin receptor from(st?l)., 2015, 73: 20-29.
[27] PITINO M, COLEMAN A D, MAFFEI M E, RIDOUT C J, HOGENHOUT S A. Silencing of aphid genes by dsRNA feeding from plants., 2011, 6(10): e25709.
[28] KENNERDELL J R, CARTHEW R W. Heritable gene silencing inusing double-stranded RNA., 2000, 18(8): 896-898.
[29] LEVIN D M, BREUER L N, ZHUANG S, ANDERSON S A, NARDI J B, KANOST M R. A hemocyte-specific integrin required for hemocytic encapsulation in the tobacco hornworm,., 2005, 35(5): 369-380.
[30] SIVAKUMAR S, RAJAGOPAL R, VENKATESH G R, SRIVASTAVA A, BHATNAGAR R K. Knockdown of aminopeptidase-N fromlarvae and in transfected Sf21 cells by RNA interference reveals its functional interaction withinsecticidal protein Cry1Ac., 2007, 282(10): 7312-7319.
[31] SHANG F, NIU J Z, DING B Y, ZHANG Q, YE C, ZHANG W, SMAGGHE G, WANG J J. Vitellogenin and its receptor play essential roles in the development and reproduction of the brown citrus aphid,(Toxoptera)., 2018, 27(2): 221-233.
RNA interference of Vitellogenin Receptorgene in beet armyworm()
ZHAO Jing1,2, Tao Rong1, HAO DeJun1, XIAO LiuBin2, TAN YongAn2
(1Co-Innovation Center for the Sustainable Forestry in Southern China/College of Forestry, Nanjing Forestry University, Nanjing 210037;2Institute of Plant Protection, Jiangsu Academy of Agricultural Sciences, Nanjing 210014)
【Objective】Vitellogenin receptor (VgR) is the main receptor that mediates the endocytosis of insect vitellin. The objective of this study is to clarify the function ofof beet armyworm () through RNA interference (RNAi) method, and to provide a basis for further understanding the molecular mechanism of reproductive physiology and developing effective new methods for prevention and control.【Method】The fragment ofwas amplified from the cDNA offemale adults abdomen tissues ofby PCR which included the ligand-binding domain region. The green fluorescent protein gene () fragment was amplified from theplasmid stored in the laboratory by specific primers. The fragment ofandwas then inserted into the pMD-19T for sequencing. The nucleic acid sequence was analyzed by DNAMAN software. The correct plasmid confirmed by sequencing acted as the DNA template. PCR amplification was performed using primers with T7 promoter.anddsRNA were synthesized with T7 RiboMAXTMExpress RNAi System synthesis kit. The abdomens offemale pupae on 2nd and 6th day were injected with 3 μL double RNA by 10 μL microsyringe (2 μg·μl-1). RT-qPCR was used to detect the changes ofexpression in 0-, 24-, 48-hour-old female adults. Meanwhile, eclosion rate and eggs per female were evaluated in control groups (blank control,-dsRNA injection) and treatment group (-dsRNA injection). 【Result】Theandgene fragments obtained by amplification were 327 and 417 bp, respectively. Theexpression level of 0-, 24-, 48-hour-old female adults in the-dsRNA group decreased by 79.35%, 84.22% and 67.68% compared with the-dsRNA group, respectively. Through anatomical observation of the ovary of 0-, 24-, 48-hour-old female adults, it was found that compared with the-dsRNA group, the ovary development of the-dsRNA group was significantly delayed. Compared with the-dsRNA group, the length of the ovary tube in the-dsRNA group decreased by 23.92% for the 24-hour-old female adults. The-dsRNA group has more mature eggs in the ovary with larger average diameter of (0.46±0.05) mm while the number of mature eggs in the-dsRNA group was small with an average diameter of (0.23±0.02) mm. There was no significant difference of eclosion rate between-dsRNA group and-dsRNA group. In the-dsRNA group, the average number of eggs per female was 170, while in the control groups (blank group,-dsRNA group), the average number of eggs per female was 451 and 420, respectively. There was a significant difference in the amount of ovipositionbetween control groups and treatment group. 【Conclusion】 The function ofwas studied by dsRNA injection, which could significantly reduce the expression of.plays an irreplaceable role in the reproduction of, which directly affects the ovary development and spawning capacity, and can be used as a potential target for controlling.
beet armyworm (); vitellogenin receptor gene (); RNA interference; ovary development
10.3864/j.issn.0578-1752.2019.01.006
2018-08-13;
2018-10-02
國(guó)家重點(diǎn)研發(fā)計(jì)劃(6111661)、國(guó)家現(xiàn)代農(nóng)業(yè)產(chǎn)業(yè)技術(shù)體系(CARS-18-16)、江蘇省農(nóng)業(yè)科學(xué)院院基金計(jì)劃(6111612、6111613)
趙靜,E-mail:jingzhao0126@126.com。通信作者郝德君,E-mail:dejunhao@163.com。通信作者肖留斌,E-mail:xlbwll@sohu.com
(責(zé)任編輯 岳梅)

