殼聚糖與大蒜素聯用抑菌與伽師瓜抗菌貯藏研究
張強,王丹,李冠*
1(新疆大學 生命科學與技術學院,新疆 烏魯木齊, 830046) 2(新疆農墾科學院農產品加工研究所,新疆 石河子, 832000)
甜瓜(CucumismeloL.),1年生的草本葫蘆科植物,伽師瓜是提昂的一個厚皮品種,因原產地為新疆伽師縣而得名。伽師瓜汁多肉脆、香甜可口,深受人們青睞。然而,伽師瓜容易染病腐爛,難以長期貯藏保鮮[1]。目前,使用化學藥物是控制甜瓜染病腐爛的主要方法,但藥物殘留存在食品安全隱患。因此,研究開發安全、高效的天然抗菌劑,對減少甜瓜貯藏過程中病害腐爛、延長保鮮期、減少化學藥劑使用量、提高食品安全都有重要意義。
殼聚糖與大蒜素均為天然產物,安全無毒。殼聚糖是甲殼質脫乙酰后的產品,有一定的抑菌活性[2],殼聚糖分子量從幾千至幾十萬,研究表明,黏均分子量在1.5×105左右的殼聚糖有較強的抑菌活性[3-4];殼聚糖還具有成膜特性[5],目前殼聚糖已應用于抑菌保鮮膜[6],曹雪慧等用殼聚糖涂膜對果蔬保鮮的研究表明,殼聚糖在發揮抑菌作用的同時,果蔬水分的散失亦得到減緩[7],殼聚糖與其他物質結合使用,保鮮效果更好,李慧妍將殼聚糖與1-甲基環丙烯復配,既有抑菌效果,還能減緩果蔬的呼吸作用[8],殼聚糖與ZnO混合能夠增加膜強度與抑菌活性[9],黃皮精油-殼聚糖復合涂膜番木瓜能顯著降低瓜病情指數,延緩果實腐爛[10]。大蒜素是廣譜抑菌劑,其抑菌活性很強[11],姜紹通等在冷卻肉表面涂抹大蒜素,抑菌效果顯著,冷卻肉的保鮮期可達19d以上[12];王梅等用大蒜素提取液對鮮切山藥進行保鮮,結果顯示大蒜素能夠殺菌防腐爛,并能抑制多酚氧化酶和過氧化物酶的酶活性,降低鮮切山藥的呼吸強度與褐變度,減少鮮切山藥的失重[13]。雖然大蒜素抗菌保鮮性能優良,但氣味不佳,多用于須烹煮后熟食的肉類或蔬菜。而瓜類多有較厚的皮,如西瓜,甜瓜,大蒜素難以對瓜內的食用部分的風味產生影響。目前,將殼聚糖與大蒜素聯合使用,聯合抑菌劑的活性與穩定性以及對甜瓜的抗菌保鮮作用尚不明確。因此,本文以殼聚糖、大蒜素為抑菌劑,對厚皮甜瓜品種伽師瓜貯藏過程中常見的4種致腐爛病原菌[14-15]:毛霉菌(Mucormucdo)、鐮飽菌(Fusariumspp.)、鏈格孢菌(Alternariaalternata)、青霉菌(Penicillumspp.)的抑菌活性進行了研究,并將2種抑菌劑聯合使用,研究聯合抑菌劑在伽師瓜貯藏過程的抗菌防腐爛作用,為甜瓜抗菌貯藏保鮮提供參考依據。
1 材料與方法
1.1 實驗材料
殼聚糖,脫乙酰度96%,黏均分子量為1.5×105,購于上海紫一試劑廠;大蒜素制品,大蒜素質量分數為30%,購于華牧康藥業;供試菌種:毛霉菌、鐮飽菌、鏈格孢菌、青霉菌,購于上海桑戈生物科技有限公司;伽師品種甜瓜,由新疆大學生物工程研究中心提供。
1.2 儀器與設備
ZHWY-200B型恒溫培養振蕩器,上海智城分析儀器制造有限公司;DHP-9162型恒溫培養箱,上海印溪儀器儀表有限公司;721G-100型分光光度計,上海圣科儀器設備有限公司;KK25F55TI型冰箱,三洋電器股份有限公司;LDZX-50KB型立式壓力蒸汽滅菌器,上海申安醫療器械廠。
1.3 方法
1.3.1 抑菌溶液制備
殼聚糖抑菌溶液制備:將分子量為1.5×105殼聚糖,用20 g/L醋酸溶液溶解達到飽和后,用無菌蒸餾水稀釋至15 g/L,再用0.1 mol/L NaOH將溶液pH值調節至6.0[16];
大蒜素抑菌溶液制備:參照2013年版美國國家臨床實驗室標準委員會(clinical and laboratory standards institute, CLSI)標準,以無菌蒸餾水為溶劑配制大蒜素的終濃度為1.435 μg/mL[17-18]。
1.3.2 菌株培養及菌懸液的制備
將菌株接種于(luria-bertani, LB)固體培養基,在37 ℃培養12~36 h,挑選單一菌落接種于LB液體培養基,于28 ℃、180 r/min培養至菌液OD值達到0.6。菌懸液的制備:將所培養的菌調至0.5麥氏比濁單位[19]。
1.3.3 抑菌活性的測定
最小抑菌濃度(minimal inhibitory concentration, MIC)的測定:將待測菌液用微量二倍稀釋法依次稀釋抑菌劑溶液,再依次加入待測菌液,以無菌蒸餾水做陰性對照,重復3次,將平板置于37 ℃培養箱內培養24 h,觀察結果[20]。
抑菌圈直徑的測定:采用濾紙片擴散法,用十字交叉法測定抑菌圈直徑[20]。
抑菌率的測定:比濁度法[21],抑菌率計算公式如下:
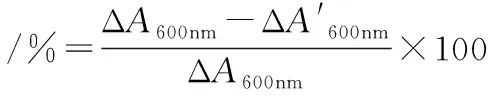
(1)
式中:A600mm,600 nm波長處吸光度,ΔA600nm,單位時間內A600nm變化。
殼聚糖、大蒜素聯合抑菌劑的配制及抑菌活性測定:抑菌劑同時對4種病原菌都有抑菌作用,應取4種病原菌中MIC值中最大者。殼聚糖組與大蒜素組對應的最大MIC值分別記為C1和C2。分別以C1和C2為2種抑菌物質終濃度配制聯和抑菌劑溶液,測定聯合抑菌劑的抑菌活性[22-23]。
1.3.4 聯合抑菌劑的抑菌穩定性測定[24]
對聯合抑菌劑分別做以下處理:
溫度處理,分別用40、50、60、70、80、90 ℃水浴處理聯合抑菌劑30 min,以20 ℃下抑菌活性作為對照;
pH值處理,將聯合抑菌劑溶液分別調至pH值為3、4、5、6、7、8、9、10;
紫外光照射處理,將聯合抑菌劑置于20 W的紫外燈下30 cm處分別照射20、40、60、80 min;
對抑菌劑做以上處理后,分別測定抑菌劑的抑菌圈直徑與抑菌率,重復3次,取平均值。
1.3.5 在伽師瓜貯藏過程中聯合抑菌劑抗菌防腐爛作用的測定[25]
聯合抑菌劑對4種病原菌的抗菌防腐爛作用測定:取成熟度一致的伽師瓜樣本,用60 ℃無菌水燙漂2 min,并紫外光照射10 min,再向瓜表面接入所選4種病原菌。處理組,在接入病原菌的樣本表面噴涂聯合抑菌劑,對照組樣本不做抑菌處理,貯藏溫度20 ℃,每10 d統計1次腐爛率。處理組與對照組各3個重復,每個重復10個瓜。
聯合抑菌劑對樣本自帶與貯藏環境病原菌的抗菌防腐爛作用測定:取成熟度一致的伽師瓜,在處理組中,向瓜面均勻噴涂聯合抑菌劑,對照組樣本不做抗菌處理,貯藏溫度20 ℃,每10 d統計1次腐爛率。處理組與對照組各3個重復,每個重復10個瓜。
腐爛率計算公式[26]:

(2)
1.4 數據處理
實驗數據采用Excel統計和繪圖,用SPSS 17.0軟件系統進行方差分析,以p<0.05作為差異顯著的標準。
2 結果與分析
2.1 殼聚糖、大蒜素的MIC以及抑菌活性的測定
如表1所示,殼聚糖與大蒜素對毛霉菌、鐮飽菌、鏈格孢菌、青霉菌均有抑菌活性,對這4種病原菌:殼聚糖的MIC分別為3.7、3.1、4.2、5.5 g/L,與MIC對應的抑菌圈直徑分別4.5、5.3、3.5、3.9 mm,抑菌率分別為34.3%、39.5%、29.3%、32.8%;大蒜素的MIC分別為2.3、1.7、2.2、2.6 g/L,與MIC對應的抑菌圈直徑分別12.7、15.5、14.3、14.6 mm,抑菌率分別為59.6%、63.7%、71.3%、67.6%;殼聚糖的MIC均高于大蒜素,而對應的抑菌圈直徑與抑菌率則小于大蒜素(p<0.05),由此可知,大蒜素對4種病原菌的抑菌活性均強于殼聚糖。
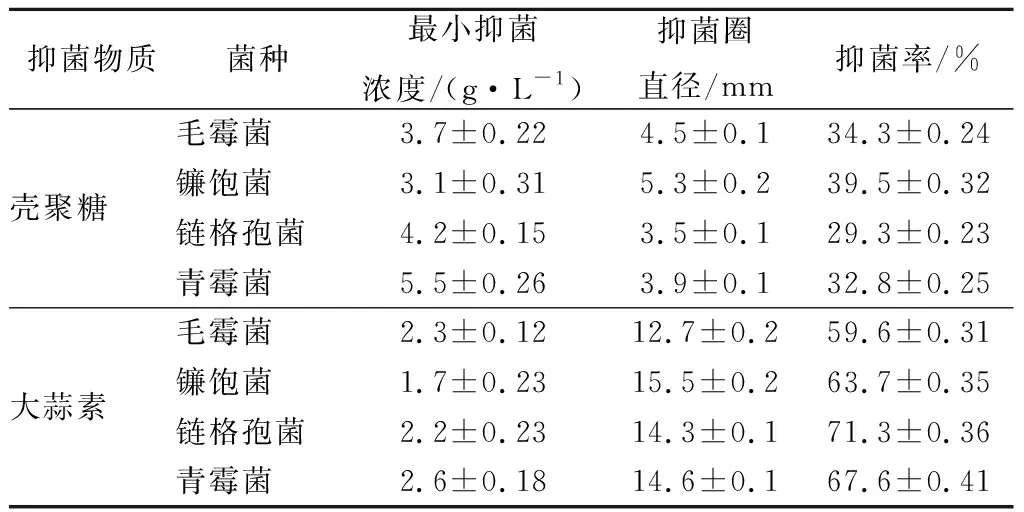
表1 殼聚糖、大蒜素的MIC、抑菌圈直徑和抑菌率Table 1 The MIC and inhibitory zone diameters and inhibitory rate of chitosan and allicin
2.2 殼聚糖、大蒜素與聯合抑菌劑的抑菌活性
由2.1結果所示,在4種病原菌中,殼聚糖對青霉菌的MIC最大,以此濃度作為殼聚糖的質量濃度(ρ1),為5.5 g/L,同理,大蒜素對應的質量濃度(ρ2)為2.6 g/L。
2.2.1 殼聚糖、大蒜素及聯合抑菌劑的抑菌圈直徑
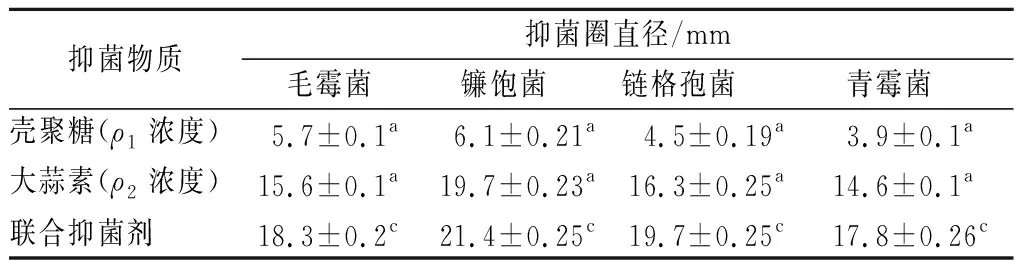
表2 ρ1濃度下殼聚糖、 ρ2濃度下大蒜素及聯合 抑菌劑的抑菌圈直徑Table 2 The inhibitory zone diameters of chitosan in ρ1 and allicin in ρ2 and the combined antibacterial agents
注:不同小寫字母表示LSD檢驗在5%水平上差異顯著;表3同。
2.2.2 殼聚糖、大蒜素及聯合抑菌劑的抑菌率
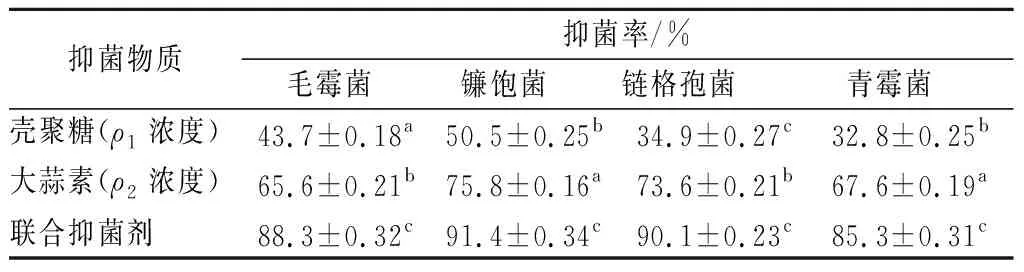
表3 ρ1濃度下殼聚糖、 ρ2濃度下大蒜素及聯合 抑菌劑的抑菌率Table 3 The inhibitory rate of chitosan in ρ1 and allicin in ρ2 and the combined antibacterial agents
以ρ1濃度殼聚糖與ρ2濃度的大蒜素配制成聯合抑菌劑,由表2與表3數據可知,殼聚糖與大蒜素聯用后對4種病原菌的抑菌圈直徑與抑菌率均有所增加,抑菌活性有所提高(p<0.05)。
2.3 聯合抑菌劑的穩定性
2.3.1 溫度對聯合抑菌劑抑菌活性的影響
由圖1、圖2可知,聯合抑菌劑的抑菌活性在40 ℃下保持良好,經50 ℃處理有小幅下降,60 ℃處理后抑菌活性有顯著下降(p<0.05),在70 ~90 ℃處理后,抑菌活性下降嚴重(p<0.05)。
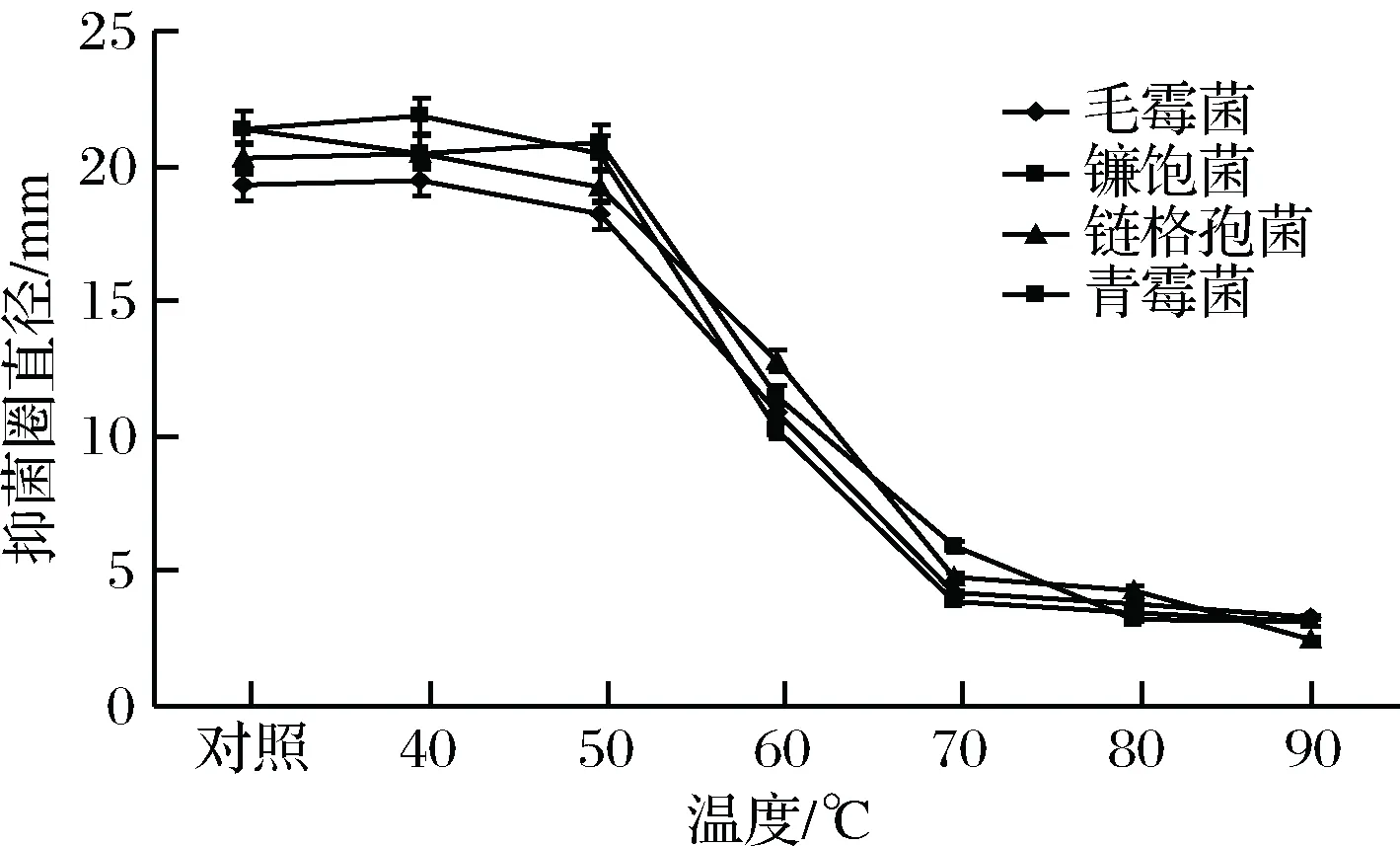
圖1 溫度對聯合抑菌劑抑菌圈直徑的影響Fig.1 The effect of temperature on the inhibitory zone diameters of combined antibacterial agents

圖2 溫度對聯合抑菌劑抑菌率的影響Fig.2 The effect of temperature on the inhibitory rate of combined antibacterial agents
2.3.2 pH對聯用抑菌劑抑菌穩定性的影響
由圖3和圖4分析可知,聯合抑菌劑在pH值在5~8之間抑菌活性較高,因此,聯合抑菌劑適于在中性pH值條件下發揮抑菌活性。
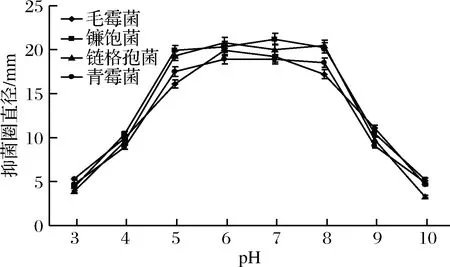
圖3 pH值對聯合抑菌劑抑菌圈直徑的影響Fig.3 The effect of pH on the inhibitory zone diameters of combined antibacterial agents
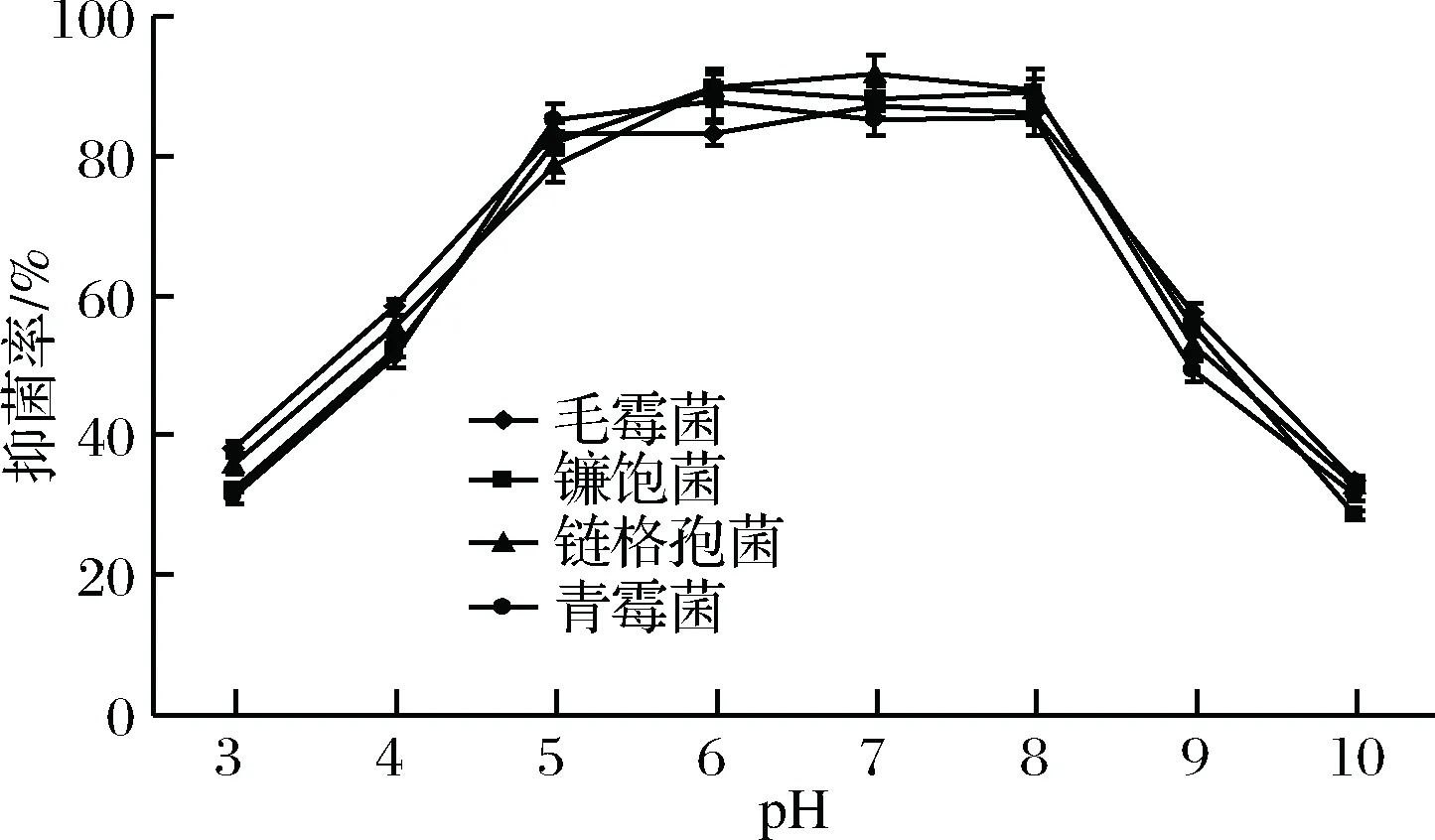
圖4 pH值對聯合抑菌劑抑菌率的影響Fig.4 The effect of pH on the inhibitory rate of combined antibacterial agents
2.3.3 紫外照射對聯用抑菌劑抑菌活性的影響
由圖5和圖6可知,隨著照射時間的延長,聯合抑菌劑的抑菌活性不斷下降。受紫外線照射20 min內,抑菌活性只有小幅下降。
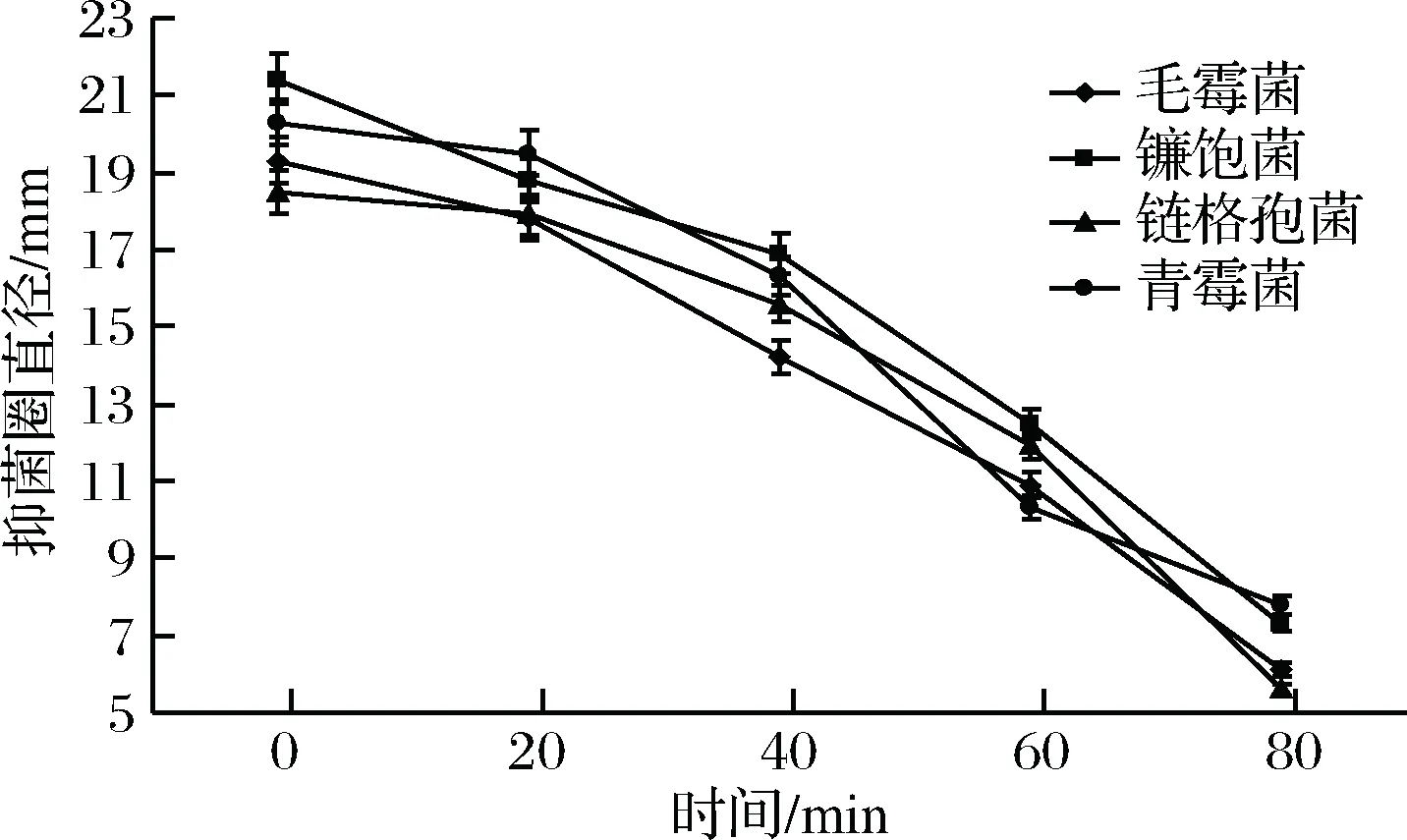
圖5 紫外線照射時間對聯合抑菌劑抑菌圈直徑的影響Fig.5 The effect of ultraviolet light irradiation time on the inhibitory zone diameters of combined antibacterial agents
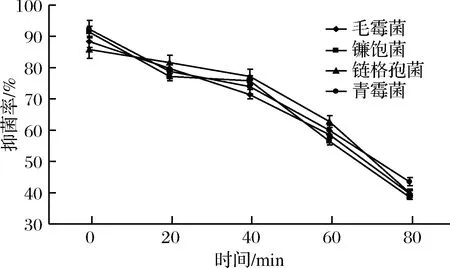
圖6 紫外線照射時間對聯合抑菌劑抑菌率的影響Fig.6 The effect of ultraviolet light irradiation time on the inhibitory rate of combined antibacterial agents
2.4 聯合抑菌劑在伽師瓜貯藏過程中抗菌防腐爛作用
2.4.1 在伽師瓜貯藏過程中聯合抑菌劑對4種病原菌的抗菌防腐爛作用
由圖7可知,在50 d時,對照組腐爛率為98.5%,處理組腐爛率僅為14.3%。處理組在貯藏120 d時,腐爛率達到97.9%,對照組腐爛速度顯著高于處理組(p<0.05)。
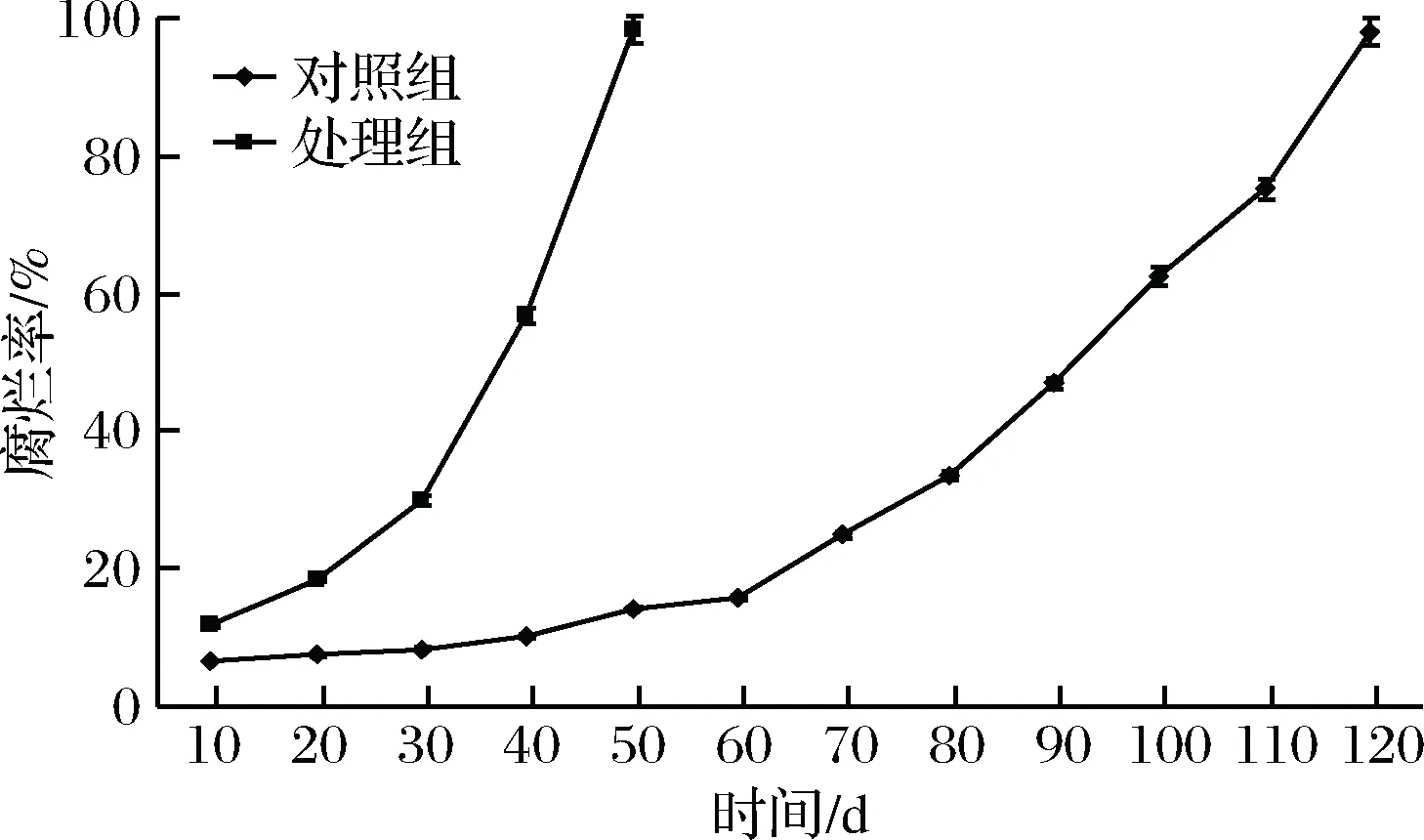
圖7 伽師瓜貯藏過程中聯合抑菌劑對4種病原菌的 抗菌作用Fig.7 Antibacterial effect of combined antibacterial agents on four pathogenic bacteria in the storage of Jiashi melon
2.4.2 聯合抑菌劑對樣本自帶與貯藏環境的病原菌的抗菌防腐爛作用
由圖8可知,在20 ℃下,對照組中伽師瓜未采取抗菌措施,腐爛速度較快,70 d時全部腐爛,處理組70 d時腐爛率僅為25.1%,120 d時,全部腐爛,兩者差異顯著(p<0.05)。
在相同的貯藏時間,圖7比圖8中對照組腐爛率高,這是由于圖7中的所有樣本都專門致腐敗較強的病原菌,所以,腐爛率較高;而圖8中的樣本并非全部都帶有致腐敗病菌,且致腐敗能力不確定,因而腐爛率較低。
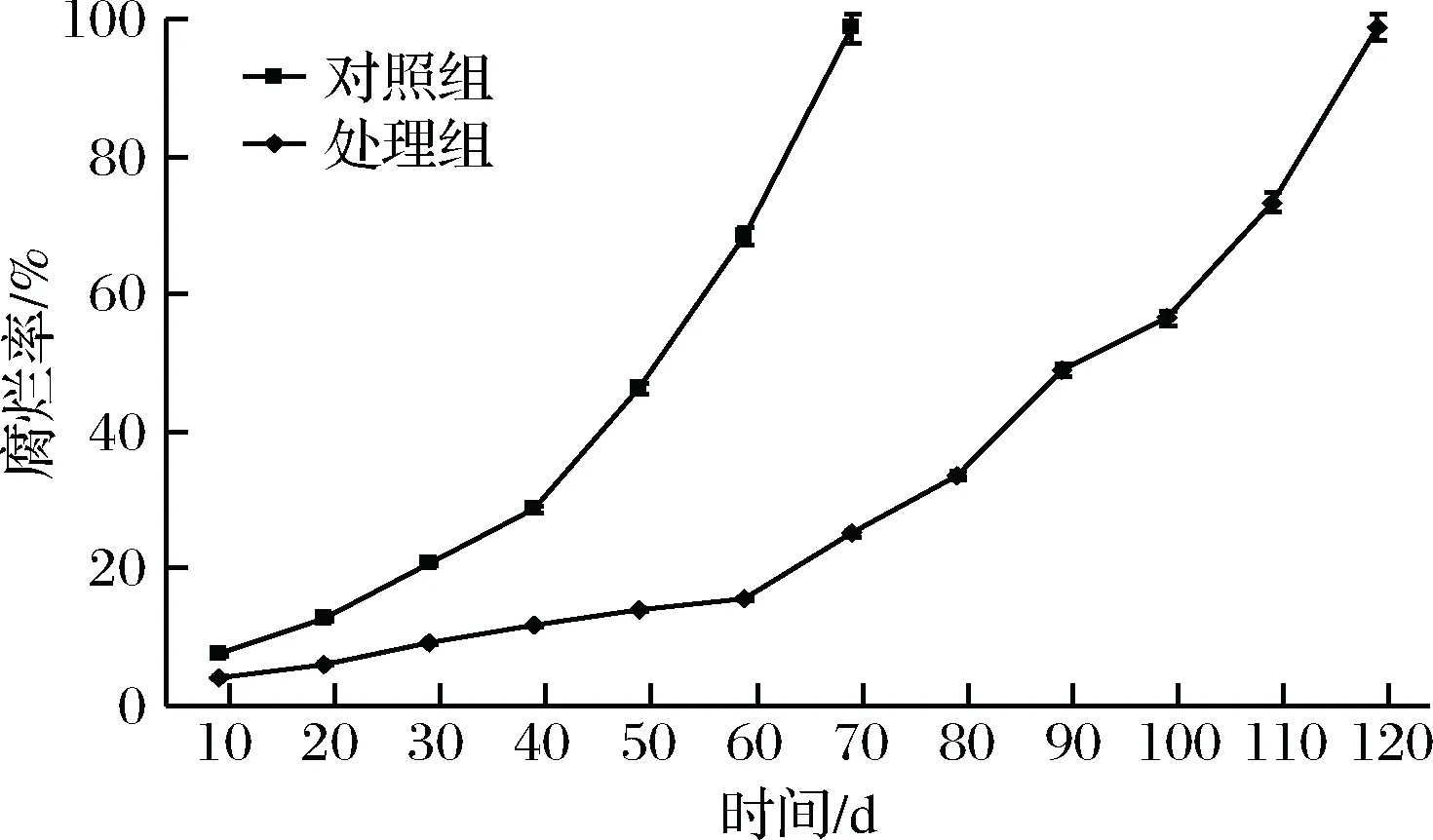
圖8 聯合抑菌劑對樣本自身與貯藏環境病原菌的 抗菌作用Fig.8 Antimicrobial effect of combined antibacterial agents on pathogenic bacteria which in samples of Jiashi melon and in the storage environment
3 討論

抑菌劑的穩定性是重要的性能指標,殼聚糖熱穩定性較好[31],高溫處理后仍能保持抑菌活性。大蒜素抑菌活性強,但熱穩定性差,高溫下抑菌活性大幅下降甚至消失[32]。高溫下,大蒜素抑菌活性急劇下降,對聯合抑菌劑整體的抑菌活性影響較大,殼聚糖仍能保持穩定的抑菌活性。因此,如圖1與圖2所示,聯合抑菌劑的抑菌活性在50~70 ℃之間快速下降,在70~90 ℃之間則下降緩慢。此外,聯合抑菌劑在pH值5~8之間、紫外光照射20 min后,能保持較強的抑菌活性,抑菌穩定性良好。
微生物侵染是導致甜瓜腐爛的主要原因[15],微生物生長繁殖分為遲緩期、對數增長期、平穩期,在經歷遲緩期,達到一定數量密度后進入快速增長的對數期[33],聯合抑菌劑大量殺滅樣本表面病原菌,推遲病原菌進入對數增長期。在針對4種病原菌的抗菌貯藏過程中,如圖7所示,對照組腐爛率上升速度較處理組快。在實際貯藏保鮮過程中,微生物復雜繁多,難以做到全部分離分析,且產地、貯藏環境等因素都會增加病原菌種類的不確定性。對伽師瓜普通樣本的抗菌貯藏,結果如圖8所示,20 ℃下貯藏70 d后處理組腐爛率僅為25.1%,對照組則全部腐爛。由此可知,聯合抑菌劑具有廣譜抑菌活性。由于聯合抑菌劑組分中殼聚糖有成膜特性,能形成一層抑菌保護膜,阻止后續病原菌的侵入,進一步降低了腐爛率,延長了保鮮期[34]。因此,圖7與圖8的處理組樣本的保鮮期均達到120 d,差異不顯著。
4 結論
殼聚糖、大蒜素對伽師瓜貯藏過程中常見的致腐敗病原菌均有抑菌作用,2種抑菌劑聯用有更強的抑菌活性,同時,聯合抑菌劑有良好的抑菌穩定性。在伽師瓜貯藏過程中使用聯合抑菌劑,能夠顯著的降低果實腐爛率,并延長保鮮期。因此,殼聚糖-大蒜素聯合抑菌劑適用于伽師瓜抗菌貯藏保鮮,對其他種類瓜果蔬菜的抗菌貯藏保鮮也有參考意義。

