LC-MS/MS法同時測定人血漿中萬古霉素和去甲萬古霉素的質量濃度
張 雷,姚鴻萍,程曉亮
(西安交通大學第一附屬醫院藥學部,西安 710061)
萬古霉素和去甲萬古霉素為糖肽類抗菌藥物,用于預防和治療多種革蘭氏陽性菌感染,包括耐甲氧西林金黃色葡萄球菌(MRSA)[1]。二者在結構上除了在去甲萬古霉素的N末端缺少1個甲基以外幾乎相同,化學結構見圖1。萬古霉素與去甲萬古霉素的抗菌譜和活性相似,治療窗均較窄,萬古霉素和去甲萬古霉素的谷質量濃度治療窗分別為10~20[2-3]和5~10 μg·mL-1[4]。谷質量濃度低于治療窗時治療效果不佳,谷質量濃度高于治療窗時出現腎毒性和耳毒性的風險增加[2-3]。因此,需要進行治療藥物監測以確保藥物療效并防止毒性和不良反應發生[2]。
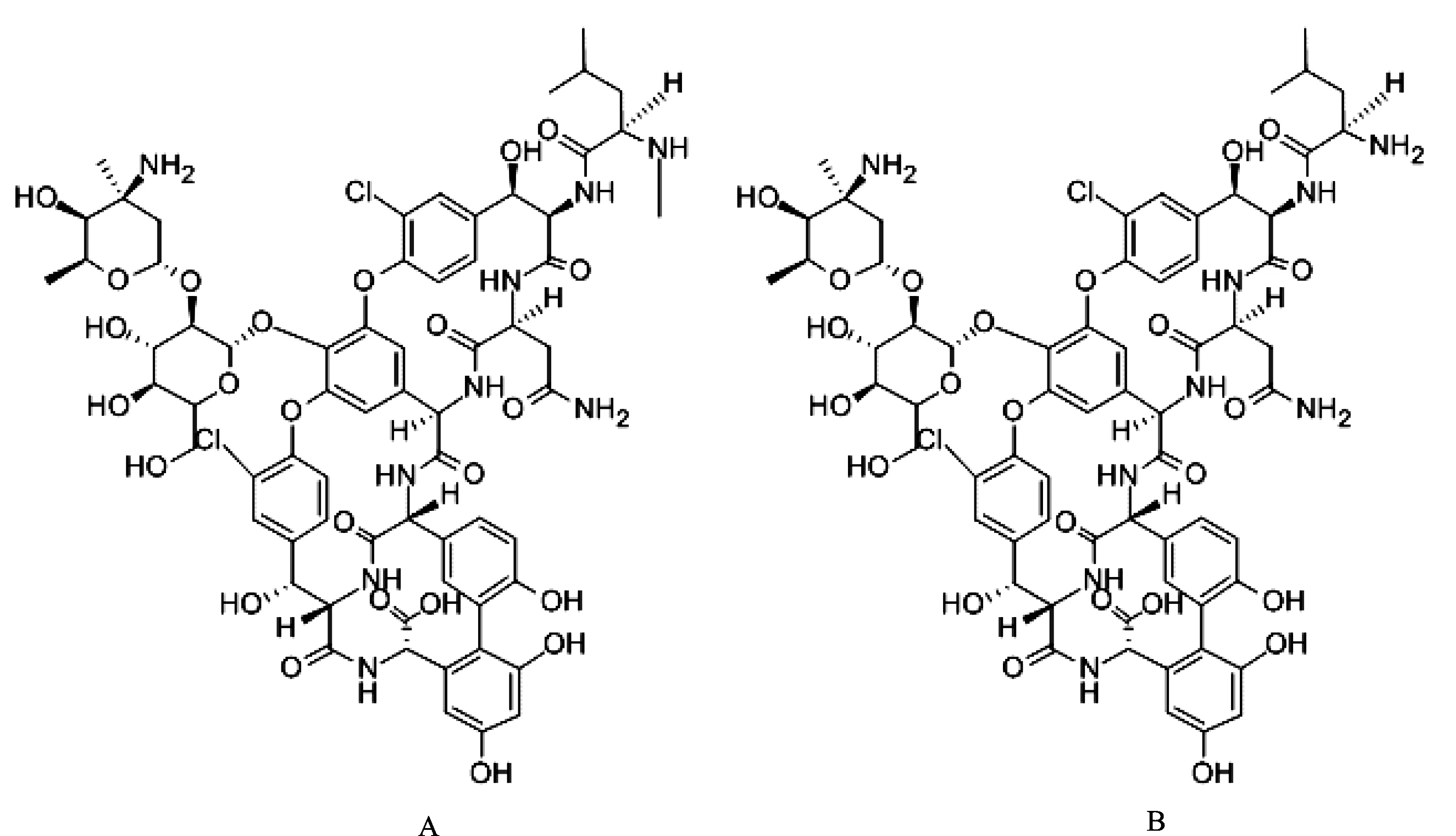
圖1萬古霉素(A)和去甲萬古霉素(B)的化學結構式
Fig.1 Chemical structure of vancomycin (A) and norvancomycin (B)
文獻報道的萬古霉素藥物質量濃度的分析方法有多種,包括免疫分析法[5]、HPLC法[6]和液相色譜-質譜聯用法(LC-MS/MS)[7-12]。盡管免疫分析法的速度快、操作方便,但該方法的特異性和靈敏度不高,需要特定的設備[13]。HPLC法的紫外或熒光檢測器對分析物的結構選擇性不高,且需要將分析物與內源性物質完全分離,因此分析時間較長[14]。LC-MS/MS法是一種靈敏度高、結構選擇性強的分析方法。目前文獻報道的LC-MS/MS法測定萬古霉素質量濃度包括在線樣品萃取和柱切換技術[8]、三氟乙酸和甲醇[9]、三氯乙酸[10]或乙腈[11-12]沉淀蛋白。這些方法采用離子對色譜或正相色譜,萃取過程較復雜,在線樣品萃取費用較高。只有少數文獻報道測定去甲萬古霉素質量濃度的方法,包括熒光偏振免疫[15]、HPLC法[16]和LC-MS/MS法[17],但這些方法靈敏度較低。
本研究的目的是建立一種簡單的反相色譜測定血漿中萬古霉素和去甲萬古霉素的LC-MS/MS法,結果表明,該方法靈敏度高、準確和可靠,可用于血藥質量濃度的監測。
1 材料與方法
1.1儀器與試藥
1.1.1儀器 Thermo TSQ Endura型三重四極桿質譜儀(配有可加熱電噴霧離子源),戴安Ultimate 3000型高效液相色譜儀(配有HGP-3200RS型雙梯度泵、SRD-3200型真空脫氣機和自動進樣器)(美國Thermo公司);Basic型電子天平(德國賽多利斯公司);AllegraTM×-22R高速冷凍離心機(美國Beckman Coulter公司);Elix@3純水儀(美國Millipore公司)。
1.1.2試藥 萬古霉素(批準文號H20140174)和去甲萬古霉素(批準文號H13020286)均購自北京百靈威科技有限公司;甲醇和甲酸均為色譜純,購自德國默克公司;水為實驗室自制超純水。
1.2方法
1.2.1色譜條件 色譜柱:Thermo Scientific Hypersil GOLD aQ (100 mm×2.1 mm,1.9 μm);流動相:1 mL·L-1甲酸水溶液(A)-甲醇(B);流速:0.3 mL·min-1。梯度洗脫程序:0~1.5 min,90%A;1.5~3 min,90%~40%A,并保持4 min;7~7.5 min,40%~90%A,保持0.5 min。分析時間:8 min;進樣量:20 μL。
1.2.2質譜條件離子源 離子源:可加熱電噴霧(HESI)離子源;檢測方法:正離子模式檢測;電噴霧電壓:3 500 V,離子源蒸發溫度:400 ℃;離子傳輸管溫度:300 ℃。掃描方法為選擇反應監測(SRM),萬古霉素、去甲萬古霉素和內標的檢測離子對分別為m/z725.7→144.2,m/z718.3→144.2和m/z338.3→296.0,套管透鏡補償電壓分別為164,164和167 V,碰撞能量分別為33,33和17 V。碰撞氣氬氣的壓力為1.5 mTorr,鞘氣(N2)和輔助氣(N2)壓力分別為35和8 Arb。萬古霉素、去甲萬古霉素和利奈唑胺的駐留時間均為200 ms。
1.3儲備液、對照品溶液和對照血漿樣品的制備 精密稱取萬古霉素和去甲萬古霉素對照品各10 mg,置于10 mL量瓶中,加純水溶解并稀釋至刻度,分別配制成質量濃度為 1 mg·mL-1的對照品儲備液。精密吸取上述萬古霉素和去甲萬古霉素儲備液,分別用純水稀釋成質量濃度為0.2,0.4,1,5,10,100和200 μg·mL-1的系列對照品溶液,置于4 ℃冰箱中保存,備用。
取180 μL空白血漿,分別加入10 μL不同質量濃度的萬古霉素和去甲萬古霉素對照品溶液,制備萬古霉素和去甲萬古霉素終質量濃度為0.01,0.02,0.05,0.25,0.5,2.5,5和10 μg·mL-1的對照血漿樣品。空白血漿中加入不同質量濃度的對照品溶液,制備萬古霉素和去甲萬古霉素終質量濃度為0.02,0.25和8 μg·mL-1的質控樣品。
1.4血漿樣品的前處理 取200 μL空白血漿,置于EP管中,加入10 μL質量濃度為500 ng·mL-1的利奈唑胺內標溶液,再加入40 μL高氯酸沉淀蛋白,渦旋30 s。加入400 μL的純化水,渦旋30 s,以提高萬古霉素和去甲萬古霉素的回收率,以11 750 r·min-1離心15 min后加入50 μL二氯甲烷,渦旋30 s。取20 μL上清液進樣分析。
1.5方法學驗證
1.5.1專屬性 通過對比空白血漿、分別加入萬古霉素和去甲萬古霉素對照品溶液或內標溶液的空白血漿以及給藥后患者的血漿樣品色譜圖,考察該方法的專屬性。
1.5.2標準曲線的制作 取空白血漿180 μL,分別加入10 μL萬古霉素和去甲萬古霉素系列質量濃度的對照品溶液和利奈唑胺內標溶液,血漿中萬古霉素和去甲萬古霉素的理論質量濃度為0.01,0.02,0.05,0.25,0.5,2.5,5和10 μg·mL-1。按照1.4項下方法處理后進樣分析,分別以萬古霉素和去甲萬古霉素的峰面積與內標利奈唑胺峰面積的比值對其質量濃度作圖,用加權最小二乘法進行線性回歸計算,得加權標準曲線。
1.5.3定量下限和最低檢測限 取空白血漿180 μL,加入10 μL萬古霉素和去甲萬古霉素對照品溶液,進行樣品處理后進樣分析,當信噪比(S/N)為10時的檢測質量濃度為本方法的定量下限(LLOQ),當信噪比(S/N)為3時的檢測質量濃度為本方法的最低檢測限(LLOD)。
1.5.4精密度與準確度 平行制備高、中、低質控樣品各5份,1 d內進樣分析,計算日內精密度RSD值和準確度(以相對誤差表示);連續5 d進樣分析,計算日間精密度和準確度。要求日間和日內精密度RSD值小于15%,日間和日內的相對誤差在±15%之內。
1.5.5提取回收率與基質效應 取180 μL空白血漿,分別加入10 μL萬古霉素、去甲萬古霉素質控溶液和利奈唑胺溶液,按照1.4項下方法處理后進樣分析,得峰面積A。取空白血漿,按照1.4項下方法處理,取620 μL上清液,分別加入10 μL萬古霉素、去甲萬古霉素質控溶液和利奈唑胺溶液,進樣分析得峰面積B。取620 μL水,分別加入10 μL萬古霉素和去甲萬古霉素質控溶液和利奈唑胺溶液,進樣分析得峰面積C。A/B為本方法的提取回收率,B/C為本方法的基質效應。
1.5.6穩定性 將質量濃度為0.02,0.25和8 μg·mL-1萬古霉素和去甲萬古霉素的血漿樣品反復凍融3次,室溫下保存24 h(短期穩定性)和-80 ℃保存1個月(長期穩定性)后進行分析,考察萬古霉素和去甲萬古霉素的穩定性。
1.5.7稀釋效應 用空白血漿將質量濃度為50 μg·mL-1的萬古霉素和去甲萬古霉素血漿樣品稀釋10倍,經1.4項下方法處理后進樣分析,考察稀釋對質量濃度測定的影響。
1.6治療藥物監測應用 將LC-MS/MS法應用于萬古霉素和去甲萬古霉素治療藥物的監測。萬古霉素和去甲萬古霉素血藥質量濃度達到穩態后,在下一次給藥前采集谷質量濃度血樣,離心后收集血漿樣品進行分析。實驗方案經西安交通大學第一附屬醫院醫學倫理委員會批準,所有患者均簽署知情同意書。
2 結果
2.1LC-MS/MS法的建立 本研究的目的是建立一種測定人血漿中萬古霉素和去甲萬古霉素質量濃度的LC-MS/MS法,并應用于治療藥物監測。萬古霉素和去甲萬古霉素母離子和子離子全掃描譜圖見圖2。m/z1 450.7和m/z1 436.4的萬古霉素和去甲萬古霉素的[M+H]+峰觀測不到,但分子離子峰分別出現在m/z725.7和m/z718.3。說明萬古霉素和去甲萬古霉素帶雙電荷,這是因為萬古霉素和去甲萬古霉素具有多個可離子化的堿性基團。根據萬古霉素和去甲萬古霉素的子離子譜圖,選擇萬古霉素和去甲萬古霉素的子離子m/z144.2作為定量離子。因此,萬古霉素和去甲萬古霉素的選擇反應監測離子對分別為m/z725.7→144.2和m/z718.3→144.2。
萬古霉素和去甲萬古霉素的親水性強,文獻報道采用離子對色譜[11]和正相色譜[12]分離萬古霉素和內源性物質。本研究采用梯度洗脫,用反相色譜柱分離萬古霉素、去甲萬古霉素和內源性物質。開始時,低甲醇相(10%)保持1.5 min,甲醇相在1.5 min內逐漸增加至60%,并保持4 min,高比例的有機相有利于分析物的電離。見圖3。由圖3可知,萬古霉素、去甲萬古霉素和利奈唑胺的保留時間分別為3.67,3.71和4.62 min,說明分析物達到了較好的色譜分離。
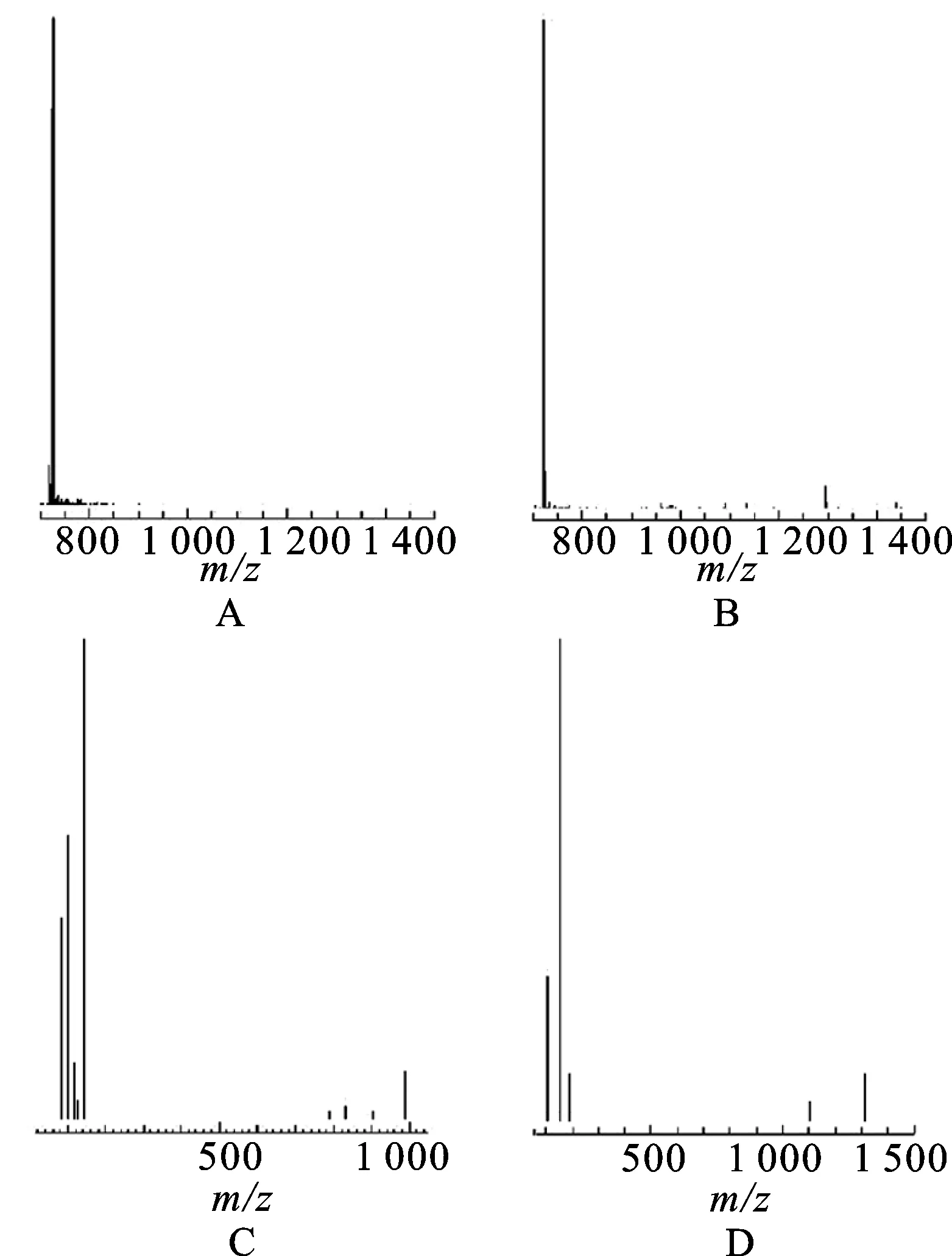
圖2萬古霉素和去甲萬古霉素母離子和子離子全掃描譜圖
A.萬古霉素母離子;B.去甲萬古霉素母離子;C.萬古霉素子離子;D.去甲萬古霉素子離子。
Fig.2 Full scan mass spectra for the parent and product of vancomycin and norvancomycin
A.parent ion for vancmycin;B.parent ion for norvancmycin;C.product ion for vancmycin;D.product ion for norvancmycin.
蛋白沉淀或有機試劑萃取通常用于提取分析物,但由于萬古霉素和去甲萬古霉素難溶于有機試劑,因此不能采用有機試劑萃取,用甲醇或乙腈沉淀蛋白導致萬古霉素和去甲萬古霉素的靈敏度降低。實驗選擇高氯酸沉淀蛋白,以增加分析物的靈敏度,高氯酸沉淀蛋白后萬古霉素和去甲萬古霉素的回收率約為50%。為了提高回收率,蛋白沉淀后加入不同體積的水,回收率隨水體積的增加而增大。但水稀釋了樣品,降低了靈敏度,因此選擇加入2倍體積的水,萬古霉素和去甲萬古霉素的回收率大于70%。
生物樣品中內源性物質引起的基質效應是LC-MS/MS分析中的一個難點,血漿中極為豐富的磷脂是基質效應的主要來源[17-18]。二氯甲烷是提取脂類的良好溶劑[17],用于減少基質效應。蛋白質沉淀后,用二氯甲烷萃取上清液以降低基質效應,結果顯示二氯甲烷萃取后無明顯的基質效應。
2.2方法學驗證
2.2.1專屬性 在空白血漿中分別加入萬古霉素、去甲萬古霉素或內標溶液(萬古霉素和去甲萬古霉素終質量濃度為5 μg·mL-1)其與用藥后患者血漿的色譜圖見圖3。萬古霉素、去甲萬古霉素和利奈唑胺的保留時間分別為3.67,3.71和4.62 min,血漿中內源性物質對萬古霉素和去甲萬古霉素的檢測無干擾。
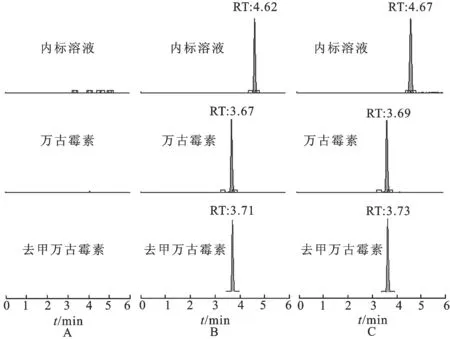
圖3萬古霉素和去甲萬古霉素的典型色譜圖
A.空白血漿;B.空白血漿中分別加入萬古霉素、去甲萬古霉素和內標溶液(萬古霉素和去甲萬古霉素的終質量濃度為5 μg·mL-1);C.患者使用萬古霉素或去甲萬古霉素后的血漿。
Fig.3 Typical chromatograms of vancomycin and norvancomycin
A.blank plasma;B.blank plasma spiked with vancomycin,norvancomycin or internal standard (final concentration of vancomycin and norvancomycin was 5 μg·mL-1);C.trough blood samples collected from patients received vancomycin or norvancomycin therapy.
2.2.2標準曲線 分別以血漿中萬古霉素或去甲萬古霉素的質量濃度為自變量(x),對其峰面積與利奈唑胺峰面積的比值(y)作圖,以1/C2為權重,進行最小二乘法線性回歸,得血漿樣品中萬古霉素和去甲萬古霉素的標準曲線。連續3 d制備標準曲線,結果見表1。結果表明,萬古霉素和去甲萬古霉素質量濃度在0.01~10 μg·mL-1范圍內線性關系良好,定量下限的實際質量濃度和理論質量濃度的誤差在±20%以內,其他質量濃度的誤差在±15%以內。
表1萬古霉素和去甲萬古霉素3條標準曲線
Tab.1 Calibration curves of vancomycin and norvancomycin in 3 runs
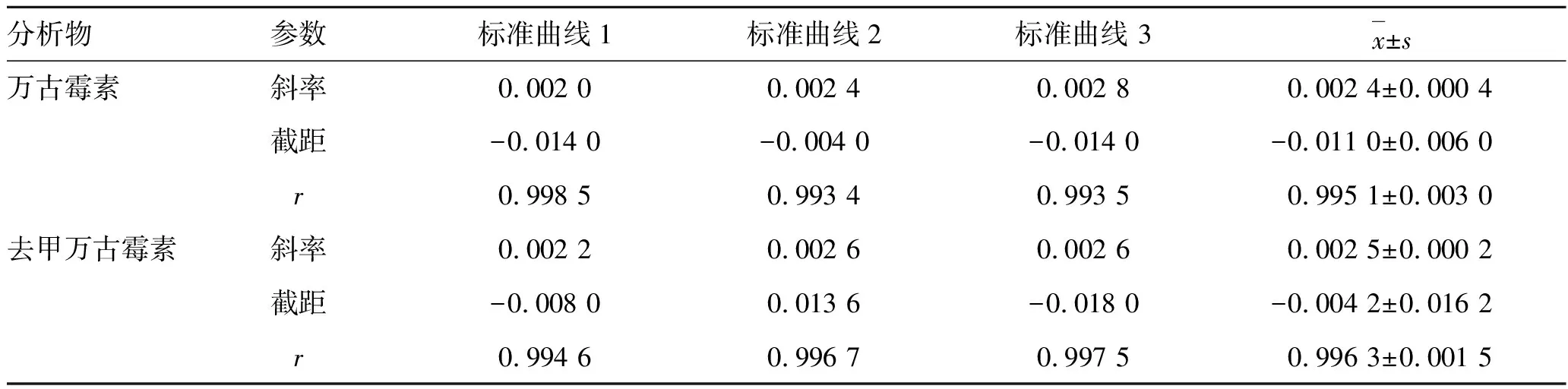
分析物參數標準曲線1標準曲線2標準曲線 3x±s萬古霉素斜率0.002 00.002 40.002 80.002 4±0.000 4 截距-0.014 0-0.004 0-0.014 0-0.011 0±0.006 0 r0.998 50.993 40.993 50.995 1±0.003 0 去甲萬古霉素斜率0.002 20.002 60.002 60.002 5±0.000 2 截距-0.008 00.013 6-0.018 0-0.004 2±0.016 2 r0.994 60.996 70.997 50.996 3±0.001 5
2.2.3最低檢測限和定量下限 萬古霉素和去甲萬古霉素的最低檢測限和定量下限分別為3和10 g·mL-1。
2.2.4精密度和準確度 萬古霉素和去甲萬古霉素質控樣品的日內和日間精密度RSD值均小于15%,準確度誤差在±15%之內,符合體內生物樣品分析的要求。結果見表2和表3。
表2萬古霉素和去甲萬古霉素日內精密度和準確度
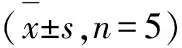
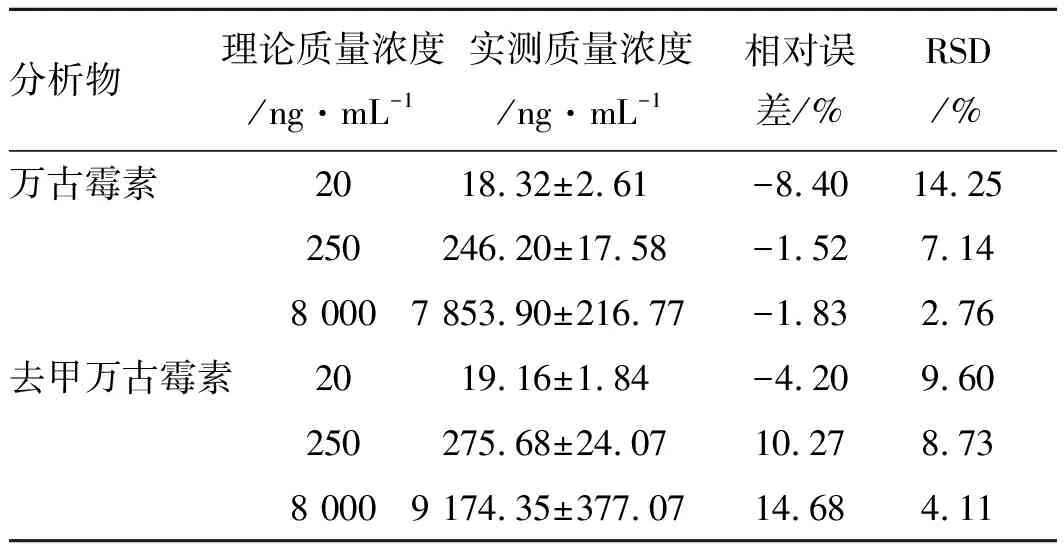
分析物理論質量濃度/ng·mL-1實測質量濃度/ng·mL-1相對誤差/%RSD/%萬古霉素2018.32±2.61-8.4014.25250246.20±17.58-1.527.148 0007 853.90±216.77-1.832.76去甲萬古霉素2019.16±1.84-4.209.60250275.68±24.0710.278.738 0009 174.35±377.0714.684.11
2.2.5基質效應和提取回收率 萬古霉素低、中和高質控樣品的回收率分別為74.16%±8.13%,76.57%±5.73%和76.79%±7.18%,去甲萬古霉素低、中和高質控樣品的回收率分別為73.01%±6.23%,77.71%±5.14%和81.11%±6.86%,符合體內生物樣品分析的要求。萬古霉素和去甲萬古霉素的基質效應分別為98.86%~108.69%和95.97%~109.64%,說明無顯著的基質效應。結果見表4。內標物的回收率和基質效應分別為74.07%±1.24%和118.17%±6.42%。
2.2.6穩定性 萬古霉素和去甲萬古霉素血漿樣品在反復凍融3次、室溫下保存24 h和-80 ℃保存1個月的穩定性結果見表5。結果表明,萬古霉素和去甲萬古霉素血漿樣品在上述條件下穩定。
表3萬古霉素和去甲萬古霉素日間精度度和準確度
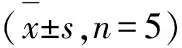
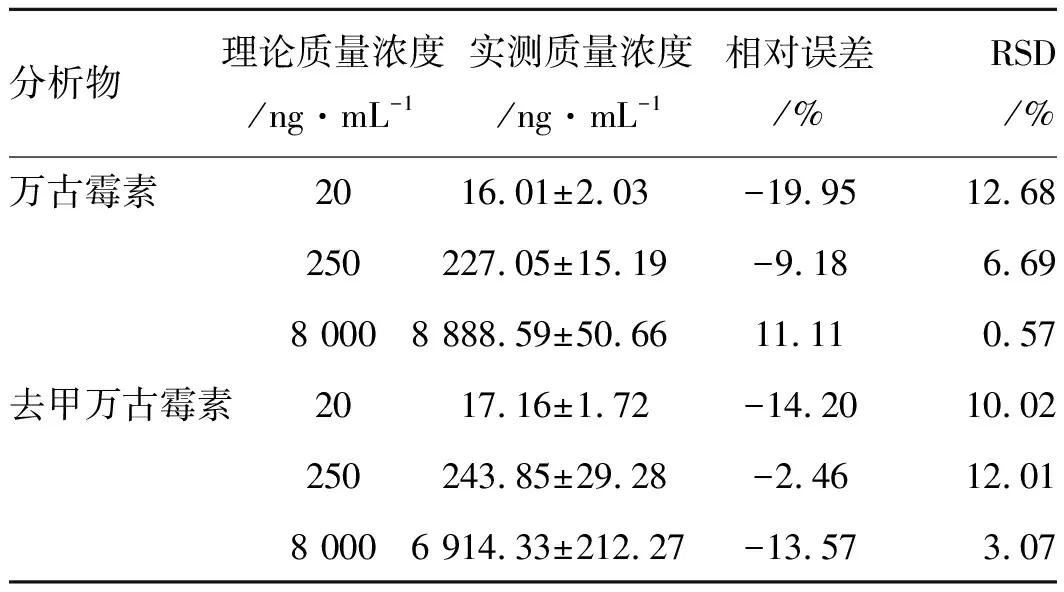
分析物理論質量濃度/ng·mL-1實測質量濃度/ng·mL-1相對誤差/%RSD/%萬古霉素2016.01±2.03-19.9512.68250227.05±15.19-9.186.698 0008 888.59±50.6611.110.57去甲萬古霉素2017.16±1.72-14.2010.02250243.85±29.28-2.4612.018 0006 914.33±212.27-13.573.07
表4萬古霉素和去甲萬古霉素提取回收率和基質效應
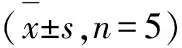
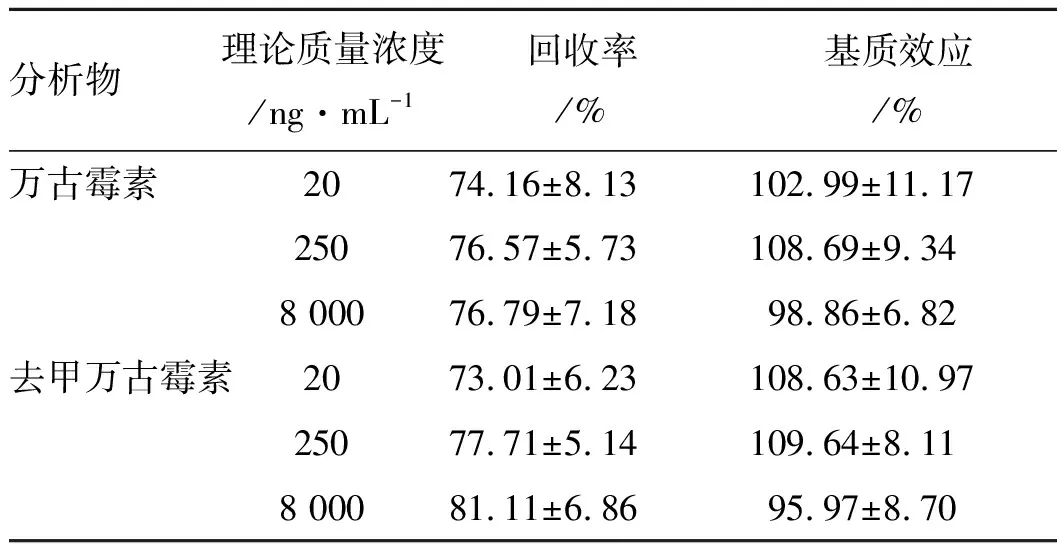
分析物理論質量濃度/ng·mL-1回收率/%基質效應/%萬古霉素2074.16±8.13102.99±11.1725076.57±5.73108.69±9.348 00076.79±7.1898.86±6.82去甲萬古霉素2073.01±6.23108.63±10.9725077.71±5.14109.64±8.118 00081.11±6.8695.97±8.70
2.2.7稀釋效應 血漿稀釋后測定值與理論值進行比較,萬古霉素的相對誤差和RSD值分別為8.41%和8.35%,去甲萬古霉素的相對誤差和RSD值分別為0.20%和1.48%。二者的相對誤差和RSD值均小于15%,結果表明本方法可用于測定質量濃度高于標準曲線上限的樣品。
表5萬古霉素和去甲萬古霉素樣品的穩定性結果
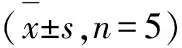
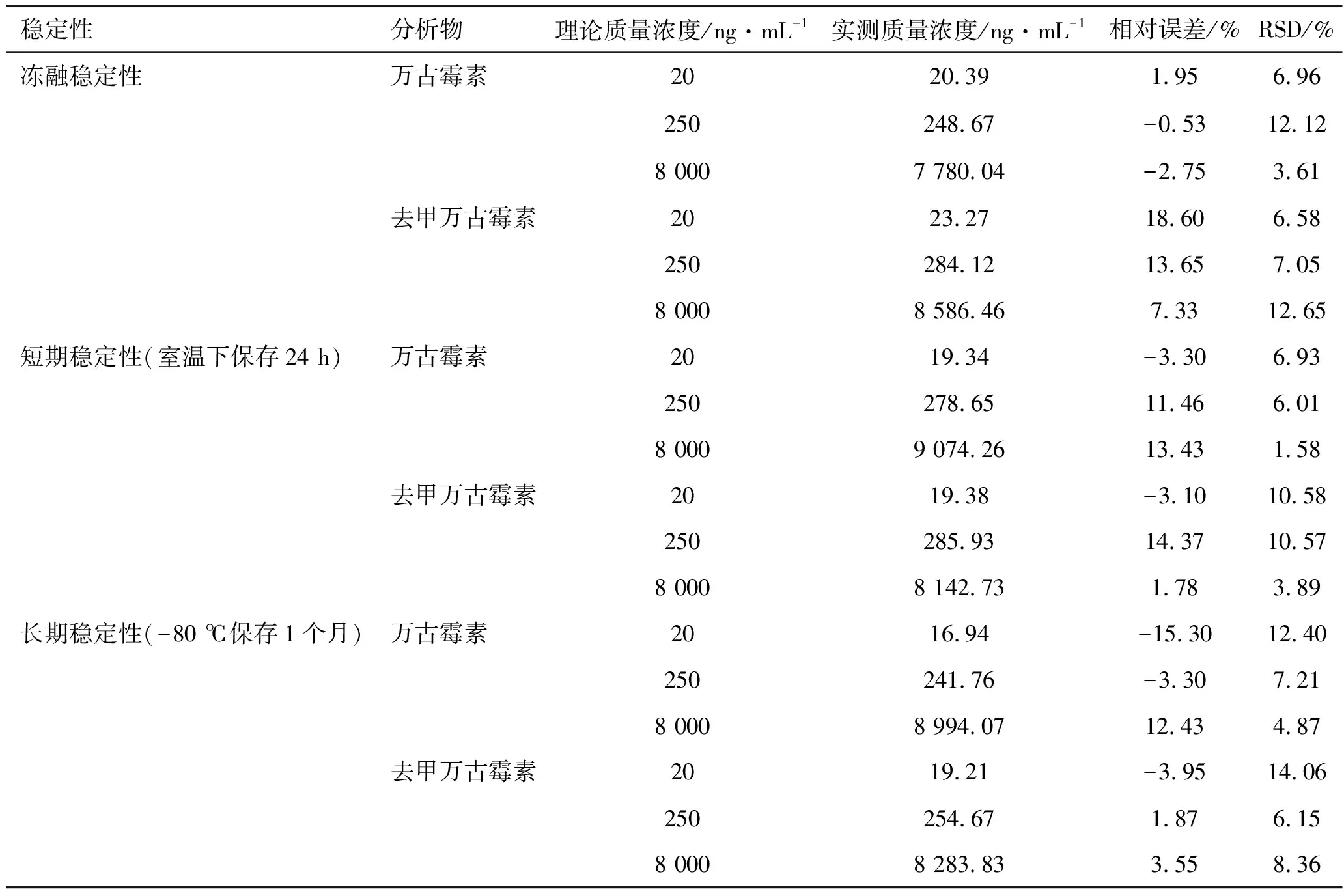
穩定性分析物理論質量濃度/ng·mL-1實測質量濃度/ng·mL-1相對誤差/%RSD/%凍融穩定性萬古霉素2020.391.956.96250248.67-0.5312.128 0007 780.04-2.753.61去甲萬古霉素2023.2718.606.58250284.1213.657.058 0008 586.467.3312.65短期穩定性(室溫下保存24 h)萬古霉素2019.34-3.306.93250278.6511.466.018 0009 074.2613.431.58去甲萬古霉素2019.38-3.1010.58250285.9314.3710.578 0008 142.731.783.89長期穩定性(-80 ℃保存1個月)萬古霉素2016.94-15.3012.40250241.76-3.307.218 0008 994.0712.434.87去甲萬古霉素2019.21-3.9514.06250254.671.876.158 0008 283.833.558.36
2.2.8治療藥物監測應用 對接受推薦劑量萬古霉素和去甲萬古霉素治療的患者進行治療藥物監測,萬古霉素和去甲萬古霉素的穩態谷質量濃度分別見圖4A和4B。52.94%的患者達到萬古霉素的治療窗(10~20 μg·mL-1),33.82%的患者低于治療窗,而13.24%的患者高于治療窗。45.45%的患者達到去甲萬古霉素的治療窗(5~10 μg·mL-1),9.09%的患者低于治療窗,而45.45%的患者高于治療窗。因此,治療藥物監測對確保萬古霉素和去甲萬古霉素療效及降低毒性和不良反應是很有必要的。
圖4接受推薦劑量治療患者的萬古霉素(A)去甲萬古霉素(B)穩態谷質量濃度
Fig.4 Steady state trough concentration of vancomycin (A) and norvancomycin (B) in patients received recommended dose
3 討論
LC-MS/MS法與HPLC法相比,具有靈敏度高、專屬性強、分析時間短的優點。本研究建立的LC-MS/MS法與已有的方法相比有以下優點:①可同時測定萬古霉素和去甲萬古霉素的質量濃度,方法適用性強。②血樣前處理采用簡單的高氯酸沉淀蛋白,與文獻報道的在線樣品萃取和柱切換[10]、乙腈提取樣品后蒸干和復溶后分析[14]等方法相比,樣品前處理簡單、方便和省時。③高氯酸沉淀蛋白后萬古霉素和去甲萬古霉素的回收率為50%,由于分析物在水中的高溶解性,當加入2倍體積的水渦旋后,萬古霉素和去甲萬古霉素的回收率大于70%。④使用梯度洗脫,用反相色譜柱分離萬古霉素、去甲萬古霉素和內源性物質,萬古霉素、去甲萬古霉素和內標的保留時間分別為3.67,3.71和4.62 min。未觀察到顯著的基質效應,說明被測物與內源性基質達到了較好的分離。⑤用利奈唑胺作為內標,相對于用氘代內標,更易獲得,且滿足分析的需求。⑥本方法的定量下限為10 ng·mL-1,可滿足低質量濃度樣本的測定需求。
本研究建立了一種簡單、快速、可靠以及能同時測定人血漿中萬古霉素和去甲萬古霉素的LC-MS/MS法,該方法具有高選擇性和靈敏度,已應用于萬古霉素和去甲萬古霉素治療藥物監測,52.94%和45.45%的患者分別達到萬古霉素和去甲萬古霉素的治療窗,表明治療藥物監測對確保萬古霉素和去甲萬古霉素療效及降低毒性和不良反應很有必要。

